甘肃藜麦霜霉病调查及其病原菌鉴定
王 昶 李敏权 杨发荣 陆建英 魏玉明 吕 玮 赵桂琴
(1甘肃农业大学草业学院,甘肃 兰州 730070; 2甘肃省农业科学院作物研究所,甘肃 兰州 730070;3甘肃省农业科学院,甘肃 兰州 730070; 4甘肃省农业科学院畜草与绿色农业研究所,甘肃 兰州 730070;5国家半干旱农业工程技术研究中心,河北 石家庄 050000)
藜麦(Chenopodium quinoa)是原产于南美洲安第斯山区,具有7 000多年栽培历史的古老作物[1],因其富含全面均衡的营养[2-4]和具有突出的抗逆性[1,5-6]而受到广泛关注,现该作物的种植已突破南美洲传统种植区,扩延至全球[7]。近年来,我国藜麦种植面积不断增加,2019年全国藜麦种植总面积接近1.67万公顷,而甘肃种植面积超过0.6万公顷,居全国之首,占全国藜麦面积的40%[8]。
藜麦霜霉病是危害藜麦最严重的全球性病害之一[9],其破坏性极强,严重影响藜麦生产。该病主要危害藜麦叶片,侵染后叶片褪绿,形成坏死斑,直至脱落,常造成藜麦减产,即使应用抗病品种,仍至少减产30%~50%,当环境条件适宜病害发生时,感病品种减产甚至高达100%[10]。但藜麦霜霉病病原菌的分类鉴定长期存在混乱,最初由于受研究技术限制,研究者仅基于形态学特征将藜麦霜霉病病原菌鉴定为Peronospora farinosa[11]。后来,随着分子生物技术的发展,Choi等[12]基于形态学和分子生物学将其更正为Peronospora variabilis,此后,该结果得到了其他学者的支持[13]。P.variabilis是来自卵菌(Oomycetes)的一种专性活体营养寄生物,属霜霉属(Peronospora)。由于卵菌的生长习性和养分吸收特性与真菌非常相似,之前一直归为菌物界(Fungi kingdom)。后来,考虑到卵菌的遗传和生殖特性及游动孢子形态、rRNA的核苷酸序列,将其归为假菌界(Chromista)[14]。随着我国藜麦种植面积的不断扩大,霜霉病危害日益突出,而国内关于藜麦霜霉病的发生危害、病原菌种类、致病力分化等研究鲜见系统报道。基于此,本研究通过病害系统调查,采集典型病叶,并利用柯赫氏法则、形态学观察和分子生物学方法及室内人工接菌叶盘等技术,明确甘肃藜麦产区霜霉病的发生危害情况、病原菌种类及致病力分化情况,旨在为藜麦霜霉病综合防控奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试病原菌及藜麦材料 藜麦典型霜霉病症状病叶分别采集自甘肃白银干旱区、兰州半干旱区、天祝高寒区、临夏二阴气候区和甘南高寒阴湿区等5个不同生态区,置于装有冰袋的保鲜箱中带回实验室备用。供试藜麦材料为QA065,由甘肃省农业科学院畜草与绿色农业研究所提供。
1.1.2 试剂和仪器 真菌DNA提取试剂盒(D3195-01),美国Omega公司;其余试剂均为国产分析纯。JY600C电泳仪,北京君意东方电泳设备有限公司;A300 PCR仪、Long gene凝胶成像系统,杭州朗基科学仪器有限公司;5425R冷冻离心机,德国Eppendorf公司;ECLIPSE NI生物显微镜、DS-Fi1C显微镜成像系统,日本Nikon公司。
1.2 试验方法
1.2.1 霜霉病调查 2019年7—8月份分别调查甘肃兰州半干旱区、白银干旱区、天祝高寒区、临夏二阴气候区和甘南高寒阴湿区等5个不同生态区藜麦盛花期霜霉病发生危害情况。选择能代表该区典型气候特征的3个村镇进行,每个村镇选取3块地,采用5点取样法,每点调查6株,统计发病植株和病害严重度,记载样点的地理坐标、海拔高度等。严重度采用Mhada等[15]的0~5级病害分级标准(略有变动):0级:无病斑;1级:小而分散的病斑,病斑占叶片面积0%~10%;2级:病斑数量和面积明显增加,病斑占叶片面积11%~25%;3级:病斑呈褐色,叶片背面开始形成孢子,病斑占叶片面积26%~50%;4级:病斑占叶片面积51%~90%;5级:病斑面积大于叶面积90%,叶片正面和背面形成大量孢子。采用三叶法[16]调查病害严重度。按照公式计算发病率和病情指数(disease index,DI):

1.2.2 病原菌形态观察 选取不同生态区藜麦霜霉病典型症状病叶,用拨针挑取病叶背面独立病斑的少许霉层和菌丝,置于载玻片上,用水做浮载剂,盖上盖玻片,置于显微镜下观察病原菌形态,对典型孢囊梗、孢子囊和卵孢子进行拍照,同时测量孢囊梗总长、宽度、孢囊梗末端长、基部宽,孢子囊长和宽、卵孢子直径等指标,统计孢囊梗分枝级别,每个指标测量30个重复。根据形态学特征,参考《真菌鉴定手册》[17]和《中国真菌志·第六卷·霜霉目》[18]等进行初步鉴定。
1.2.3 菌株DNA提取、rDNA-ITS序列扩增 选取与形态观察相同的新鲜病叶,用无菌毛刷轻轻刷下叶背霉层,采用真菌DNA提取试剂盒提取基因组DNA,具体方法参照试剂盒说明书。应用rDNA-ITS通用引物ITS1(5´-TCCGTAGGTGAACCTGCGG-3´)∕ITS4(5´-TCCTCCGCTTATTGATATGC-3´)[19]进行PCR扩增,引物由西安擎科泽西生物科技有限责任公司合成。反应体系共25 µL:Master Mix 12.5 µL,10 µmol·L-1引物ITS1∕ITS4各1 µL,30 ng·µL-1模板DNA 2 µL,ddH2O 8.5 µL。反应程序:95 ℃预变性5 min,95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸40 s,30个循环;72 ℃终延伸10 min;PCR扩增产物经1.0%的琼脂糖凝胶电泳检测后,送西安擎科泽西生物科技有限责任公司测序。
1.2.4 系统发育树的构建 将测序获得菌株的rDNA-ITS序列在GenBank数据库中进行BLAST比对分析,下载同源性较高的rDNA-ITS序列。基于供试菌株和选取藜属植物(Chenopodium sp.)霜霉病菌株的rDNA-ITS序列,采用Mega7.0软件用最大似然法(maximum likelihood,ML)构建系统发育树[20],自举检验次数为1 000次。
1.2.5 致病力测定
1.2.5.1 孢子悬浮液的制备 将上述典型病叶新鲜孢子囊用无菌毛刷刷下,加入5 mL无菌水,用4层无菌纱布过滤,将滤液在显微镜下用血球计数板计数,调至孢子囊浓度为1×105个·mL-1,加入0.1%吐温20,备用。
1.2.5.2 离体叶片接菌测定 将藜麦QA065大田常规种植,选取成株期相同部位健康的叶片,采用叶盘法测定致病力。用70%酒精叶片表面消毒30 s,无菌水冲洗干净,自然晾干,打孔器避开主脉取直径10 mm的叶盘,置于铺有2层无菌滤纸的培养皿中(直径90 mm),每皿置10个叶盘,叶背朝上。每叶盘中央滴20 µL的孢子悬浮液,加无菌水使滤纸湿润,保鲜膜封口。每菌株3次重复,设置1个清水对照。将培养皿置于温度20 ℃、相对湿度85%的人工气候培养箱中,黑暗培养24 h后,用无菌滤纸吸掉叶盘表面液滴,封口后12 h黑暗∕12 h光照交替培养,接种6 d后调查发病情况。病害严重度分级和病情指数统计方法同1.2.1。
2 结果与分析
2.1 霜霉病的发生情况
甘肃白银干旱区、兰州半干旱区、天祝高寒区、临夏二阴气候区和甘南高寒阴湿区等不同生态区霜霉病调查结果见表1。白银干旱区霜霉病平均发病率为19.26%,病情指数为16.67;在兰州半干旱区,随着海拔升高,发病率下降,平均发病率为24.45%,病情指数也依次降低,平均病情指数为21.44;天祝高寒区平均发病率为45.92%,病情指数为40.11;甘南高寒阴湿区,随着海拔升高,发病率和病情指数均依次降低,平均发病率为72.59%,病情指数为69.22;临夏二阴气候区的平均发病率和病情指数最高,分别为83.70%和80.44,该区康乐县八松乡藜麦霜霉病的发病率和病情指数均为所有调查点最高,分别为97.78%和95.00。不同生态区发病率和病情指数的变化趋势完全一致,从高到低依次为:临夏二阴气候区>甘南高寒阴湿区>天祝高寒区>兰州半干旱区>白银干旱区。
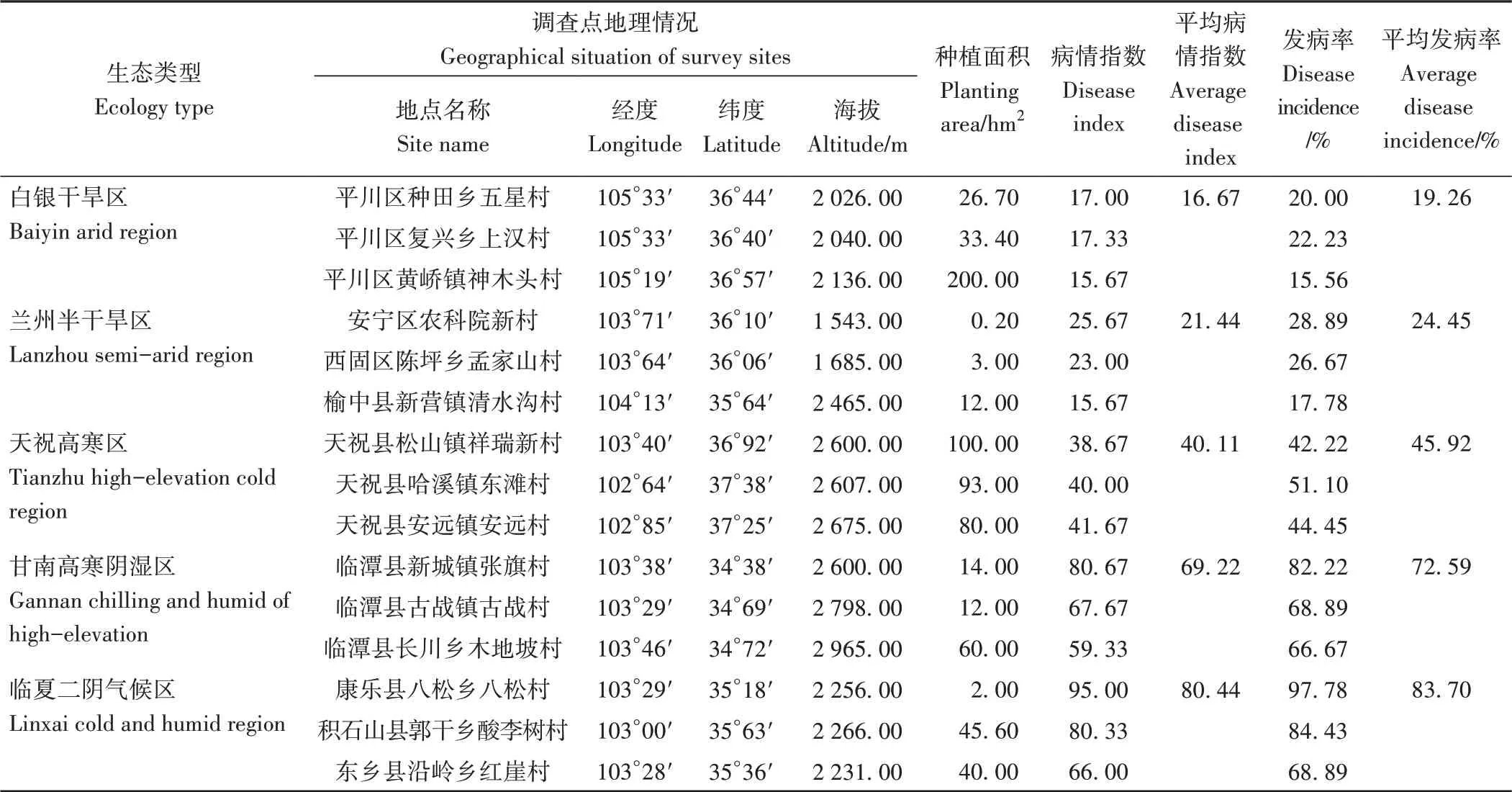
表1 甘肃不同生态区藜麦霜霉病发生情况Table 1 Occurrence of quinoa downy mildew of different ecological regions in Gansu Province
2.2 霜霉病症状
藜麦霜霉病主要危害叶片,也可侵染茎、枝、花序和籽粒,首先从植株下部的叶片开始发病,侵染初期,叶正面出现小而不规则的褪绿坏死斑,因藜麦品种不同,坏死斑呈现黄绿色(图1-A)、浅红色(图1-B)、深红色(图1-C)和紫色(图1-D)等不同颜色。病原菌在叶肉组织中不断生长,破坏叶片机体,阻碍光合作用,当孢囊梗从气孔伸出后,在叶背形成灰色至黑色的绒毛状霉层(图1-E、F)。随着病程的发展,褪绿斑不断聚结、扩展、融合变大,叶片开始变黄、干枯,最终导致脱落,严重影响藜麦的生长发育。

图1 藜麦霜霉病叶片症状Fig.1 Leaf symptoms of quinoa downy mildew disease
2.3 病原菌的形态特征
分别选取甘肃白银平川区、兰州市安宁区、武威市天祝县、甘南州临潭县和临夏州康乐县等不同地区典型霜霉病叶片,菌株分别标记为GSBY(白银干旱区)、GSLZ(兰州半干旱区)、GSTZ(天祝高寒区)、GSLT(甘南高寒阴湿区)和GSKL(临夏二阴气候区),对其形态特征进行鉴定。结果显示,5个菌株形态特征(表2)均与前人报道的藜麦霜霉菌P. variabilis形态特征[12]一致。孢囊梗(图2-A)树形,呈二叉状分支(图2-B),分枝级别为4~7级,孢囊梗长221.71~731.08 µm,宽8.94~12.80 µm;末端弯曲至弧形,末端尖呈钝形,长5.51~27.91 µm,基部宽2.24~5.45 µm;无性生殖产生孢子囊(图2-D~G),其着生于孢囊梗分枝末端(图2-C~E),呈宽椭圆至椭圆形、浅褐色、表面光滑,末端有突出的梗(图2-F、G),呈短圆柱形;孢子囊长20.19~39.02 µm,宽16.01~29.69 µm,长宽比1.00~1.56;有性生殖产生卵孢子(图2-H、I),呈球形,黄褐色、壁双层,表面凹凸不平,直径为22.91~31.57 µm。不同生态区霜霉病菌株除孢囊梗末端基部宽度不显著外,孢囊梗总长和宽度、孢囊梗末端长、孢子囊长和宽、卵孢子直径均存在显著差异(P<0.05)。
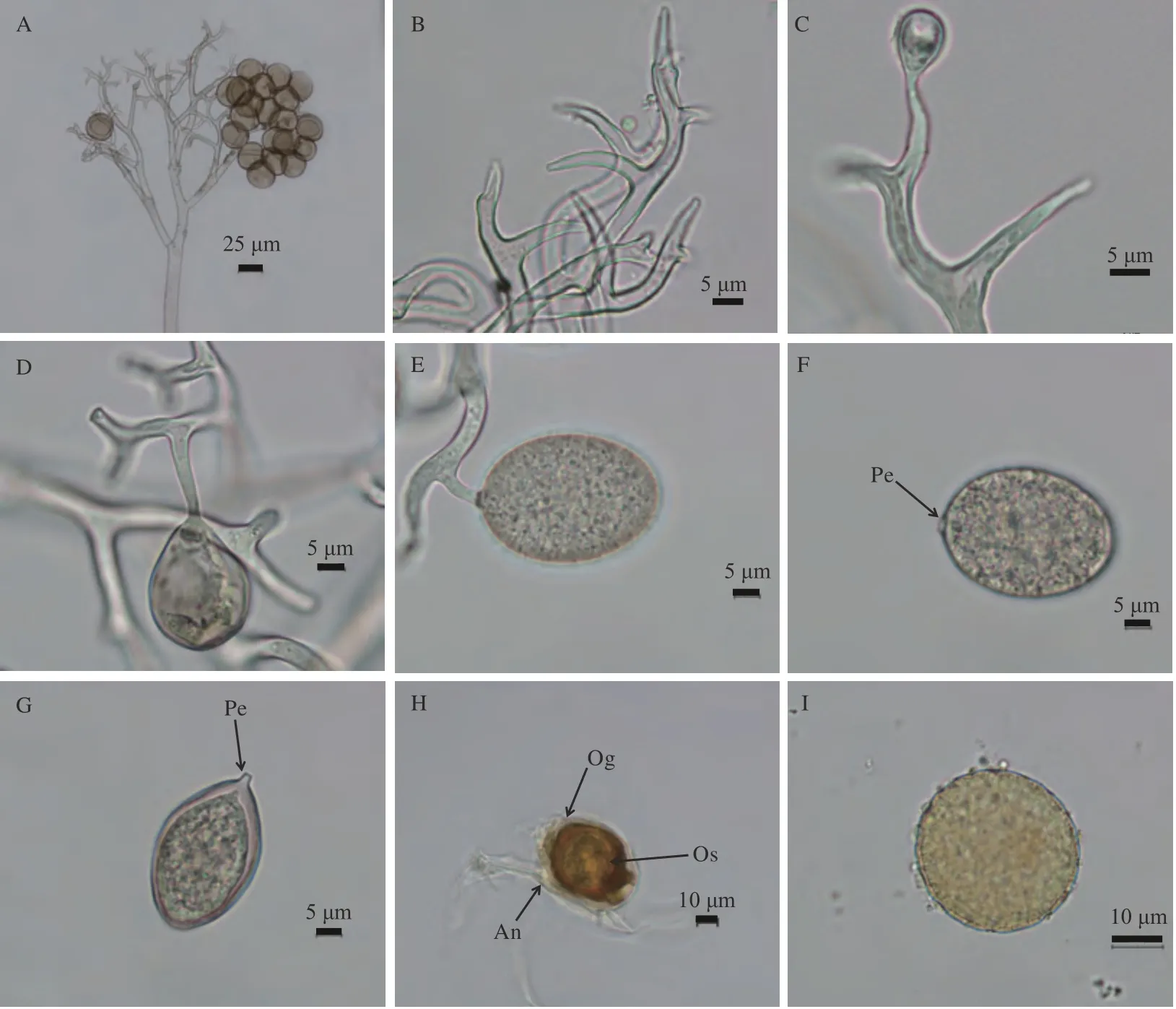
图2 霜霉病病原菌形态特征Fig.2 Morphological characterization of quinoa downy mildew pathogen
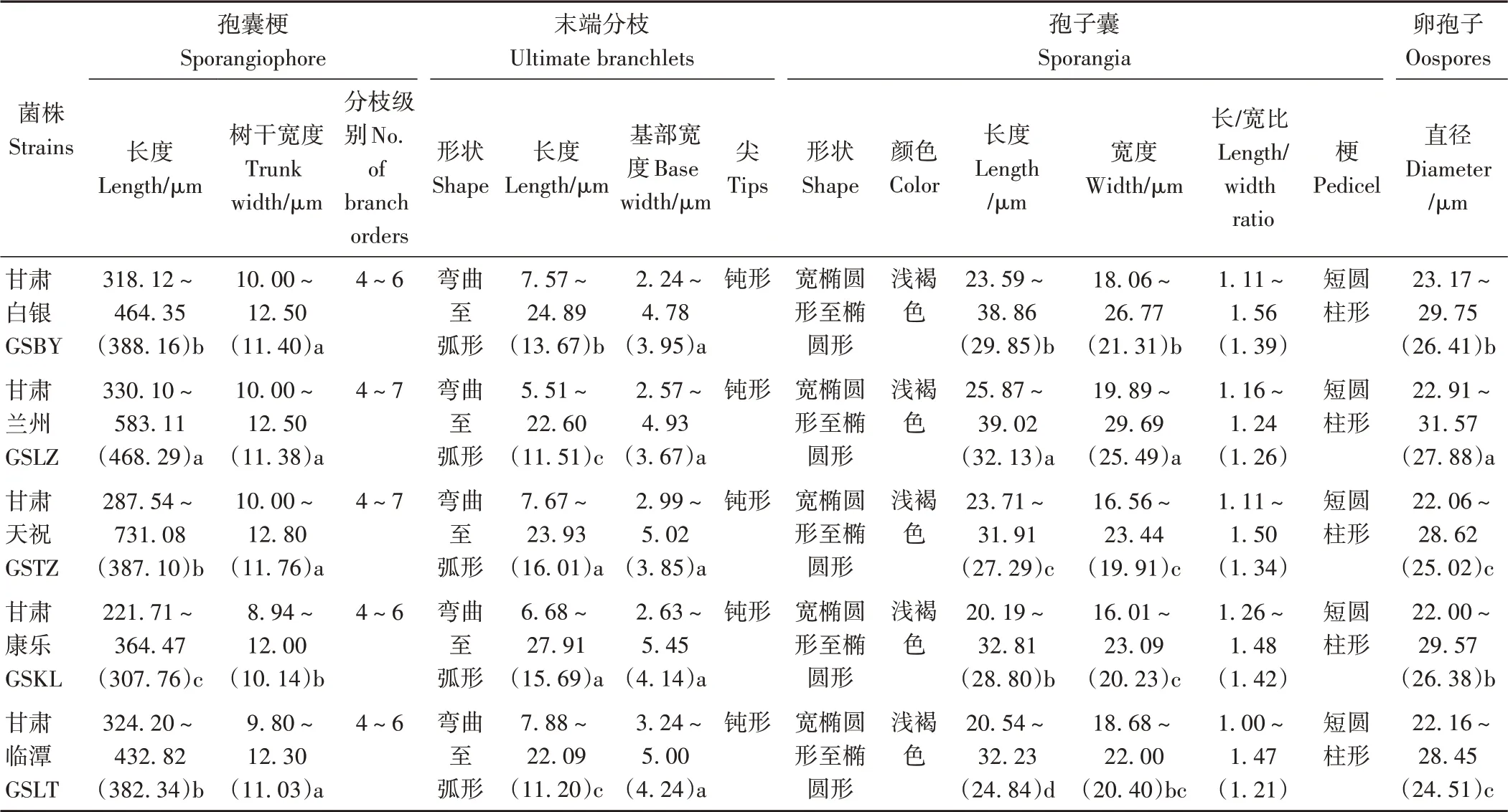
表2 不同生态区藜麦霜霉病菌株形态特征Table 2 Morphological characterization of quinoa downy mildew pathogen from different ecological regions
2.4 病原菌分子鉴定
采用引物ITS1∕ITS4将5株不同生态区代表性菌株rDNA-ITS基因片段进行扩增,产物经琼脂糖凝胶电泳检测,均得到1条约800 bp的清晰条带(图3),测序后得知除菌株GSLZ序列为795 bp外,其余菌株GSBY、GSTZ、GSKL和GSLT等的序列大小均为800 bp。
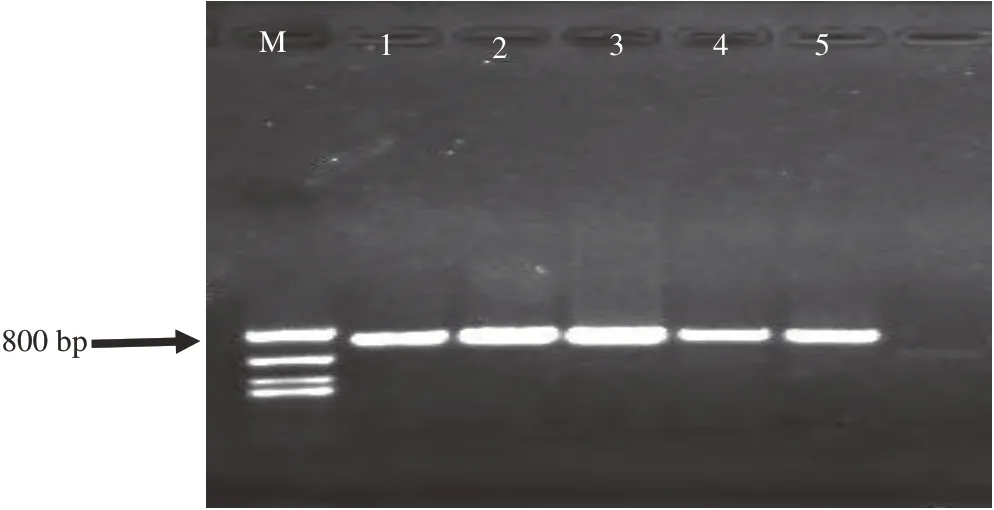
图3 病原菌rDNA-ITS基因片段PCR扩增产物电泳结果Fig.3 Electrophoresis pattern of rDNA-ITS gene fragments of pathogens
将供试菌株GSBY、GSLZ、GSTZ、GSKL和GSLT基因组的ITS序列在GenBank中进行同源性比对,结果显示菌株GSBY和GSLZ均与登录号EF614959和FM863724(寄主都为C. album)的P. variabilis序列的同源性达100%;菌株GSTZ与登录号为KF269605(寄主为C. quinoa)和登录号为FM863719(寄主为C. album)的P. variabilis序列的同源性达100%;菌株GSKL和GSLT 均与登录号为KF269605(寄主为C. quinoa)的P. variabilis序列的同源性达98%。基于供试菌株的ITS序列,比对获取的同源性较高菌株的ITS序列和选取的藜麦(C. quinoa)、藜(C. album)、滨藜(Atriplex patula)及其他藜属植物(Chenopodiumsp.)霜霉病菌株的ITS序列构建系统发育树(图4),结果显示菌株GSBY、GSLZ和GSTZ分别与来自南美洲(厄瓜多尔、秘鲁、阿根廷、玻利维亚)、欧洲(丹麦、西班牙)、北美洲(美国)和亚洲(中国、韩国)寄主为藜麦、藜和藜属植物的P. variabilis以94%的自展率聚为一支。结合形态学和系统发育分析,确定菌株GSBY、GSLZ和GSTZ为P. variabilis。侵染厄瓜多尔、秘鲁、丹麦、韩国藜麦和藜的P. farinosa(P. variabilis的曾用名)与侵染藜麦和藜的P. variabilis同样聚为一支,充分说明侵染藜麦和藜的霜霉菌P. farinosa应更正为P. variabilis。系统发育说明菌株GSBY、GSLZ和GSTZ与来自藜麦、藜和藜属植物的P. variabilis遗传进化关系更近。而菌株GSKL和GSLT以98%的自展率聚为一支,又以87%的自展率与P. variabilis聚为一支。结合形态学和系统发育,确定菌株GSKL和GSLT为P. variabilis。系统发育说明菌株GSKL和GSLT二者的遗传进化关系更近,与其他地理来源的藜属植物的P.variabilis存在地理种群遗传分化。
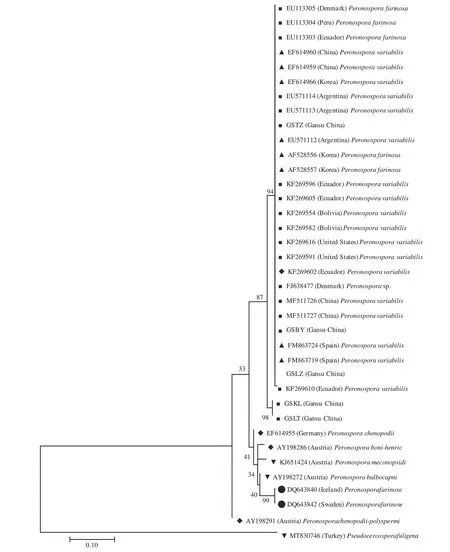
图4 采用最大似然法基于rDNA-ITS序列构建的系统发育树Fig.4 The phylogenetic tree based on rDNA-ITS sequence by maximum likelihood method
2.5 病原菌致病力测定
不同菌株致病力测定结果见图5,菌株GSBY、GSLZ、GSTZ、GSKL和GSLT分别接菌后藜麦叶片均能发病,菌株GSKL和GSLT在接菌后第3天出现明显褪绿斑点,其他菌株在第4~第6天出现褪绿斑(图6)。不同菌株侵染藜麦的病情指数之间差异显著(P<0.05),菌株GSKL的病情指数最大,为90.00,其次为GSLT,为83.33,最低的为GSTZ,为44.67,其他介于二者之间,说明甘南高寒阴湿区和临夏二阴气候区霜霉菌致病力较强。致病力大小依次为菌株GSKL>菌株GSLT>菌株GSBY>菌株GSLZ>菌株GSTZ。对发病叶片的霜霉菌进行形态学观察,确定其与原接种菌株一致,符合柯赫氏法则。
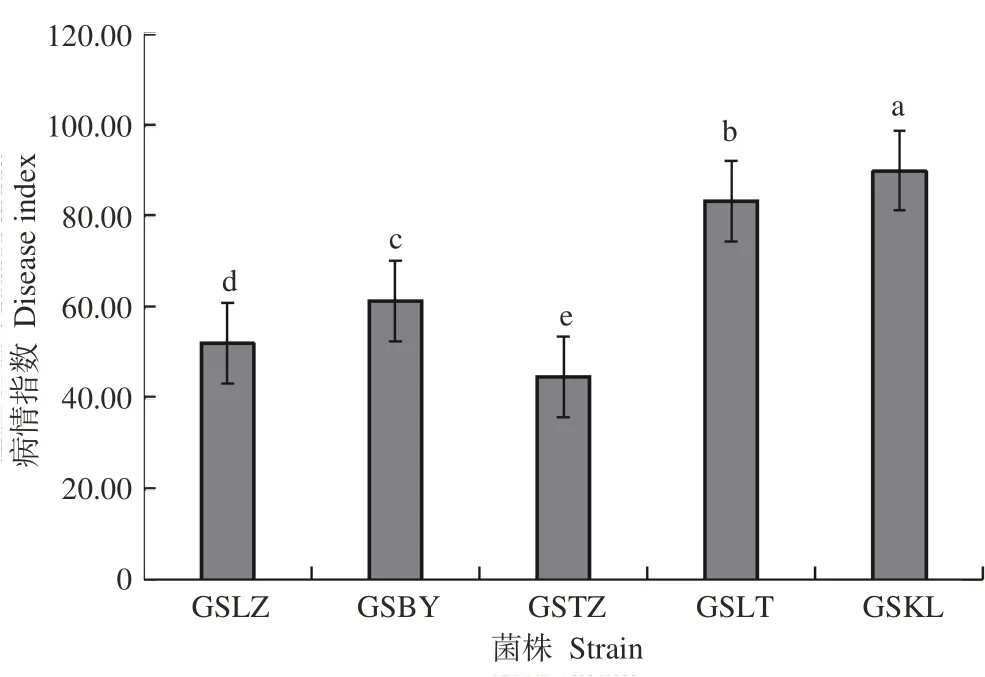
图5 不同霜霉病菌株致病力Fig.5 Pathogenicity of downy mildew pathogen on qunioa

图6 接种不同霜霉病菌株后叶盘的发病情况Fig.6 Disease incidence on leaf discs after inoculated with different strains of qunioa downy mildew
3 讨论
我国藜麦种植面积在逐年增加的同时,霜霉病的发生和危害也在不断蔓延和加剧。本试验调查发现,甘肃藜麦霜霉病发生危害普遍严重,发病率和病情指数分别为15.56%~97.78%和15.67~95.00,局部地方呈爆发态势,但不同生态区差异较大。在调查的所有地区中,临夏二阴气候区霜霉病发生最严重,尤其是康乐县八松乡,发病率和病情指数分别高达97.78%和95.00,该地区气候凉爽,阴湿多雨,极利于病菌的生长;白银干旱区则发病最轻,该地区气候干燥少雨;其余生态区均介于其间。由此可见,霜霉病发生严重程度与当地的气候环境密切相关,多雨潮湿的地区发病重,干旱少雨的地区发病轻。这主要是因为霜霉菌最适生长环境条件为:温度18~22 ℃,相对湿度>80%[21]。分析认为在此条件下叶片气孔通常开放[22],而这利于病原菌孢子的萌发和侵入。鉴于藜麦霜霉病的防治十分困难[20],在今后藜麦种植区域布局中可以减少湿度大的地区的播种面积,适当增加气候偏干燥地区的种植面积。此外,在调查过程中发现,田间微环境同样明显影响病害的发生,种植密度过大,植株冠层相互重叠,造成微环境小气候湿度过大,也会促进病害的发生。因此,在实际生产中,应适当密植,及时排涝,保持田间植株通风透气,从而减轻病害的发生。
病害的调查时期至关重要,恰当的时期能够充分体现病害发生的严重程度。甘肃省农业科学院藜麦研究团队在前期病害调查的基础上发现,藜麦盛花期病害发生严重,为霜霉病盛发期,因此确定盛花期为霜霉病调查的最佳时期。有学者认为花芽分化期是藜麦抗性鉴定最重要和关键时期[23]。本研究确定的调查时期与其存在微小差异,这可能受寄主、气候环境、病原菌特性等多种因素影响。此外,本研究发现藜麦叶片表现出不同颜色的褪绿斑,典型症状呈黄绿色至黄色,少数呈浅红色、深红色和紫色,其颜色主要与藜麦的品种有关,取决于植物的色素种类[24-25],这为今后研究植物色素与病害发生的关系提供了新视角。
病原菌的形态特征是鉴别其归属的重要依据,也是病害鉴别过程中必不可少的环节。本研究发现,甘肃不同生态区病原菌的形态特征与已报道藜麦霜霉病病原菌P. variabilis的形态特征[12,26]一致。孢子囊的长宽比及梗的有无是从形态学鉴别不同藜属植物(Chenopodiumspp.)霜霉属(Peronospora)病原菌的重要特性[16]。本研究中,霜霉病病原菌孢子囊具有短而小的梗,长宽比为1.00~1.56(平均1.21~1.42),这与Choi等[12]对P. variabilis的描述一致。甘肃不同生态区霜霉病菌株孢子囊大小存在差异,这与前人的研究结果相似[12,27],这种差异可能与生长环境、寄主植物、病原菌小种、孢子年龄等有关[28]。rDNA-ITS序列分析是比较藜属近缘物种非常有用的一种工具,常应用于霜霉属近缘种[29]和近亲属内不同菌种的分类和系统发育的研究。本研究基于rDNA-ITS序列的系统发育分析显示,甘肃藜麦霜霉病病原菌与侵染藜麦和藜的P. variabilis聚为一支。结合形态特征和分子生物学将甘肃藜麦霜霉病病原菌鉴定为P. variabilis,这与殷辉等[30]对山西藜麦霜霉病的鉴定结果一致。系统发育分析显示甘肃藜麦霜霉病菌株GSKL、GSLT与GSBY、GSLZ、GSTZ及其他来源的P. variabilis聚为不同分支,说明不同生态区霜霉病菌株之间存在地理种群遗传分化,这与Nolen等[31]的研究结果相似。分析其原因可能是P. variabilis的有性生殖是卵配生殖(Oogamous),存在异宗配合(Heterothallic)现象[32],导致种群发生变异[20]。
本研究发现甘肃藜麦霜霉病不同菌株的致病力之间存在显著差异(P<0.05),尤其是菌株GSKL和GSLT与其他菌株相比表现出强致病力,说明P. variabilis可能发生变异,产生新的毒力基因[33],导致致病力增强,致病力产生分化,这与Ochoa等[34]研究结果相似。藜麦霜霉病P. variabilis种群的变异及致病力的增强,给其防治带来了极大挑战。基于此,后续应该加强P. variabilis毒力的监测,筛选鉴别寄主,构建鉴别体系,加强病害的防控研究工作。但由于P. variabilis是活体营养型病原菌,与其他能够离体培养的病原菌相比,该病原菌的分离培养显得更加困难[35],从而限制了P.variabilis的研究,也给科研人员提出了更大的挑战。
4 结论
甘肃不同生态区藜麦霜霉病发生普遍严重,局部地方呈爆发态势,病害发生与气候环境湿度密切相关;不同生态区病害发生危害严重程度由高到低依次为:临夏二阴气候区>甘南高寒阴湿区>天祝高寒区>兰州半干旱区>白银干旱区;结合形态学和分子生物学,将甘肃藜麦霜霉病病原菌鉴定为P. variabilis,不同生态区P. variabilis的孢子囊和卵孢子大小差异显著;不同生态区P. variabilis菌株之间致病力差异显著,从大到小依次为:菌株GSKL>菌株GSLT>菌株GSBY>菌株GSLZ>菌株GSTZ,不同菌株之间存在地理种群遗传分化。

