二氢杨梅素对间歇低氧大鼠神经系统保护的作用机制
王玲 霍艳慧 张敏 杨馥宇 黄超
(1华北理工大学附属医院,河北 唐山 063000;2遵化市人民医院;3秦皇岛市第一医院)
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)可造成机体损伤,其中神经系统作为主要的靶器官之一〔1〕。OSAHS发病机制为长期慢性间歇性缺氧,缺氧后可引起神经细胞的凋亡进而造成神经系统认知功能的下降〔2〕。活化胱天蛋白酶(Caspase)-9是线粒体凋亡通路的主要凋亡蛋白,激活后可诱导细胞凋亡〔3〕。间歇性缺氧除引起细胞凋亡外,可造成机体氧化应激,是OSAHS机体损伤的另一个重要的病理机制〔4〕。超氧化物歧化酶(SOD)及丙二醛(MDA)是评估机体氧化应激严重程度的重要指标〔5〕。二氢杨梅素(DHM)具有调节细胞凋亡减轻机体氧化应激等多种机制,但在间歇低氧中尚无相关的试验研究,本实验通过观察间歇低氧后及DHM干预后大鼠皮层神经细胞Caspase-9蛋白的表达、细胞的凋亡、SOD活性及MDA含量等的变化,探讨DHM对间歇低氧大鼠神经系统保护作用的机制。
1 材料与方法
1.1主要仪器、试剂 Caspase-9兔抗鼠多克隆抗体、PV6001试剂盒及二氨基联苯胺(DAB)显色试剂盒由北京博尔西公司提供,TUNEL、 SOD及MDA试剂盒由上海奇源生物公司提供。
1.2实验动物及分组 成年Wistar雄性大鼠96只〔动物许可证:SCXK(津)2009-0001〕,采用随机数字表法分为对照(UC)组、5%间歇低氧(IH)组、DHM组,每组又分别分为2 w、4 w、6 w、8 w 4个亚组,每个亚组8只大鼠。
1.3动物模型的制作 5%IH组大鼠低氧箱内首先注入30 s的氮气,流速控制在10 L/min,使氧浓度降至5%,再注入40 s的空气,流速同上,使氧浓度升至21%,在注入50 s的空气,流速降至10 L/min,使氧浓度维持在21%,以上述120 s为周期进行循环。UC组大鼠实验箱持续给予空气注入,使试验箱内的氧浓度为21%,空气流速压力控制在0.8 MPa。DHM组实验大鼠按250 mg/(kg·d)给予DHM灌胃(每日晨起7∶00),灌胃半小时后与5%IH组大鼠一起放入低氧箱内,3组大鼠每日实验时间均为8 h,实验结束后置于相同的饲养环境。
1.4大鼠皮层组织SOD活性及MDA含量的测定 取大鼠皮层组织,进行匀浆、离心后取上清液,整个过程需要在冰浴条件下。应用黄嘌呤氧化酶法对SOD活性进行检测,应用硫代巴比妥酸法对MDA 含量进行测定,严格按照实验试剂盒操作要求进行。
1.5免疫组织化学法检测Caspase-9蛋白的表达 固定后的脑组织经透明、切片等步骤进行制片。切片依次进行脱蜡、脱水、H2O2孵育、高压修复、滴加Caspase-9抗体(1∶500稀释),4℃过夜,滴加二抗等,进行DAB 显色,显色结束后再次进行脱水、透明等,最后进行封片,于显微镜下摄影。
1.6细胞凋亡的测定 TUNEL法:切片进行脱蜡后,依次置于新鲜的H2O2溶液中10 min(室温,浓度为3%),TBS漂洗3次,蛋白酶K工作液20 min(37℃)进行反应,TBS漂洗3次,TUNEL工作液滴20 μl 70 min(湿盒中,37℃)进行反应,TBS漂洗3次,封闭液30 min(37℃)进行封闭,20 μl POD-转化液30 min(湿盒中,37℃)进行反应,TBS漂洗3次,DAB显色、封片等,最后于显微镜下摄影。
1.7统计学处理 采用SPSS20.0软件进行单因素方差分析。
2 结 果
2.1各组皮层组织SOD活性及MDA含量的比较 与UC组比较,5%IH组及DHY组各个时间点MDA含量增加、SOD活性降低,差异均有统计学意义(P<0.05);与5%IH组比较,DHY组各个时间点MDA含量下降,SOD活性升高,差异均有统计学意义(P<0.05)。见表1。
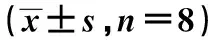
表1 各组皮层组织SOD、MDA含量的表达
2.2各组皮层神经细胞Caspase-9蛋白表达比较 与UC组比较,5%IH组及DHY组各个时间点Caspase-9蛋白表达显著增加(P<0.05);与5%IH组比较,DHY组各个时间点Caspase-9蛋白表达显著下降(P<0.05)。见表2、图1。
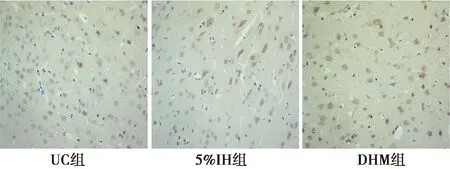
图1 8 w各组皮层神经细胞Caspase-9蛋白的表达(免疫组化,×400)
2.3各组皮层神经元凋亡的变化 UC组各个时间点凋亡细胞较少;与UC组比较,5%IH组及DHY组各个时间点神经细胞凋亡指数显著增加(P<0.05);与5%IH组比较,DHY组各个时间点神经细胞凋亡指数显著下降(P<0.05)。见表2、图2。
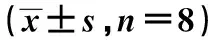
表2 各组皮层神经元凋亡指数及神经细胞Caspase-9蛋白的表达
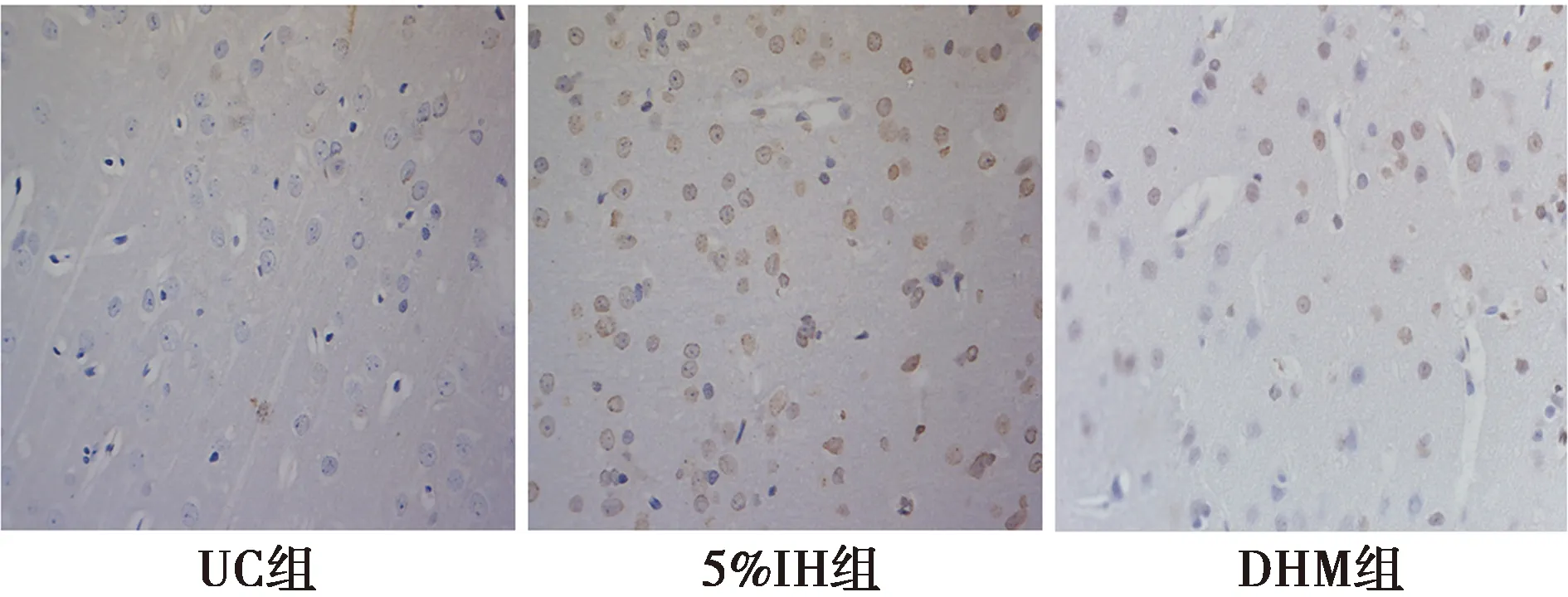
图2 8 w各组皮层神经细胞的凋亡情况(免疫组化,×400)
3 讨 论
OSAHS是呼吸科睡眠障碍性疾病,随着人们生活水平的提高,肥胖、血糖升高等问题越来越严重,导致OSAHS的患病率明显升高。OSAHS危害性巨大,长期的慢性间歇性缺氧可造成多系统损害,如心血管系统、肾脏系统、内分泌系统等,甚至危及生命,严重影响患者的生活及工作。研究已经证实,OSAHS可引起神经系统损伤,影响认知功能等〔6〕。OSAHS引起神经系统损伤的机制众多,其中细胞凋亡及氧化应激是重要的两种致病机制〔7〕。
细胞凋亡是主动性细胞死亡过程,机制复杂多样,主要由线粒体凋亡通路、死亡受体通路等进行调控,其中线粒体凋亡通路为调控凋亡主要的通路,有多种凋亡因子参与,如Bax、Bcl-2、P53、细胞色素C、Apaf-1、Caspase-9等〔8〕。Caspase-9是线粒体凋亡通路中的重要成员,可激活Caspase-3,引起Caspase依赖性的细胞凋亡。动物实验证实,间歇低氧损伤后,可使凋亡蛋白Caspase-9表达增加,进而引起细胞发生凋亡〔9〕。OSAHS患者反复的发生上气道梗阻引起间歇性缺氧,可引起机体发生氧化应激反应。氧化应激可使机体氧化与抗氧化失衡,抗氧化物质增多,产生大量的自由基对机体产生一系列的负面作用。属于金属酶的SOD可及时清除机体过量的自由基,使细胞免受自由基的毒害与攻击,发挥保护作用,因此,SOD活性可评估机体对氧自由基清除的能力。MDA是胞脂中不饱和脂肪酸被自由基氧化后所产生的脂质过氧化产物,脂质过氧化是机体氧化损伤的重要原因,因此测定MDA的含量可反映自由基对机体的损伤严重程度〔10〕。本研究结果显示,5%IH组可引起神经细胞MDA含量、Caspase-9蛋白表达及细胞凋亡指数增加,SOD活性降低,说明间歇低氧损伤可引起神经细胞的凋亡及氧化应激。
DHM广泛存在于葡萄科属植物中,藤茶中含量较多,属于黄酮类化合物,具有抗炎、抗凋亡、抗氧化、抗肿瘤等多种作用〔11〕。研究证实,DHM可通过影响线粒体凋亡通路Caspase-9等的表达进而对小细胞肺癌细胞的凋亡进行调控〔12〕。同样发现DHM通过抗氧化及抗凋亡机制对神经系统损伤发挥明显保护作用〔13〕。本实验结果显示,通过给予DHM干预后,可使神经细胞MDA含量、Caspase-9蛋白表达及细胞凋亡指数降低,SOD活性增加,说明DHM可改善间歇低氧损伤后细胞的氧化应激反应及抑制细胞凋亡。

