单唾液酸四己糖神经节苷脂对DPN大鼠多元醇代谢通路及尾神经电生理变化的影响
任丽敏 何红丽 白玲茹 赵霞
(1南阳医学高等专科学校,河南 南阳 473000;2南阳医学高等专科学校第一附属医院门诊部)
糖尿病周围神经病变(DPN)是糖尿病常见并发症,临床症状以感觉丧失、肌肉萎缩、疼痛等为主,可累及运动、感觉及自主神经,引发坐骨神经结构及细胞受损,造成患者疼痛和神经功能障碍,极大影响其正常工作生活〔1,2〕。糖尿病(DM)体内高糖环境可引发严重的炎症反应,造成坐骨神经轴突变性萎缩、髓鞘紊乱、神经细胞凋亡,在DPN的病理过程中具有关键作用〔3〕;另外高糖还可激活多元醇代谢通路,使神经细胞内多元醇含量明显增加,造成渗透性肿胀,破坏细胞结构完整性,并可促进氧自由基生成,加重炎症反应,也是DPN重要发病机制之一〔4〕。研究发现,单唾液酸四己糖神经节苷脂(GM)1可减轻DPN患者神经炎症,缓解疼痛,改善其临床症状,具有神经保护作用〔5,6〕,本研究探索GM1对DPN大鼠多元醇代谢通路及尾神经电生理变化的影响。
1 材料与方法
1.1材料
1.1.1动物 清洁级雄性SD大鼠:上海茂生衍生物科技有限公司,生产许可证号SCXK(沪)2017-0004,体重180~220 g,饲养在南阳医学高等专科学校第一附属医院动物房中,室内环境安静、通风良好,维持清洁级,温度25℃,相对湿度55%,自然照明。
1.1.2主要试剂及仪器 GM1钠(长春翔通药业有限公司,国药准字H20066833);甲钴胺(北京星昊医药股份有限公司,国药准字H20060865);链脲佐菌素(西安热默尔生物科技有限公司,货号0210055701);苏木素-伊红(HE)染色试剂盒(上海信帆生物科技有限公司,货号G1120-10);大鼠醛糖还原酶酶联免疫吸附试验(ELISA)试剂盒(上海圻明生物科技有限公司,货号YS06433B);大鼠山梨醇ELISA试剂盒(上海江莱生物科技有限公司,货号LCS34521);大鼠白细胞介素(IL)-6 ELISA试剂盒、大鼠肿瘤坏死因子(TNF)-α ELISA试剂盒、果糖测定试剂盒(美国Abcam公司,货号ab100772、ab5603、ab83380);RIPA裂解液、二喹啉甲酸(BCA)试剂盒(上海碧云天公司,货号:P0013K、P0011)等。XElx800酶标仪(Perkin Elmer公司,美国);BIO-EVF3 Von Frey探针(深圳市瑞沃德生命科技有限公司,中国);ZH-YLS-6B智能热板仪(上海珂淮仪器有限公司,中国);RM2016病理切片机(购自上海徕卡仪器有限公司,中国);ECLIPSE CI正置光学显微镜(NIKON公司,日本);肌电诱发电位仪(大化集团有限责任公司,中国)等。
1.2方法
1.2.1动物模型制备及分组给药 参考文献〔7〕中的方法制备DPN大鼠模型:尾静脉注射55 mg/kg剂量的链脲佐菌素溶液,72 h后测量血糖,至少连续2次结果均高于16.7 mmol/L,提示DM大鼠模型建立成功,28 d后以不同标号的Von Frey探针刺激安静状态下大鼠右侧后爪皮肤,记录大鼠嘶吼或缩爪任一行为时Von Frey探针的克数,即缩爪阈值,重复测试5次,中间间隔5 min,取平均值,当其明显降低时,表明DPN大鼠造模成功。共建模64只,成功60只,随机分为5组:模型组、GM1低剂量组、GM1中剂量组、GM1高剂量组、甲钴胺组,每组12只,另取12只SD大鼠,腹腔注射等剂量生理盐水,设定为对照组。
将GM1〔8〕溶于生理盐水,GM1各剂量组以1.0、2.5、5.0 mg/kg的剂量尾静脉注射,同时以与甲钴胺组相同的剂量灌胃生理盐水;将甲钴胺〔9〕溶于生理盐水,甲钴胺组以0.25 mg/kg的剂量灌胃,同时以与GM1高剂量组相同的剂量尾静脉注射生理盐水;对照组与模型组以与甲钴胺组相同的剂量灌胃生理盐水,同时以与GM1高剂量组相同的剂量尾静脉注射生理盐水,1次/d,持续14 d。
1.2.2大鼠疼痛检测试验 结束给药后24 h,进行机械性疼痛刺激试验,检测缩爪阈值;热敏试验:将安静的大鼠放置在温度保持在(44±1)℃的智能热板仪热板上,记录大鼠出现后肢撤回或嘶吼时所用的时间,即为热敏潜伏期,重复测试5次,中间间隔25 min,取平均值。
1.2.3大鼠尾神经电生理变化检测 疼痛检测试验结束后,以肌电诱发电位仪测定大鼠尾神经电生理指标:尾神经根部远端放置刺激电极的阴极,近端放置阳极,相距1 cm,参考电极置于尾尖远端,相距记录电极1 cm,记录电极置于尾尖近端,相距刺激电极阴极14 cm,接地电极置于刺激电极与记录电极之间,在3~6 mA范围内逐渐增加刺激强度,使记录到的神经动作电位达到最大值,测定运动神经传导速度、波幅;将记录电极与刺激电极互换,刺激强度固定于1.2 mA,测定感觉神经传导速度、波幅。
1.2.4大鼠坐骨神经病理变化情况检测及标本收集 电生理检测结束后,使用5 ml注射器经尾静脉取血3 ml,静置10 min,3 000 r/min,4℃,离心15 min,收集上清,获得血清,储存在-80℃冰箱备用;大鼠吸入乙醚麻醉,断头处死,解剖分离右侧后肢坐骨神经组织,取0.5 g剪碎,加入1 ml RIPA裂解液,匀浆,3 000 r/min,4℃,离心20 min,收集上清,获得蛋白样品液,采用BCA法测量总蛋白浓度后,-80℃储存备用;剩余坐骨神经组织以4%多聚甲醛溶液固定、低浓度到高浓度的梯度酒精溶液脱水、二甲苯透明、石蜡包埋后,采用切片机做厚度为2 μm的连续病理切片,经脱蜡、高浓度到低浓度梯度酒精溶液浸泡处理后,做HE染色,参照试剂盒说明书进行,再次进行脱水、透明处理,最后封片,使用光学显微镜观察坐骨神经病理变化,任选5个视野拍照。
1.2.5大鼠坐骨神经醛糖还原酶活性、多元醇(山梨醇、果糖)含量和血清IL-6、TNF-α水平检测 取出1.2.4中的蛋白样品液和血清,置于冰水浴中解冻,以各自试剂盒检测其中醛糖还原酶活性、多元醇(山梨醇、果糖)含量、IL-6、TNF-α水平,具体步骤参照说明书进行。
1.3统计学方法 采用SPSS24.0软件进行方差分析、t检验。
2 结 果
2.1各组机械性痛觉刺激及热敏刺激测定结果 与对照组比较,模型组缩爪阈值及热敏潜伏期明显降低(P<0.05)。与模型组比较,GM1低、中、高剂量组及甲钴胺组缩爪阈值及热敏潜伏期升高,且GM1各组呈剂量依赖性,差异有统计学意义(P<0.05),GM1高剂量组与甲钴胺组差异无统计学意义(P>0.05),见表1。
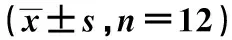
表1 各组缩爪阈值及热敏潜伏期
2.2各组尾神经电生理变化 与对照组比较,模型组运动及感觉神经传导速度、波幅均显著降低(P<0.05)。与模型组比较,GM1低、中、高剂量组及甲钴胺组运动及感觉神经传导速度、波幅均明显升高,且GM1各组呈剂量依赖性,差异有统计学意义(P<0.05),GM1高剂量组与甲钴胺组差异无统计学意义(P>0.05),见表2。
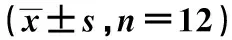
表2 各组尾神经电生理变化
2.3各组坐骨神经病理形态变化 对照组神经纤维排列紧密,结构正常。模型组神经纤维结构混乱,排列松散分离,出现明显的病理损伤。与模型组比较,GM1低、中、高剂量组及甲钴胺组神经纤维病理损伤减轻,且神经纤维组织结构随GM1剂量升高而逐渐恢复正常,GM1高剂量组与甲钴胺组比较,神经纤维病理损伤无明显差异,见图1。

图1 各组坐骨神经病理(HE染色,×200)
2.4各组坐骨神经醛糖还原酶活性 与对照组比较,模型组坐骨神经醛糖还原酶活性显著升高(P<0.05)。与模型组比较,GM1低、中、高剂量组及甲钴胺组坐骨神经醛糖还原酶活性明显降低,且GM1各组呈剂量依赖性,差异有统计学意义(P<0.05),GM1高剂量组与甲钴胺组差异无统计学意义(P>0.05),见表3。
2.5各组坐骨神经多元醇(山梨醇、果糖)含量 与对照组比较,模型组坐骨神经山梨醇、果糖含量显著升高(P<0.05)。与模型组相比,GM1低、中、高剂量组及甲钴胺组坐骨神经山梨醇、果糖含量明显降低,且GM1各组呈剂量依赖性,差异有统计学意义(P<0.05),GM1高剂量组与甲钴胺组差异无统计学意义(P>0.05),见表3。
2.6各组血清TNF-α、IL-6水平 与对照组比较,模型组血清TNF-α、IL-6水平显著升高(P<0.05)。与模型组比较,GM1低、中、高剂量组及甲钴胺组血清TNF-α、IL-6水平含量明显降低,且GM1各组呈剂量依赖性,差异有统计学意义(P<0.05),GM1高剂量组与甲钴胺组差异无统计学意义(P>0.05),见表3。
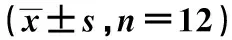
表3 各组坐骨神经醛糖还原酶活性、山梨醇、果糖含量及血清TNF-α、IL-6水平
3 讨 论
DPN是DM患者的一种慢性并发症,可导致其肢体麻木、疼痛、感觉减退,严重时可致残,甚至致死〔10〕。DPN病程进展缓慢,发病机制复杂,与氧的亲和力强的糖化血红蛋白增多,引发血氧降低,造成组织细胞长期缺氧是DPN患者发生神经病变的病理基础〔11,12〕。神经电生理检查运动及感觉神经传导情况,在DPN基础及临床研究中得到了广泛应用,是判定DPN治疗效果的经典检测方法〔13〕。本文结果表明链脲佐菌素诱导的高血糖可损害大鼠坐骨神经组织,造成运动及感觉神经传导受损,并引发疼痛,提示模型建立成功。
大多研究认为DPN的发病与多元醇通路激活、糖基化产物产生、微血管病变、炎症反应、氧化应激等诸多因素有关。醛糖还原酶是多元醇代谢通路中的第一个酶,激活该酶,可促使葡萄糖大量转化为山梨醇,并进一步转化为果糖,积累在神经细胞内,导致产生高渗状态,造成细胞肿胀、破裂〔14,15〕,另外高糖可诱导氧自由基过量产生,促进炎性因子表达,引发严重的炎症反应,最终加重神经组织损伤〔16~18〕。研究发现,GM1是治疗DPN的常用药物,可降低患者炎性因子水平,抑制炎症发生发展,缓解患者感觉异常及疼痛,改善神经传导速度,但其对多元醇代谢通路的影响目前还未见明确阐述〔19,20〕。本文结果表明,GM1可降低炎性因子表达,抑制多元醇代谢通路,减轻炎症,缓解坐骨神经病理损伤,改善神经传导障碍及疼痛,进一步证明了GM1对DPN的临床疗效。
综上,GM1可降低DPN大鼠促炎因子水平,阻止炎症发生及进展,减轻坐骨神经组织炎症损伤,缓解疼痛,改善坐骨神经运动和感觉传导功能,抑制多元醇代谢通路可能是其药理机制之一,但未对调控多元醇代谢的分子信号进行探讨,需进行后续深入探究。

