粘度刺激响应的荧光探针研究进展
王孔琛, 冯杨振, 陈杜刚
(武汉工程大学,化工与制药学院,湖北武汉 430205)
1 引言
细胞微环境与细胞的新陈代谢,增殖分化等密不可分,是反映细胞生理活动是否正常进行的重要因素[1,2]。粘度作为细胞微环境的重要指标之一,影响着细胞内分子扩散、信号传递以及化学物质的运输。粘度的异常变化常预示着细胞的功能发生障碍,从而诱发一系列疾病。同时,由于细胞内细胞器的作用不一,细胞内各区域的粘度也不尽相同。线粒体作为细胞内部的“动力车间”,除了给细胞供能以外,还参与诸如细胞分化、细胞信息传递和细胞凋亡等过程,并具有调控细胞生长和细胞周期的功能[3]。研究表明,粘度的异常变化可能导致线粒体功能失调,并导致一系列症状,例如动脉硬化、癌症和心机能不全[4 - 6]。溶酶体是细胞内部的“消化车间”,其作为一种动态的细胞器,参与老化细胞器的清除、杀死病毒和病变以及细胞内信号的传递等等生理活动,对维持细胞内环境稳态有重大意义[7]。溶酶体粘度的异常可能导致细胞微环境紊乱,从而影响生物正常生理活动,引起炎症甚至癌症等疾病。因此,精确监测细胞内不同部位的粘度变化,以揭示粘度与疾病的病理过程之间的微观机理,对于疾病的探索极其重要。
传统的粘度检测工具包括落球粘度计、振动式粘度计、旋转式粘度计和毛细管粘度计,但是这些工具只能用于宏观粘度的检测,而不适用于微观环境。近年来,荧光成像因具有灵敏度高、侵入性小,时间分辨率好等优点而被研究者们广泛关注,并大量用于细胞内活性分子的检测、活体成像和成像引导的光疗等领域。根据现有研究,开发对细胞内粘度有特异性响应能力的荧光探针,通过荧光成像的方式实时反映并跟踪粘度的变化,是监测细胞内粘度变化的有效手段。本文将从荧光探针的设计结构和机理出发,主要介绍近5年来报道的部分靶向不同细胞器的粘度荧光探针,并探讨结构-性能关系和生物成像应用。最后就该领域的现状做出总结并对未来的发展提出展望,希望对开发性能更好的荧光探针用于细胞微环境粘度的探测提供参考。
2 粘度荧光探针简介
2.1 粘度荧光探针的结构
常见的荧光团如香豆素类、萘酰亚胺类、罗丹明类、BODIPY类、花菁类、黄酮类和喹啉类等,它们具有诸多优异的光学性质,如光谱半峰宽较窄、摩尔消光系数大和荧光效率高,因而常被用来构建粘度刺激响应的荧光探针。这些染料分子大多是平面共轭性好的亲脂性基团,由其所构建的荧光探针具有良好的脂溶性。为了提高探针的亲水性,并赋予探针特定的细胞内靶向功能,通常在荧光染料上引入吡啶/三苯基膦阳离子或吗啉基团等,可使探针分别定位到线粒体和溶酶体,并提高探针的生物相容性。
2.2 粘度荧光探针的识别机理
2.2.1 扭转的分子内电荷转移(TICT)从分子结构来讲,大多粘度响应的荧光探针都是电子给体-共轭π桥-电子受体(D-π-A)型。当分子中的D和A非常强,且分子有一定的柔性时,在激发态下,分子内旋转导致D和A处在正交的构象上,从而发生扭曲的分子内电荷转移(TICT)作用,使得探针的荧光猝灭。而当细胞环境发生变化,如粘度升高时,分子内的运动会受到限制,从而抑制TICT,恢复探针的发光。由于粘度变化的幅度不同,荧光恢复的程度不一,据此实现对粘度的特异性识别。
2.2.2 聚集诱导发光(AIE)与传统荧光染料不同,AIE分子在单分散态下不发光,而在聚集态下显现出强荧光。这种独特的发光模式使得该类型分子在聚集态下具有高的荧光亮度和优异的光稳定性,非常有利于其在生物环境的应用。在低粘性介质中,AIE分子内基团的自由运动耗散了激发态的能量,使得分子不发光;而当粘度升高时,分子内的运动受限,从而开启荧光,因此可实现对粘度的检测。
2.2.3 光致电子转移(PET)该种类型的荧光探针一般由荧光染料和受体部分组成,在光激发下,荧光染料和受体之间会发生电子转移作用,从而导致荧光发生猝灭。当荧光探针与目标分析物作用后,受体部分被破坏或者从分子中裂解,则可恢复荧光染料的荧光。当所选的荧光染料本身对粘度有灵敏的响应时,依据此机理可设计同时检测粘度和其它分析物的多功能荧光探针。
3 粘度荧光探针的应用
3.1 检测细胞质内粘度的荧光探针
香豆素类染料具有Stokes位移大、光稳定性好、生物相容性好等优点。2020年,本课题组将茚二酮与二乙胺香豆素基团共轭连接合成了近红外荧光探针ACI[8]。在低粘度环境下,茚二酮与二乙胺香豆素之间单键的自由旋转引起TICT现象,导致荧光猝灭(图1);而随着环境粘度的增加,单键的旋转受到抑制,从而使得分子的荧光增强。我们通过探针ACI检测了经制霉菌素干预的HeLa细胞环境的粘度变化。实验结果显示,ACI的光稳定性和生物相容性好,同时具有长的激发波长和发射波长,在活体成像中应用时有望表现出高的信噪比。2017年,孟祥明课题组设计合成了以喹啉为骨架的双光子荧光探针MCN(图1)[9]。该探针在470 nm处荧光强度随着粘度的增大而增强90倍,且不受pH、极性的影响。该课题组通过MCN监测了经依托泊苷诱导的HeLa细胞凋亡期间的粘度变化,并通过荧光寿命成像观察了大鼠组织切片以及斑马鱼的粘度分布情况。
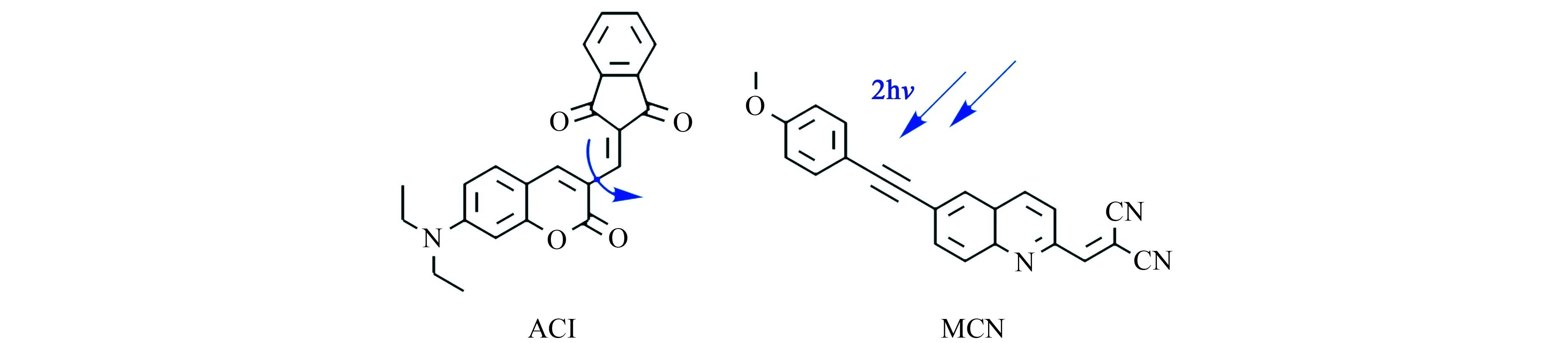
图1 探针ACI和MCN的结构[8,9]Fig.1 Structure of probes of ACI and MCN[8,9]
3.2 检测线粒体内粘度的荧光探针
线粒体基质中存在大量的酶和蛋白质。当环境粘度异常变化时,线粒体嵴将会发生堆积[10],影响酶和蛋白质扩散的速率,最终导致神经退行性疾病、糖尿病和细胞恶性肿瘤等多种症状的发生[11 - 14]。因此,对线粒体内的粘度进行监测意义重大。
菁类染料一般具有长发射波长,且分子中有阳离子基团如吲哚盐,能有效地定位在线粒体,常被选用来构建靶向线粒体的荧光探针。2019年,王慧课题设计合成了基于半花菁染料的水溶性荧光探针L(图2)[15],分子中引入二乙酸酯基团以提高生物相容性,并可以通过对该部分的细微调节使得发射光谱红移。随着溶液粘度的增加,L在590 nm处荧光强度增大23倍,同时荧光量子产率增大20倍。课题组通过L成功观察了老鼠组织切片的粘度分布情况。2020年,葛健锋课题组基于半花菁染料设计合成了三个定位线粒体的粘度探针1d-1f(图2)[16]。相比于探针L,1d-1f的发射波长红移至近红外区间(652~690 nm),在生物领域应用时具有光损伤小,背景干扰小的优点。
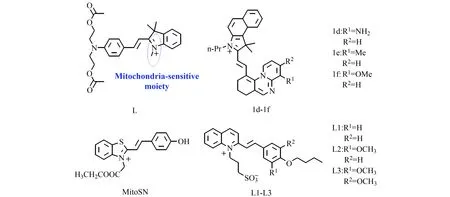
图2 探针L、1d-1f、MitoSN和L1-L3的结构[15 - 18]Fig.2 Structure of probes of L,1d-1f,MitoSN and L1-L3[15 - 18]
除了吲哚阳离子之外,其它含阳离子的结构也能靶向线粒体。2018年,王慧课题组报道了以噻唑阳离子作为线粒体定位基团的粘度荧光探针MitoSN(图2)[17]。该探针已成功应用于观察活体斑马鱼幼虫的微粘度。2019年该课题组又制备了一系列以喹啉阳离子为受体的荧光探针L1-L3(图2)[18]。与MitoSN相比,L2、L3对粘度表现出了更高的敏感性,其中,L2在576 nm处荧光强度随着粘度增强180倍,荧光量子产率增大280倍。L1-L3已经成功用于监测经药物刺激后HeLa细胞中粘度的变化。
2019年,刘志洪课题组设计合成了近红外荧光探针NI-VIS(图3a)[19]。NI-VIS对粘度具有很高的灵敏度,随着体系环境由水变为99%甘油,其荧光强度增大167倍。该探针已成功用于区分肝硬化组织与正常组织。2021年,唐波课题组基于吡啶阳离子构建了线粒体靶向荧光探针Mito-NV(图3a)[20]。该课题组以Mito-NV为工具发现环境中存在过量的H2O2会使得粘度上升,而过量的阳离子如Pd2+,Cu2+会使得粘度下降。
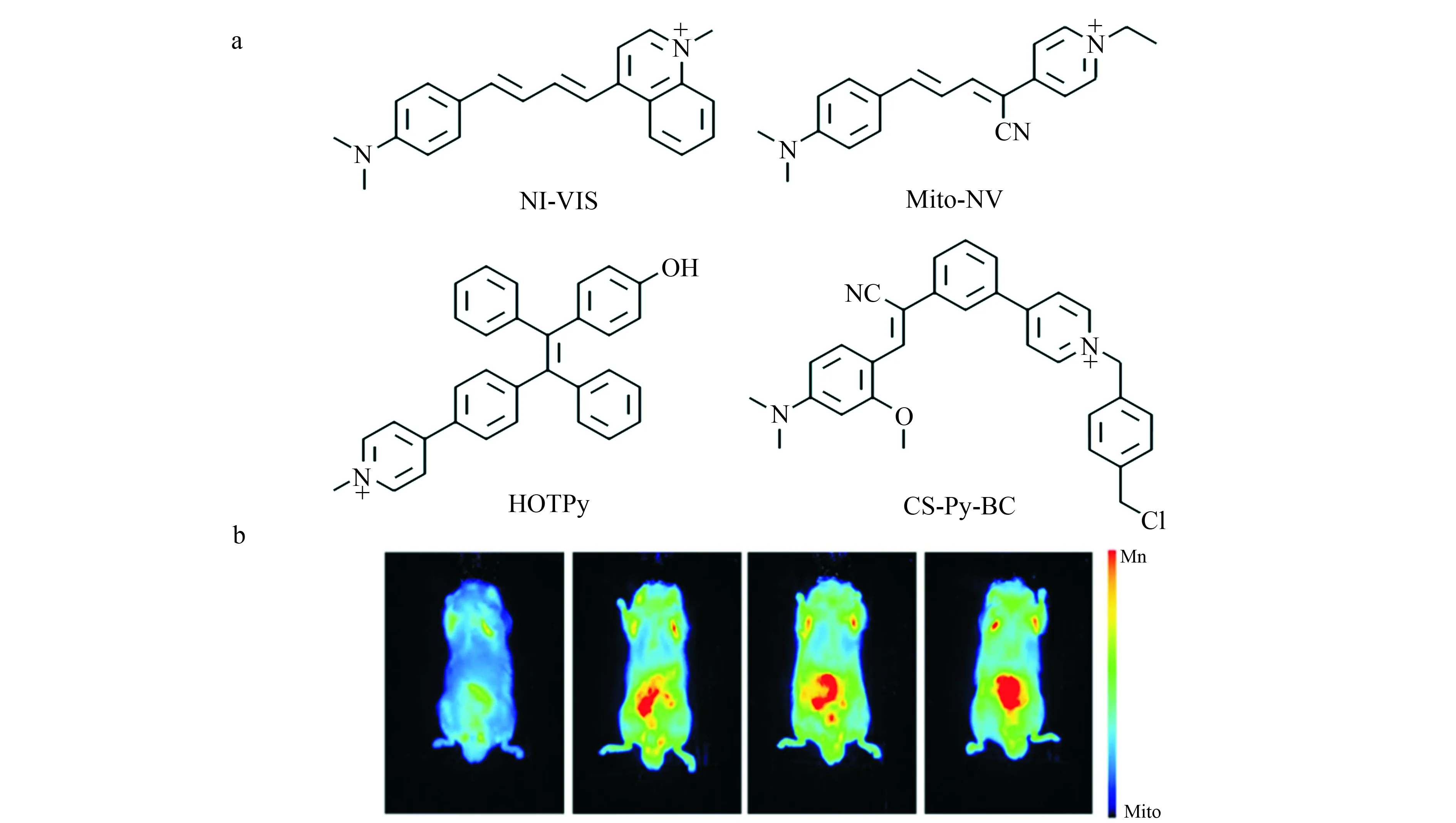
图3 (a)探针NI-VIS、Mito-NV、HOTPy和CS-Py-BC的结构[19-22];(b)由左至右:HOTPy在对照组小鼠、经酒精干预后1天、2天、3天的小鼠体内生物成像[21]Fig.3 (a) Structure of probes of NI-VIS,Mito-NV,HOTPy and CS-Py-BC[19-22];(b) From left to right:In vivo imaging of mice in control group and mice with alcohol treatment in 1,2 and 3 days with HOTPy as the fluorescent probe[21]
上述的探针多数都是基于TICT机理构建的,但该类探针容易受到环境极性的影响,或是环境中存在的亲电物质可能会破坏探针D-A结构导致探针功能失效。近些年来聚集诱导发射(AIE)由于其具有较大的Stokes位移,优异的光稳定性而逐步进入了研究人员的视野。2021年,本课题组基于荧光团四苯乙烯设计合成了AIE粘度探针HOTPy(图3a)[21]。通过结构筛选发现,分子中引入助水溶性基团羟基,能有效提高HOTPy对粘度的选择性。随着环境粘度的增大,探针在611 nm处的荧光强度增大128倍。该探针已经成功用于急性酒精肝损伤小鼠模型的成像,以及经SILY治疗后,该病症变化的即时示踪(图3b)。
为了增加探针在线粒体内的滞留能力,2021年,董川课题组在分子内引入苄基氯亚基制备了探针CS-Py-BC(图3a)[22],使得当膜电位降低或消失时探针也不会失去对线粒体的靶向性,从而有效提高了检测的准确度。经470 nm波长激发,CS-Py-BC在650 nm处的荧光强度随粘度增大了92倍。
3.3 检测溶酶体内粘度的荧光探针
溶酶体内含有丰富的水解酶,主要用于分解和代谢细胞内的蛋白和大分子。当外界物种进入溶酶体后,溶酶体内的水解酶会发挥作用将外来物种分解为细胞所需的物质。溶酶体内水解酶缺失或其功能发生异常变化时将会引起大量底物在溶酶体体内堆积,使得溶酶体内部粘度发生变化,最终导致各种疾病的发生,例如溶酶体贮积病、庞贝氏病、粘多糖疾病等。因此,对溶酶体粘度的变化进行检测同样具有重要的意义。
溶酶体是细胞微环境中酸度最高的细胞器,有与碱性物质结合的倾向,故常选用含有氨基的碱性吗啉作为溶酶体的靶向基团。2018年,黄楚森课题设计合成了一个基于绿色荧光蛋白GFP的粘度探针Lys-V(图4)[23]。该探针引入了对羟基苯甲醛以增大体系的共轭程度。研究发现该探针在515 nm处荧光强度与粘度之间存在良好的线性关系。并已经成功检测了经地塞米松刺激后MCF-7细胞中溶酶体粘度变化。
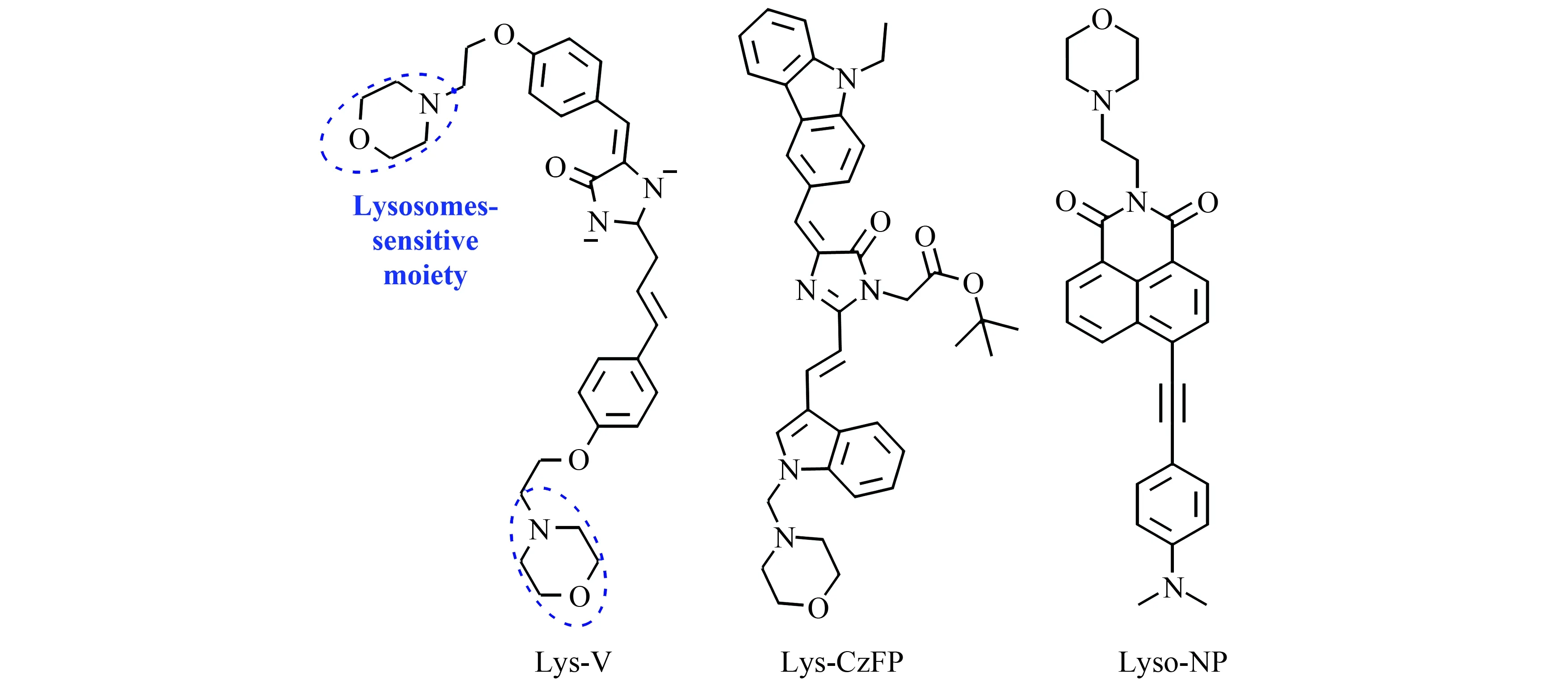
图4 探针Lys-V、Lys-CzFP和Lyso-NP的结构[23 - 25]Fig.4 Structure of probes of Lys-V,Lys-CzFP,and Lyso-NP[23 - 25]
2020年,钱鹰课题组报道了选用咔唑基团为单元合成的GFP粘度荧光探针Lys-CzFP(图4)[24]。该探针具有较长的发射波长(560 nm)与较大的Stokes位移(78 nm),同时具有优异的粘度响应能力。探针Lys-CzFP在560 nm处荧光强度随着粘度增加了98倍,荧光量子产率从0.003增至0.253,荧光寿命由0.25 ns延长至1.12 ns。Lys-CzFP已成功用于检测经地塞米松刺激后Bel-7402细胞内溶酶体粘度的变化。
上述探针虽然有着优异的光稳定性与较好的粘度响应,但是仍然存在着诸如激发和发射波长较短,穿透能力不够,且易受到自荧光影响等问题。双光子荧光成像因激发波长更长,能够避免自荧光的干扰,同时具有更深的穿透效果,有望解决上述问题。2020年,孟祥明课题组以苯乙炔取代的萘胺基为TP荧光团合成了双光子探针Lyso-NP(图4)[25]。该探针在515 nm处的荧光强度与粘度之间有着良好的线性关系,且在860 nm处的双光子吸收截面值随着粘度的增加而增大。此外,探针的荧光寿命不随pH而变化,可以通过荧光寿命成像来对环境的粘度进行检测。
BODIPY类染料一般能系较低,很容易表现出长波长的信号。2018年,余孝其课题组基于BODIPY结构设计合成了双光子荧光探针Lyso-B(图5)[26]。该探针在环境pH<5时才会对粘度产生响应。在pH较高时,吗啉基团因PET的机理猝灭了探针本身的荧光,而pH降低时,吗啉基团被质子化,PET过程消失,探针的荧光开启。经实验发现,pH=2时,探针在甘油中的荧光强度比在水中高63倍,而比在pH=7.4的水高15 600倍。目前,Lyso-B已成功用于HeLa细胞中溶酶体的粘度检测,Lyso-NP已经成功用于MCF-7细胞内溶酶体自噬过程的粘度检测。
除了吗啉基团之外,一些科研工作者还尝试通过其它的基团来构造靶向溶酶体的荧光探针。2019年,郭炜课题组基于罗丹明染料设计合成了近红外荧光探针BTP(图5)[27]。随着粘度的增加,苯并噻唑与吡罗红之间的碳碳单键的旋转被抑制,BTP在635 nm处的荧光强度增大83倍。此外,BTP能在较宽的pH范围(pH=2~10)内对粘度响应,具有优异的稳定性。2020年,曾宪顺课题组开发了半花菁近红外荧光探针Lyso-cy(图5)[28]。该探针通过苯基硒定位溶酶体,并具有更高、更快速的粘度响应,在710 nm处的荧光强度随着粘度的增加而增大122倍。在不同pH中,Lyso-cy的结构存在酚式、旋酮式、酮式之间转换,因此发射波长会随着pH而变化。目前该探针已经成功监测经地塞米松刺激的HeLa细胞中溶酶体的粘度变化。
2020年,蒋健晖课题组设计合成了一个靶向溶酶体的探针Lyso-VR1(图5)[29]。随着环境粘度增加,Lyso-VR1在550 nm处荧光强度增大83倍。此外,该探针不受极性影响,能在pH=4~7.3的范围内使用。值得一提的是,课题组通过Lyso-VR1与其同期研发的Mito-VR2首次实现了自噬过程中线粒体和溶酶体粘度变化的同时监测,发现此过程中两者内部粘度都增加。
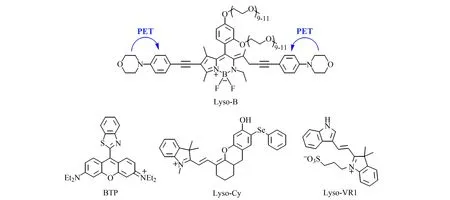
图5 探针Lys-B、BTP、Lyso-cy和Lyso-VR1的结构[26 - 29]Fig.5 Structure of probes of Lys-B,BTP,Lyso-cy and Lyso-VR1[26 - 29]
4 多功能的荧光粘度探针
许多疾病导致的细胞微环境的变化不仅仅与粘度相关,还可能与许多化学物质水平的变化相联系,能够实现对这些化学物质含量的检测对疾病的预防与临床治疗具有重大意义。因此除了上述能够单独靶向线粒体或者溶酶体的探针,科研工作者还设计合成了许多多功能型的水溶性粘度探针。
2020年,冯国强课题组基于喹啉设计合成了粘度与ONOO-双重响应的近红外荧光探针VO[30]。该探针的粘度响应基于TICT机理,并引入了苯硼酸作为ONOO-的识别基团(图6a)。随着环境粘度的增大,770 nm处的荧光强度增大36倍;当ONOO-加入后,探针颜色由蓝色转变为黄色,635 nm处荧光强度增大288倍,且在5 min内达到最大值。VO不受其它活性氧或活性氮等的干扰,能在pH=6~11的范围内使用。同时,VO还可以检测内源性与外源性的ONOO-,目前已经在斑马鱼和小鼠体内成功应用。课题组通过VO进行生物实验发现过量的对乙酰氨基酚(APAP)会引起ONOO-含量增多,导致药物诱导的肝毒性增加(图6b)。

图6 (a)探针VO和A-1的结构[30-31];(b)探针VO在小鼠肝组织上的成像[30]Fig.6 (a)Structure of probes of VO and A-1[30-31];(b) Imaging of the mouse livers with VO[30]
2021年,Lee课题组设计合成了粘度与NO双重检测的探针A-1[31]。该探针中萘酰亚胺及其连接部分能够对粘度产生响应,而(4-硝基苯)氨基硫脲部分则对NO产生响应(图6a)。探针A-1在470 nm处与550 nm处的荧光强度分别随着粘度的升高、NO含量的增加而增强。该探针对粘度的响应荧光为蓝光,对NO的响应荧光为绿光,因此实现了对粘度与NO的同时检测。探针A-1不受诸如Cu2+、Mg2+等阳离子,CN-、S2-等阴离子以及ONOO-、OH-等活性氧物质的影响,能在pH=5~9范围内使用。此外,探针A-1可以检测细胞内外源性/内源性的NO,且课题组通过将A-1应用于HeLa细胞中成功观察到了制霉菌素刺激后粘度的升高、LPS刺激后NO水平的升高以及再经过NO合成酶抑制剂氨基胍干预后NO水平的下降。
除了活性氧之外,对于细胞微环境内含硫物质的含量监测也同样十分重要。2020年,孔凡鹏课题组在已经合成的近红外粘度探针DCMN的基础上进一步对其羟基位点进行修饰,连接了H2S靶向基团2,4-二硝基苯磺酸酯,构建了一种H2S和粘度双激活的荧光探针DCO-V-H2S(图7)[32]。该探针中,2,4-二硝基苯磺酸酯通过PET作用猝灭探针本身的荧光;尽管在高粘度甘油中探针的荧光信号有一定的增强,但并不明显。而当在甘油环境中加入H2S时,2,4-二硝基苯磺酸酯基团发生断裂,探针的荧光则显著增强,因此该探针只有在硫化氢和高粘度条件同时满足时才能被激活,发出近红外荧光。在cH2S=20 μmol/L时,探针630 nm处的荧光强度随着PBS-甘油体系中甘油的比例增大而增强90倍;在高粘度的环境中,对H2S的响应限度高达40 μmol/L。此外,DCO-V-H2S还具有优异的稳定性,选择性,良好的生物相容性,目前课题组已经通过DCO-V-H2S成功实现了对HeLa细胞经饥饿诱导与硫氢化钠干预后粘度、H2S的双重成像。

图7 探针DCO-V-H2S、P-Py、Lyso-MC和B-1的结构[32-35]Fig.7 Structure of probes of DCO-V-H2S,P-Py,Lyso-MC and B-1[32-35]
2019年,张雷课题组基于半花菁染料MC-1设计合成了对粘度与β-淀粉样蛋白都能响应的探针Lyso-MC(图7)[34],分子中引入了吗啉基团使其具有溶酶体的靶向能力。Lyso-MC在615 nm处荧光强度随着粘度的增大而增强33倍,且不受pH、极性等条件的影响;当Aβ1~42聚集体浓度上升至0.25 μmol/L时,探针在610 nm处荧光强度增强了10倍,且粘度的对数值、Aβ1~42聚集体浓度都与荧光强度线性相关。目前课题组已经成功将该探针用于PC12、SH-SY5Y细胞中粘度与Aβ聚集体浓度的监测。
2021年,李朝辉课题组设计合成了pH与粘度同时激活的探针B-1(图7)[35]。该探针原结构中的亚氨基部分带有一定的碱性,因此能够靶向识别溶酶体。在酸性的环境下亚氨基被质子化成为氨基,此时其与吡咯红之间的连接键可以自由旋转,探针仍只表现出微弱的荧光,而在高粘度的环境中,分子内旋转受限,才会发出强荧光。探针在554 nm处荧光强度随着环境粘度增大增强50倍,且不受极性、活性氧、活性氮、ONOO-等诸多因素的影响,具有优异的选择性。由于癌细胞内的pH比正常细胞低、粘度比正常细胞高,因此探针B-1能够成为区分癌细胞与正常细胞的工具。目前已成功通过探针B-1观察到了HepG-2荷瘤小鼠肿瘤细胞与正常部位细胞之间粘度与pH的差异。
5 总结与展望
荧光成像技术由于具有灵敏度高、毒性低、可视化等优点,被广泛应用于生物成像研究。目前,大多数粘度荧光探针是基于TICT机理来设计构建,在对粘度检测的过程中表现出了较高的灵敏度和优异的生物相容性。借助双光子技术和近红外荧光团,探针的吸收和发射信号都能红移,达到生物光学透明区,不仅提高了组织穿透深度,还降低了背景干扰,对探针在活体中的应用大有好处。随着AIE概念的提出,具有AIE特性的粘度探针能够克服传统的小分子荧光探针在水溶液中易聚集而导致荧光猝灭的缺点,具备更高的光稳定性和抗干扰能力,是荧光探针开发的新方向。
粘度荧光探针的发展已取得了巨大的进步,但仍存在一些问题有待研究解决,如:(1)探针信号的保真度问题。尽管很多探针因引入定位基团可以有效靶向到特定的细胞器,但是在特定区域的滞留能力还有待研究;较长时间的成像有利于跟踪细胞内的粘度变化,从而解决相关疾病的问题,但是探针在细胞内的迁移扩散有可能导致假阳性或假阴性信号的干扰。(2)具体症状或疾病的深入研究。粘度作为一个重要的细胞内参数,其波动反映着细胞功能的变化,如果能找到以粘度作为有效标志物的特定病症,将为粘度荧光探针开启医学诊断的大门。希望本文能为后续的研究工作者们提供新的思路,开发出更好的探针以满足生物医学领域的需要。

