板蓝根多糖对PRRSV-JXA1株体外增殖的影响
苏 科,李倩楠,樊俊洋,刘 健,朱世豪,郝潇雅,杨明凡,2,3,张红英,2,3*
(1.河南农业大学 动物医学院,河南 郑州450046;2.河南省动物性食品安全重点实验室,河南 郑州450046;3.郑州市中兽药创制与评价重点实验室,河南 郑州450046)
板蓝根多糖(Radixisatidispolysaccharide,IPRS)是从板蓝根中提取的多糖,约占板蓝根质量的12%,是板蓝根中主要的活性成分之一。IPRS是天然的免疫调节剂,具有低毒、无残留等优点[1]。IPRS中的蛋白多糖具有抗氧化、抗菌、抗病毒、免疫调节等作用[2-3]。IPRS能够提高雏鸡包括法氏囊在内的多种免疫器官指数,并能够促进B细胞和T细胞增殖,提高雏鸡血清中的抗体水平[4-5]。据报道,IPRS通过腹腔注射能够提高小鼠的先天性免疫和特异性免疫[6]。胡元亮等[7]研究证实,80~600 mg/L 的板蓝根多糖能够显著抑制新城疫病毒的感染。IPRS对于猪细小病毒[8]和猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)[9]也有很好的阻断作用。李晓等[10]研究结果显示,IPRS促进了鸡的免疫器官指数,增加了CD3+、CD4+和CD8+T细胞的占比,对鸡传染性支气管炎具有较好的治疗效果。
猪繁殖与呼吸障碍综合征(porcine reproductive and respiratory syndrome,PRRS)是由PRRSV引起的、严重危害养猪产业的疾病。仅美国养猪业每年因该病导致的经济损失达到6亿美元[11]。当前,预防该病的主流措施是弱毒疫苗或灭活疫苗接种,但由于灭活苗免疫效果不佳,弱毒苗则存在极大散毒风险,且PRRSV具有抗体依赖增强作用[12-13],因此研发抗PRRSV药物对防制该病有深远意义。
近年来,国内外广泛开展了中药抗PRRSV的试验研究[14]。据报道,体外具有显著抗PRRSV作用的中药很多,本实验室将体外抗PRRSV效果显著的苦参碱、甘草酸用于动物试验,却发现体内试验无效[15-17]。其原因是多方面的,动物机体是一个复杂的系统,体外试验则仅限细胞、病毒和药物之间的作用,且体外试验多用MA-104和MARC-145细胞,这2株细胞来源于猴肾,与PRRSV自然宿主存在较大种属差异,体外试验未考虑药物对PRRSV致炎作用及免疫抑制的影响。因此,抗PRRSV药物筛选迫切需要从2个方面研究:一是药物对病毒的影响,二是药物对宿主免疫功能的影响。
本项目组前期研究发现,IPRS在体外具有抗PRRSV的作用,并对免疫细胞具有免疫调节作用。本试验采用成功转染CD163受体的永生化猪肺泡巨噬细胞3D4/21/CD163作为靶细胞,筛选出IPRS最佳质量浓度及其最佳作用方式,确定 IPRS抑制PRRSV复制的主要环节,并验证了TLR4在IPRS的抗PRRSV增殖过程中的作用,以期为后续探究IPRS的抗PRRSV致炎作用和对细胞的免疫调节奠定基础。
1 材料与方法
1.1 细胞、病毒及药物3D4/21/CD163细胞,由河南省农业科学院动物免疫学重点实验室惠赠;PRRSV-JXA1株(TCID50为10-5.25),由河南农业大学田克恭老师惠赠;IPRS(94.37%)由本实验室提取、保存。
1.2 主要试剂反转录酶购自Vazyme公司;荧光定量mix酶购自Vazyme公司;TPRRSV-N抗体购自Bioss公司;PITC标记的山羊抗兔IgG购自鼎国昌盛有限公司;预染Marker购自美国 Thermo 公司;TLR4 Antibody购自美国 Novus 公司;Anti-β-actin、Anti-β-actin Rabbit购自上海 Abway 抗体公司;TAK-242购自MCE中国。
1.3 主要仪器荧光定量PCR仪(CFX96 Tou),BIO-RAD公司产品;荧光显微镜(XSP-BM21AY),上海光学仪器厂产品;蛋白电泳仪(PowerPac Basic)、蛋白电泳槽(Mini PROTEAN®Tetra Cell)、半干转膜仪(Trans-Blot Turbo System),BIO-RAD公司产品。
1.4 IPRS最大安全质量浓度的确定将细胞以3×105/mL浓度均匀铺于96孔细胞板,待细胞长至80%~90%。IRPS组是用维持液将IRPS从2 g/L 倍比稀释为0.500 00,0.250 00,0.125 00,0.062 50,0.031 25 g/L 5个质量浓度梯度分别作用于细胞,同时设置细胞对照组和空白对照组。将每个梯度的IRPS组、细胞对照组和空白对照组设置6个重复,置于培养箱中继续培养48 h,使用CCK8法测D495 nm值。
1.5 IPRS抑制PRRSV-JXA1增殖的最佳作用方式和质量浓度
1.5.1IPRS对PRRSV-JXA1的预防作用 将3D4/21/CD163细胞以3×105/mL的浓度均匀铺于24孔板,待细胞长至80%~90%,弃去生长液,PBS洗2次。IRPS组是用维持液将IRPS倍比稀释为0.062 500,0.031 250,0.015 625 g/L等3个梯度作用于细胞,同时设置病毒对照组。每个梯度的IRPS组和病毒对照组设置3个重复。培养4 h后,弃上清,PBS洗2次,加入100 TCID50的病毒液,37℃孵育2 h,弃上清,PBS洗2次,加入维持液,培养箱中继续培养48 h,测定IRPS组和病毒对照组的PRRSV载量。
1.5.2IPRS对PRRSV-JXA1的直接杀灭作用 将3D4/21/CD163细胞以3×105/mL的浓度均匀铺于24孔板,待细胞长至80%~90%,弃去生长液,PBS洗2次。IRPS组是用100 TCID50的病毒液将 IPRS倍比稀释为0.062 500,0.031 250,0.015 625 g/L等3个梯度作用于细胞,同时设置病毒对照组。每个梯度的IRPS组和病毒对照组设置3个重复,37℃孵育2 h,弃上清,PBS洗2次,加入维持液,继续培养48 h,测定IRPS组和病毒对照组的PRRSV载量。
1.5.3IPRS对PRRSV-JXA1的治疗作用 将3D4/21/CD163细胞以3×105/mL的浓度均匀铺于24孔板,待细胞长至80%~90%,弃去生长液,PBS洗2次,病毒液以100 TCID50的浓度接种于24孔板,孵育2 h。弃去病毒液,PBS洗2次,IRPS组是用维持液将IRPS倍比稀释为0.062 500,0.031 250,0.015 625 g/L等3个梯度作用于被感染的细胞,病毒对照组不用药物处理,每个梯度的IRPS组和病毒对照组设置3个重复,培养箱中继续培养48 h,测定PRRSV载量。
1.6 IPRS对PRRSV-JXA1复制环节的影响
1.6.1IPRS对PRRSV-JXA1吸附环节的影响 将3D4/21/CD163细胞以3×105/mL的浓度均匀铺于24孔板,待细胞长至80%~90%,4℃预冷0.5 h。IRPS组是用100 TCID50浓度的病毒稀释液将药物倍比稀释为0.062 500,0.031 250,0.015 625 g/L等3个梯度,每个梯度设置3个重复。弃去上清,PBS洗2次,每孔加入500 μL,4℃吸附2 h后弃上清,PBS洗2次,每孔加入500 μL维持液,培养箱中继续培养48 h,测定PRRSV载量。
1.6.2IPRS对PRRSV-JXA1侵入环节的影响 将3D4/21/CD163细胞以3×105/mL的浓度均匀铺于24孔板,待细胞长至80%~90%,弃去生长液,PBS洗2次,加入100 TCID50的病毒液,4℃吸附2 h,弃去病毒液每孔加入500 μL维持液,转入培养箱,分别在转入后0,1,2 h加入最佳质量浓度的 IPRS,培养箱中继续培养48 h,测定PRRSV载量。
1.6.3IPRS对PRRSV-JXA1胞内增殖的影响 将3D4/21/CD163细胞以3×105/mL的浓度均匀铺于24孔板,待细胞长至80%~90%,弃去生长液,PBS洗2次,加入100 TCID50的病毒液,细胞对照组加入无血清培养基,4℃吸附2 h。弃去病毒液,在细胞对照组和病毒对照组加入维持液,给药组加入维持液稀释的最佳质量浓度的 IPRS。转入培养箱中继续培养48 h,测定PRRSV载量。
1.7 IPRS对PRRSV-JXA1的确证
1.7.1荧光定量PCR检测 IPRS对PRRSV-JXA1的拷贝数影响 将3D4/21/CD163 细胞以 3×105/mL 铺于24孔细胞板中,长至80%~90%弃去生长液,设置细胞对照组、病毒对照组和给药组。给药组加入维持液稀释的最佳质量浓度的IPRS,其他2组加入维持液,培养4 h后,置于4℃预冷30 min,弃上清液4℃PBS洗2次。细胞对照组、给药组、病毒对照组,分别加入4℃的无血清培养液、100 TCID50病毒液稀释的最佳质量浓度药物、100 TCID50的病毒液,转入4℃吸附 2 h 后弃上清液PBS洗2次,加入维持液,培养箱继续培养36,48,72 h。通过测定病毒载量的变化,来检测IPRS体外抗PRRSV作用。
1.7.2间接免疫荧光检测该药对PRRSV-JXA1的作用 细胞处理同1.7.1,按照参考文献[17]方法进行间接免疫荧光检测药物对PRRSV的作用。
1.8 IPRS抑制PRRSV-JXA1增殖过程中对TLR4蛋白翻译水平的影响具体方法参考文献[18]。
1.9 TLR4在IPRS抑制PRRSV-JXA1增殖过程的作用
1.9.1TAK-242最大安全浓度的测定 将TAK-242倍比稀释为80.000 00,40.000 00,20.000 00,10.000 00,5.000 00,2.500 00,1.250 00,0.625 00,0.312 50,0.156 25 μmol/L等10个梯度,待96孔板的细胞长至80%~90%,加入各浓度的TAK-242,继续培养48 h,使用CCK8法测D495 nm值。
1.9.2TAK-242对TLR4抑制功能的验证 TAK-242处理组是将TAK-242稀释为80,40,20 μmol/L及1.9 nmol/L作用于细胞,同时设置细胞对照组和LPS组。TAK-242处理组均使用1 mg/L LPS刺激,通过检测TLR4下游关键转录因子NF-ΚB(p65)的蛋白翻译水平来评价TAK-242对TLR4的抑制功能,具体方法参考文献[18]。
1.9.3IRPS在TLR4被阻断时对PRRSV-JXA1增殖影响 3D4/21/CD163细胞在24孔板中长至80%~90%,设置细胞对照组、病毒对照组、TLR4/NF-ΚB途径被阻断条件下的病毒对照组、IRPS组、TLR4/NF-ΚB途径被阻断条件下的IRPS组。IRPS组细胞处理同1.7.1;TAK-242组为TAK-242提前与细胞孵育4 h后,PBS洗3次接毒;TAK-242+IRPS组是将多糖与药物混合后使药物和TAK-242均为最佳作用浓度与细胞孵育4 h,后续处理同给药组。使用荧光定量PCR检测病毒载量。
1.10 数据处理与分析用Prism 8.0、Adobe Photoshop和SPSS软件对数据进行分析处理。
2 结果
2.1 IRPS对3D4/21/CD163细胞最大安全质量浓度的测定IRPS在3D4/21/CD163细胞上的最大安全质量浓度为0.062 50 g/L(表1)。

表1 IRPS在3D4/21/CD163细胞上的最大安全质量浓度
2.2 IRPS抑制PRRSV-JXA1增殖的最佳作用方式和质量浓度IRPS对PRRSV的预防作用和直接杀灭作用效果极显著(P<0.0001),最佳质量浓度为0.015 625 g/L,病毒载量分别减少了91.34%和84.36%(图1,表2)。
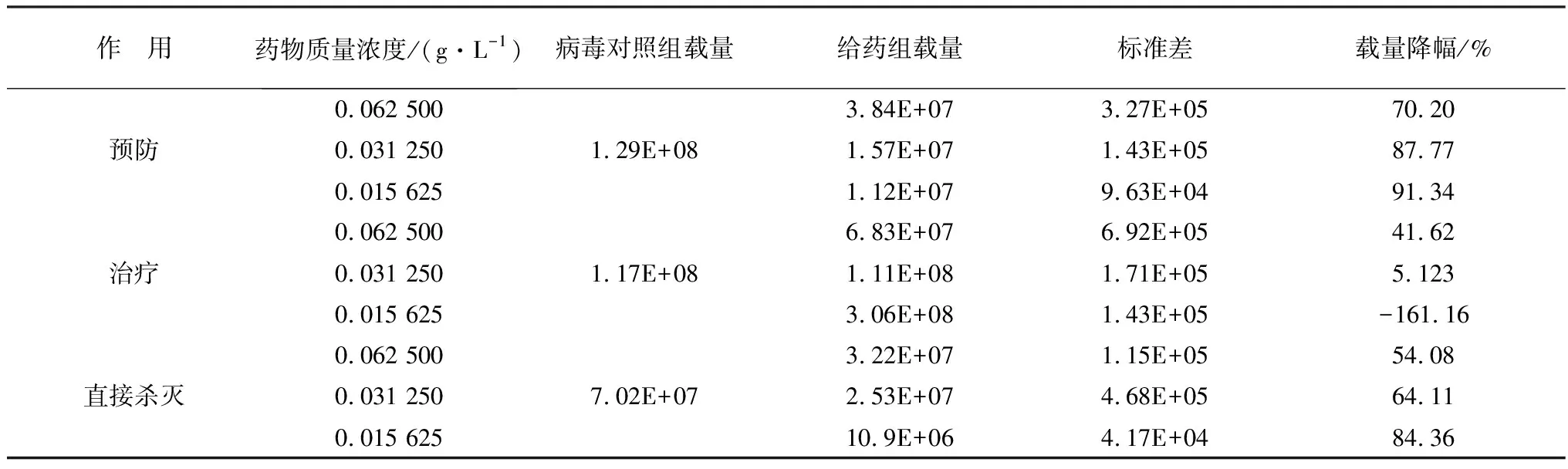
表2 不同质量浓度IRPS预防、治疗和直接杀灭作用下PRRSV-JXA1载量的变化
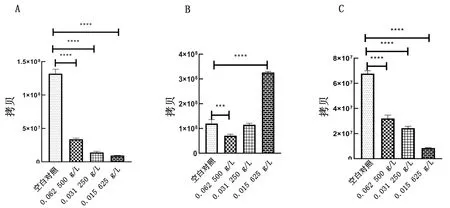
A.IRPS对PRRSV-JXA1的预防作用;B.IRPS对PRRSV-JXA1的治疗作用;C.IRPS对PRRSV-JXA1的直接杀灭作用。***表示P<0.001,****表示P<0.000 1。下同
2.3 IRPS对PRRSV-JXA1复制环节的抑制IRPS抗PRRSV-JXA1吸附环节作用效果最佳(P<0.000 1),质量浓度为0.015 625 g/L时病毒载量减少了88.83%(图2,表3)。
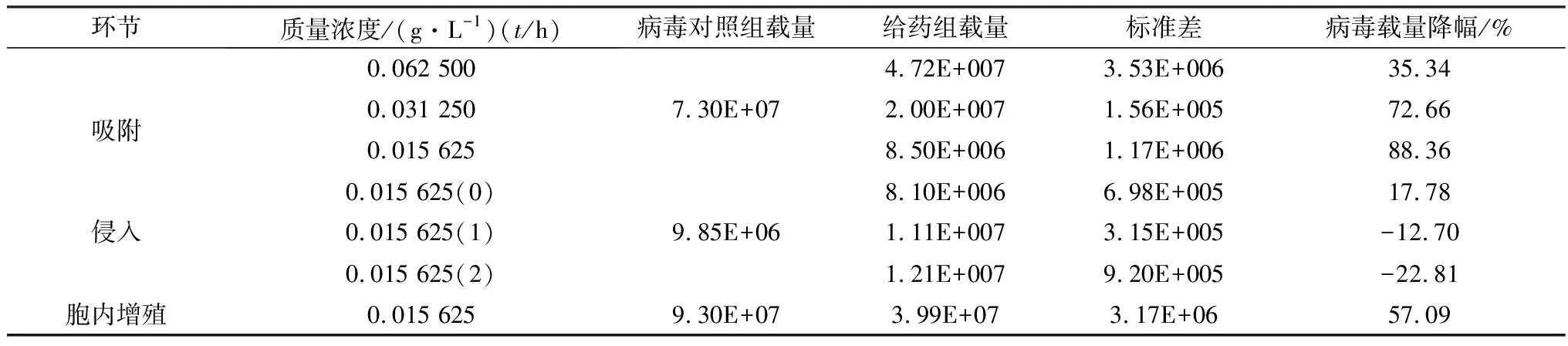
表3 IRPS作用于PRRSV的吸附、侵入和胞内增殖环节对病毒载量的影响
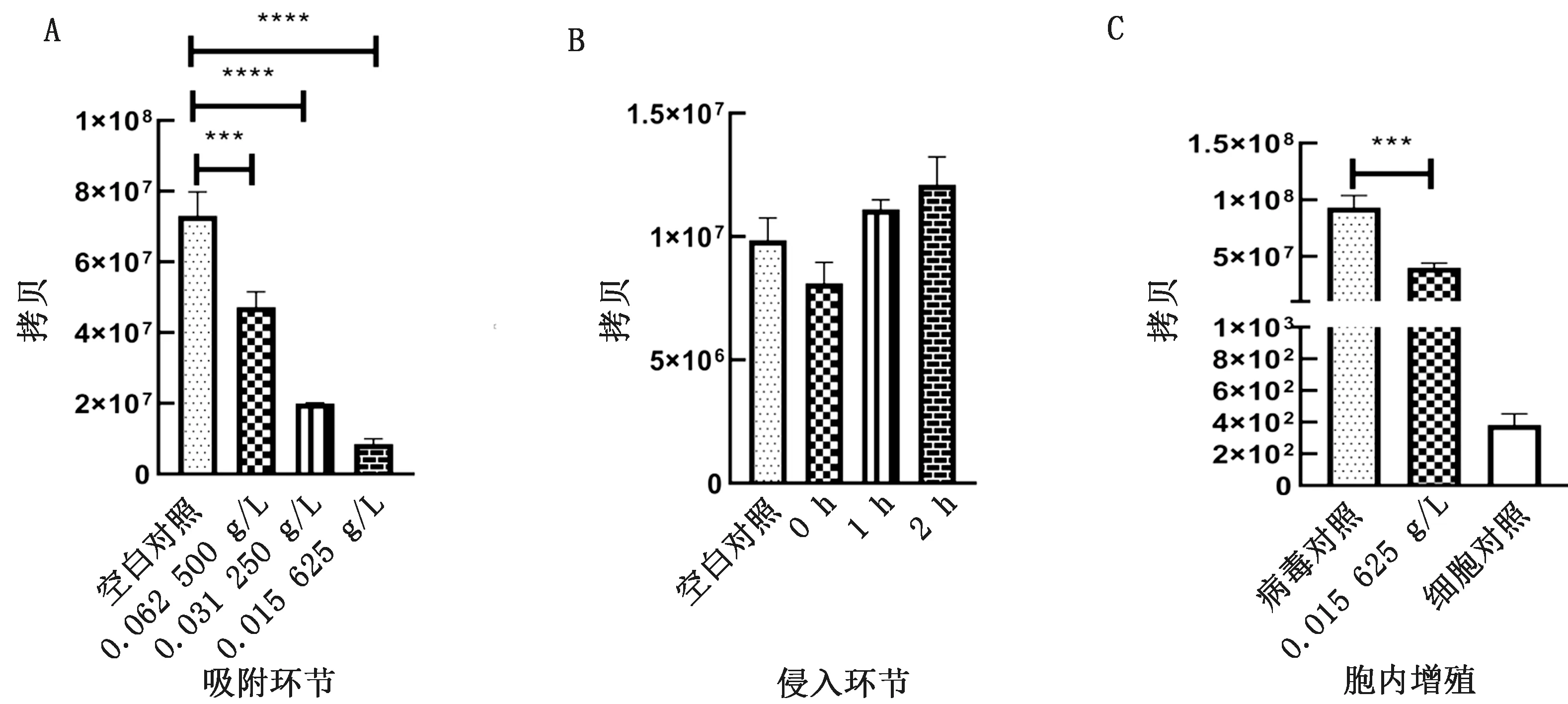
A.IRPS对PRRSV-JXA1吸附内化环节的抑制作用;B.IRPS对PRRSV-JXA1侵入环节的抑制作用;C.IRPS对PRRSV-JXA1胞内增殖的抑制作用
2.4 荧光定量PCR方法检测 PRRSV 拷贝数给药48 h IRPS抗病毒效果最佳,使病毒载量下降了94.97%(P<0.000 1);给药36,72 h减少了60.83%和53.10%病毒载量;给药组载量小于病毒对照组(图3,表4)。
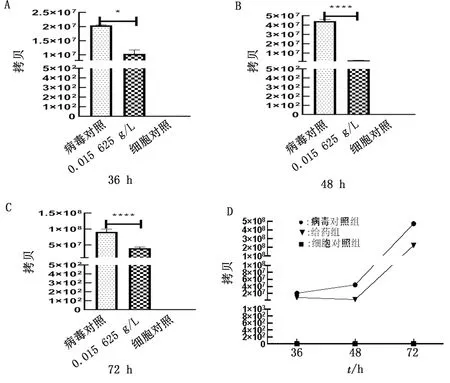
A,B,C.分别为以IRPS以最佳给药方式、最佳给药质量浓度、最佳作用环节共同作用于细胞分别孵育36,48,72 h后的病毒拷贝数;D.不同培养时间病毒对照组、细胞对照组和给药组的病毒拷贝

表4 IRPS以最佳给药方式、最佳给药质量浓度、最佳作用环节共同作用于细胞分别孵育36,48,72 h后的病毒载量降幅
2.5 间接免疫荧光检测IRPS对PRRSV的作用由图4可见,染色后细胞核呈蓝色,染色均匀,着色效果很好。相对于病毒对照组,给药组和细胞对照组细胞核圆润,核与核之间的黏连较少。图4C有明显的绿色荧光,图4B仅见少量荧光,证实IRPS有很好地抑制强毒株PRRSV-JXA1在3D4/21/CD163细胞增殖的作用。

A.细胞对照组;B.给药组;C.病毒对照组。DAPI.各组细胞核染色结果;PRRSV-N.各组免疫荧光结果;Merge.荧光融合结果
2.6 IRPS抑制PRRSV-JXA1增殖过程中对TLR4蛋白翻译水平的影响6 h给药组TLR4蛋白翻译水平较细胞对照组显著上调(P<0.05);12 h病毒对照组和给药组TLR4蛋白翻译水平较细胞对照组显著下调(P<0.000 1),IRPS组相对于病毒对照组TLR4蛋白翻译水平显著上调(P<0.000 1);24,30 h 病毒对照组显著下调了TLR4蛋白翻译水平(P<0.000 1),IRPS组减弱了这种下调(P<0.000 1)使TLR4蛋白翻译水平与细胞对照组无显著性差异;48 h给药组TLR4蛋白表达水平相对于细胞对照组和病毒对照组显著下调(P<0.000 1)(图5,6)。

T.IPRS处理组;C.细胞对照组;V.病毒对照组。不同数字代表不同时间点(h)

*表示P<0.05,****表示P<0.000 1
2.7 TLR4在IRPS抑制PRRSV-JXA1增殖过程的功能
2.7.1TAK-242最大安全浓度的测定及TAK-242抑制TLR4/NF-ΚB途径的检测 所选TAK-242的浓度对3D4/21细胞未出现细胞毒性,反而促进了细胞增殖(图7)。TAK-242浓度为20.000 00,40.000 00,80.000 00 μmol/L能显著抑制TLR4下游分子NF-ΚB(P65)蛋白翻译水平(P<0.000 1),40.000 00 μmol/L的TAK-242相对于20.000 00 μmol/LTAK-242抑制效果更佳(P<0.01),相对于80.000 00 μmol/LTAK-242细胞毒性更小(图7,8,9)。
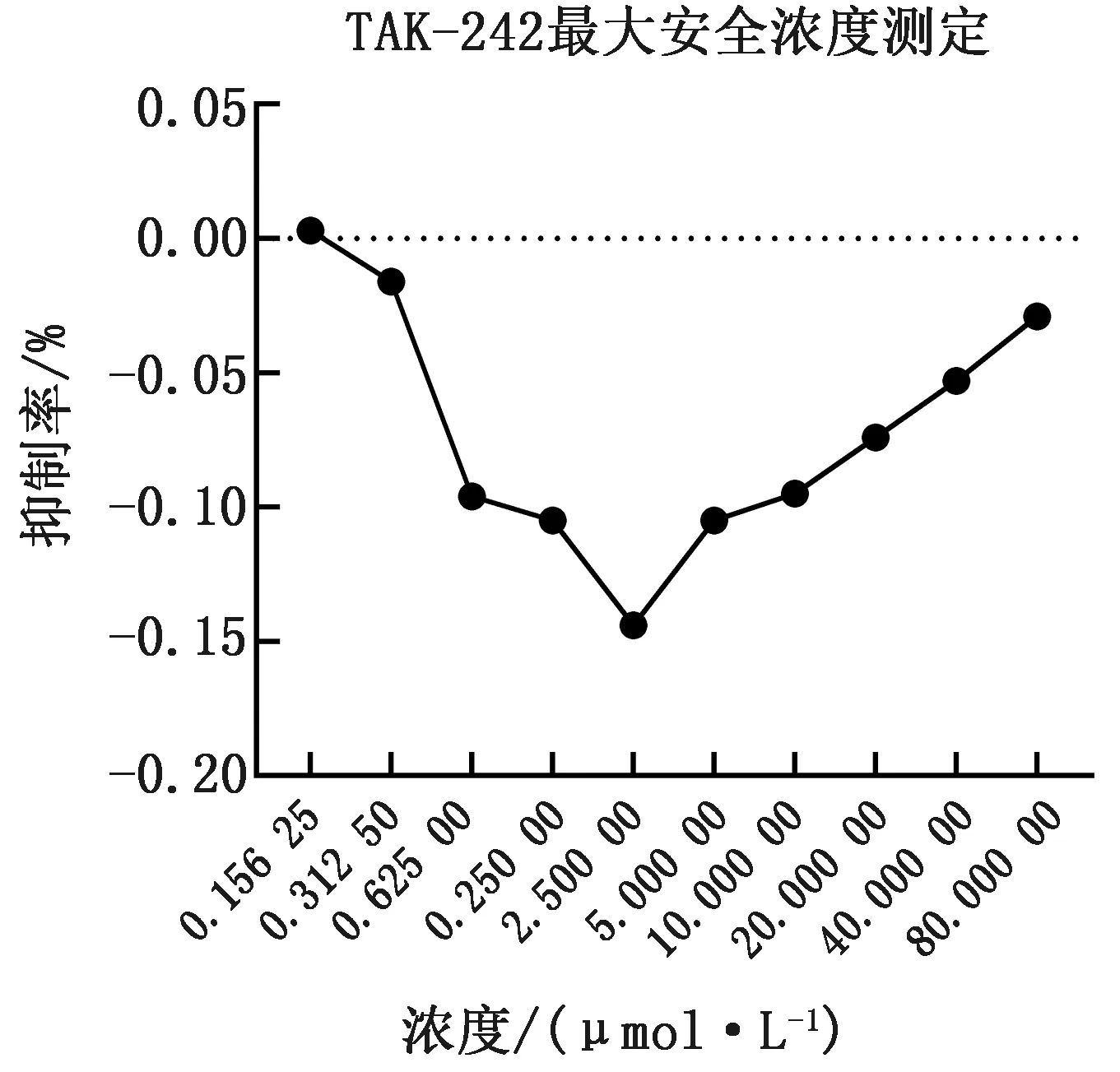
图7 不同浓度的TAK-242对细胞活性的抑制率

-.未添加LPS或TAK-242;+.添加LPS或TAK-242;图下方数字代表所添加的TAK-242浓度

LPS.LPS阳性对照;TAK-242.TLR4抑制剂处理组。*表示P<0.05,**表示P<0.01,****表示P<0.000 1
2.7.2IRPS在TLR4/NF-ΚB途径被阻断时对PRRSV-JXA1增殖的影响 试验结果显示,IRPS组仍保持了对PRRSV 90%以上的抑制率,与病毒对照组相比差异极显著(P<0.000 1);TLR4抑制剂组PRRSV载量与病毒对照组相比显著升高(P<0.001);在TLR4/NF-ΚB途径被阻断条件下的IRPS组与病毒对照组相比病毒载量显著增加(P<0.000 1)(图10)。

Cell.细胞对照;T+I+V.TLR4/NF-ΚB途径被阻断条件下的IRPS组;T+V.TLR4/NF-ΚB途径被阻断条件下的病毒对照组;I+V.IRPS组;V.病毒对照。***表示P<0.001,****表示P<0.000 1
3 讨论
3.1 IRPS抑制PRRSV增殖的吸附环节IRPS能够与多种受体作用,因此一般认为其抗病毒作用机理是多途径的[8]。本试验结果表明,3种给药方式药物作用的时间先后有很大差异,IRPS对PRRSV的预防作用效果最显著(P<0.000 1)。IRPS提前4 h作用细胞,可能与细胞表面的一些受体作用,激活了细胞的先天性免疫,此时PRRSV对细胞的感染率大大降低。PRRSV具有严格的细胞嗜性,通过表面特异性受体以胞吞的形式进入细胞[19],在这之前需要吸附并融合于细胞膜表面。PRRSV编码多种蛋白,其中结构蛋白GP2 b可能涉及病毒和宿主细胞的融合及内吞作用[20]。PAM细胞表面存在多种受体有助于PRRSV吸附、膜融合和内化作用,这些受体的功能有交叉性。硫酸乙酰肝素参与PRRSV的吸附环节[21]。唾液酸黏附素参与PRRSV的吸附和内吞作用[22]。CD163介导PRRSV的内吞和脱壳[23]。因此,IRPS能够显著抑制PRRSV的吸附环节(P<0.000 1),可能存在2个方面的原因:一是IRPS能够破坏或改变PRRSV GP2 b的结构;二是IRPS与PRRSV竞争性结合硫酸乙酰肝素或唾液酸黏附素,这有待后续试验进一步验证。
3.2 PRRSV感染对TLR4表达的影响TLR4是经典的抗细菌天然免疫模式识别受体,主要识别革兰阴性菌的脂多糖或类脂A,也可识别部分病毒的包膜蛋白,通过诱导炎性细胞因子和共刺激分子而诱发天然免疫反应[24]。研究发现,新冠病毒冠状蛋白可以直接结合并激活模式识别受体TLR4,并上调相关炎症因子(如IL-1B和IL-6),这种天然免疫反应的结果是造成患者体内的细胞因子风暴和病毒无法有效被清除[25],其感染结果和PRRSV感染相似。宋爽[26]研究发现,PRRSV通过TLR4/MyD88信号通路诱导IL-lβ、IL-6和IL-8的产生,但这3种细胞因子对PRRSV的增殖均无明显影响。本试验中,在PRRSV感染后6,24 h,3D4/21/CD163细胞TLR4的表达与对照组相比无差异,这与参考文献[27]的研究结果一致,但在PRRSV感染后12,30,36 h TLR4的表达显著下降,说明PRRSV的增殖可以抑制TLR4的表达。
3.3 TLR4/NF-ΚB信号通路是IRPS抗PRRSV增殖的关键通路目前,主要的植物多糖受体包括补体受体3、TLRs、清道夫受体、Dectin-1以及甘露糖受体等。据报道,胀果甘草多糖通过TLR4/MyD88/NF-ΚB途径激活巨噬细胞的免疫功能[28]。周雪[18]发现,TLR4能够与锦灯笼果实多糖结合。本试验中,IRPS组相对于病毒对照组在多个时间点促进了TLR4的蛋白翻译水平(P<0.001),本研究推测IRPS抑制PRRSV增殖可能是通过TLR4途径,试验结果也证明了这个推测。TLR4是唯一一个MyD88和TRIF信号通路兼依赖的TLRs,NF-ΚB是MyD88下游的转录因子,当TLR4下游的NF-ΚB信号通路被阻断时,PRRSV的拷贝数显著增加(P<0.001),这说明TLR4的NF-ΚB途径确实在机体抗PRRSV过程中起关键作用;当TLR4信号通路未受到抑制时IRPS有较好的抗PRRSV作用(P<0.000 1),而在TLR4/NF-ΚB途径被阻断时IRPS不能抑制PRRSV的体外增殖,这说明TLR4/NF-ΚB信号通路同样是IRPS体外抗PRRSV增殖的关键通路,其具体机制有待进一步研究。
本试验基于多个实验室及本课题组前期对IRPS体外抗PRRSV作用[9,29]以及通过促进DC细胞的增殖、分化和成熟[30]等研究工作,探讨板蓝根多糖在3D4/21/CD163细胞上的抗PRRSV作用,证明了TLR4/NF-ΚB途径是机体抗PRRSV的关键,并在IRPS抑制PRRSV增殖过程中不可或缺。3D4/21是永生化的猪肺泡巨噬细胞,因此相较于Marc-145或MA-104,在3D4/21/CD163细胞上研究中药抗PRRSV作用可能更具现实意义。

