猪细小病毒非结构蛋白NS1通过NF-κB信号通路介导炎症反应
徐盟龙,阮静娴,王栋涵,王平利,王林青,夏 璐*
(1.河南农业大学 动物医学院,河南 郑州 450046;2.郑州师范学院,河南 郑州 450044)
猪细小病毒病是由猪细小病毒(porcine parvovirus,PPV)引起的以母猪繁殖障碍为主要特征的病毒性传染病,临床表现为初产母猪不孕、流产、死胎、木乃伊胎及带病弱胎,同时还可以引起仔猪皮炎、腹泻和呼吸系统疾病[1-2]。MAYR等[3]在1968年首次报道该病,至今已在全世界广泛传播与流行,制约了养猪业的健康发展。PPV是一种小的、无包膜的DNA病毒,基因组长约5 kb,包含2个主要的开放阅读框,5′端编码结构蛋白(VP1、VP2和VP3),3′端编码非结构蛋白(NS1、NS2和NS3)[4-6]。其中,NS1是最重要的非结构蛋白,参与PPV的转录、复制和细胞毒性[7]。
核因子-κB(nuclear factor kappa-B,NF-κB)是调节机体先天性和适应性免疫反应的重要因子[8]。静息状态下,NF-κB的二聚体(p50和p65亚基)与抑制蛋白(inhibitory protein κB,IκB)结合成三聚体,以非活性复合物的形式存在于细胞质[9]。细胞受到刺激时,IκB激酶(IκB kinase,IKK)复合物磷酸化IκB蛋白内的特定丝氨酸,降解IκB蛋白,从而导致p65磷酸化,从二聚体中释放出来,激活参与免疫反应相关的基因转录[10]。
Toll样受体(Toll-like receptors,TLRs)是一种典型的模式识别受体,可以通过识别病原相关分子模式诱导细胞因子的表达[11]。例如,TLR2和TLR4可以识别革兰阴性细菌细胞壁的成分,如脂多糖和脂蛋白[12]。除此之外,病毒蛋白也被报道作为TLR的激动剂,麻疹病毒的血凝素蛋白、丙型肝炎病毒的核心蛋白和轮状病毒的非结构蛋白等都可以通过TLR2诱导炎性细胞因子的表达[13-15]。研究这些分子机制可以更好地理解宿主应对病毒感染的防御机制。
我们前期研究结果表明,PPV体外感染细胞可以激活NF-κB信号通路诱导IL-6的表达[16]。本试验应用实时荧光定量PCR和免疫印迹技术分别研究了PPV NS1对PK-15细胞炎性因子IL-6/TNF-α的表达和NF-κB信号通路激活的影响,为了解PPV与宿主细胞相互作用的机制奠定了理论基础。
1 材料与方法
1.1 细胞、病毒和质粒PK-15细胞、PPV李氏毒株和PPV NS1的重组质粒pCAGGS-HA-NS1均由河南省动物性食品安全重点实验室保存[16-17]。
1.2 主要试剂胎牛血清、MEM培养基、opti-MEM减血清培养基均购自美国Gibco公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;RIPA裂解液购自武汉BOSTER公司;TLR2激动剂Pam3CSK4购自美国InvivoGen公司;TLR2抑制剂购自美国MCE公司;NF-κB抑制剂BAY 11-7082购自北京Beyotime公司;TRIzol、HiScriptⅡ 1st Strand cDNA Synthesis Kit、ChamQ Universal SYBR qPCR Master Mix购自南京Vazyme公司;HA Tag Monoclonal Antibody购自美国Invitrogen公司,IκBα(L35A5)Mouse mAb(Amino-terminal Antigen)、NF-κB p65(L8F6)Mouse mAb、Phospho-NF-κB p65(Ser536)(93H1)Rabbit mAb抗体购自美国CST公司;Beta Actin Monoclonal Antibody、TLR2 mouse mAb、HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)、HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)购自武汉Proteintech公司。
1.3 主要仪器低温高速离心机5430R购自德国Eppendorf公司;PCR扩增仪Veriti购自美国Applied Biosystems公司;荧光定量PCR仪CFX 96、蛋白电泳仪、半干转印槽Trans-Blot Turbo购自美国Bio-Rad公司;超灵敏多功能成像仪Amersham Imager 800购自美国GE公司。
1.4 重组质粒转染PK-15细胞使用含10%胎牛血清的MEM培养基培养PK-15细胞,细胞长满时传至12孔板中,当细胞生长至80%时进行质粒转染。配制转染液A:150 μL无血清的opti-MEM加入1 μg空载或目标质粒轻柔混匀,室温静置5 min;转染液B:150 μL无血清的opti-MEM加入3 μL Lipofectamine 2000轻柔混匀,室温静置5 min。完成后将A液缓慢加入B液中混匀,室温静置25 min。12孔板中的PK-15细胞用高压灭菌后的D-Hank's洗涤2次,更换为无血清的opti-MEM培养基,将转染混合液加入细胞孔中,转染6 h后细胞培养液更换为含2% FBS的培养基。
1.5 蛋白免疫印迹检测转染重组质粒24 h后用预冷的PBS缓冲液清洗PK-15细胞,将细胞收集至1.5 mL EP管中,4℃、1 000 r/min离心10 min,弃上清液。细胞沉淀使用含1% PMSF的RIPA细胞裂解液冰上裂解细胞,作用30 min,4℃、13 000 r/min离心10 min,取上清液即为细胞总蛋白。抽取10 μL细胞总蛋白加入2 μL 6 × SDS Protein Buffer,100℃变性5 min。变性后的蛋白进行10%SDS-PAGE电泳,转印至硝酸纤维膜(NC膜),5%脱脂乳封闭1 h,分别加入一抗HA(1∶5 000)、TLR2(1∶200)、p-p65(1∶1 000)、p65(1∶1 000)、IκBα(1∶1 000)、β-actin(1∶4 000),4℃孵育过夜。TBST洗5次,每次10 min,加入相应的HRP标记的二抗(1∶5 000),37℃孵育1 h,TBST洗5次,每次10 min。最后使用ECL发光显色液显色,通过成像仪Amersham Imager 800曝光、拍照。
1.6 实时荧光定量PCR检测PK-15细胞转染重组质粒24 h后,收集细胞至1.5 mL EP管中,使用TRIzol法提取总RNA,并参照HiScriptⅡ 1st Strand cDNA Synthesis Kit说明书将总RNA反转录为cDNA。使用ChamQ Universal SYBR qPCR Master Mix进行实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)。RT-qPCR反应体系:2×SYBR qPCR Master Mix 10 μL,ddH2O 7 μL,上、下游引物(10 μmol/L)各0.5 μL,cDNA 2 μL。RT-qPCR反应程序:95℃预变性3 min;95℃变性5 s,60℃退火20 s,72℃延伸15 s,45个循环。设置阴性对照,确认引物熔解曲线和扩增曲线。以β-actin作为内参,采用2-△△Ct计算基因表达的相对水平。所有的引物均由河南尚亚生物技术有限公司合成。引物信息见表1。
1.7 PPV NS1转染细胞后炎症细胞因子的检测将1,2,3 μg的重组质粒pCAGGS-HA-NS1分别转染PK-15细胞,同时设置阴性对照和PPV感染阳性对照。24 h后提取细胞总蛋白和总RNA,通过Western blot检测HA的表达来显示NS1的表达,通过RT-qPCR检测IL-6和TNF-α的转录水平。
1.8 NF-κB抑制剂处理后炎症细胞因子的检测使用无血清的MEM培养基将NF-κB抑制剂BAY 11-7082稀释至5 μmol/L,使用D-Hank's洗涤PK-15细胞2次,每孔细胞加入200 μL 5 μmol/L 的NF-κB抑制剂BAY 11-7082,37℃预处理30 min[18]。处理结束后每孔细胞转染2 μg重组质粒pCAGGS-HA-NS1,同时设置阴性对照和PPV感染阳性对照组。转染24 h后提取细胞总RNA,通过RT-qPCR检测IL-6和TNF-α的转录水平。
1.9 PPV NS1转染细胞后NF-κB通路蛋白的检测将2 μg的重组质粒pCAGGS-HA-NS1转染PK-15细胞,转染6 h后,细胞培养液更换为含2% FBS的培养基,同时设置阴性对照和PPV感染阳性对照。24 h后分别提取细胞总蛋白,通过Western blot检测IκBα、p65和p-p65蛋白的表达水平。
1.10 TLR2激动剂和抑制剂处理后NF-κB通路蛋白和炎症细胞因子的检测使用无血清的MEM培养基将TLR2激动剂Pam3CSK4和抑制剂C29分别稀释至1 mg/L和50 μmol/L,分别使用200 μL的TLR2激动剂或抑制剂在37℃孵育细胞2 h。孵育结束后转染重组质粒pCAGGS-HA-NS1,转染6 h 后,细胞培养液更换为含2%FBS的培养基,培养基中维持相应TLR2激动剂和抑制剂的浓度。同时设置阴性对照和PPV感染阳性对照。24 h后分别提取细胞总蛋白和总RNA,通过Western blot检测IκBα、p65和磷酸化p65蛋白的表达水平,通过RT-qPCR检测IL-6和TNF-α的转录水平。
1.11 统计分析应用 Image J 软件对Western blot的条带进行灰度分析;利用GraphPad Prism 8.0.1软件作图和统计学分析,采用t检验或单因素方差进行显著性分析。
2 结果
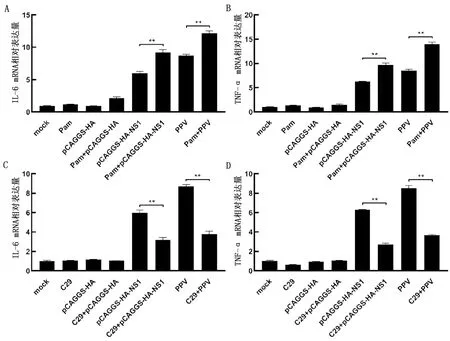
2.1 PPV NS1激活炎症反应如图所示,转染2 μg重组质粒pCAGGS-HA-NS1时NS1的表达量显著升高(P<0.01),转染3 μg重组质粒时NS1的表达量与2 μg重组质粒差异不大(图1A),所以后续试验均转染2 μg的pCAGGS-HA-NS1进行研究。并且不同质量的pCAGGS-HA-NS1转染细胞后均显著上调了炎性细胞因子IL-6和TNF-α的转录水平(P<0.01),且随着pCAGGS-HA-NS1转染质量的增加,炎性细胞因子的转录水平也相应的增加(图1B,C)。结果表明,PPV NS1转染细胞后可以激活炎症反应,且呈剂量依赖性。

A.不同质量pCAGGS-HA-NS1转染PK-15细胞后的表达量;B.不同质量pCAGGS-HA-NS1转染PK-15细胞后IL-6 mRNA转录水平;C.不同质量pCAGGS-HA-NS1转录PK-15细胞后NS1 mRNA转录水平;D.不同质量pCAGGS-HA-NS1转染PK-15细胞后TNF-α mRNA转录水平。*表示0.01 2.2 PPV NS1通过激活NF-κB信号通路诱导炎症反应如图2所示,与只转染pCAGGS-HA-NS1的细胞相比,使用NF-κB抑制剂BAY 11-7082处理细胞后再转染pCAGGS-HA-NS1,炎性细胞因子IL-6和TNF-α mRNA的转录水平明显受到了抑制(P<0.01)。结果表明,NF-κB激活的经典途径对随后IL-6的上调至关重要。 A.NF-κB抑制剂BAY 11-7082对IL-6 mRNA表达的影响;B.NF-κB抑制剂BAY 11-7082对TNF-α mRNA表达的影响。**表示P<0.01 2.3 PPV NS1诱导p65的磷酸化和IκBα的降解如图3所示,与空白细胞和空载体转染组相比,pCAGGS-HA-NS1转染细胞后,显著下调IκBα的表达水平,显著上调p65的磷酸化水平(0.01 A.pCAGGS-HA-NS1诱导IκBα的降解;B.pCAGGS-HA-NS1诱导p65的磷酸化。*表示0.01 2.4 PPV NS1激活NF-κB通路依赖于TLR2如图4所示,与空白细胞组和空载体转染组对比,pCAGGS-HA-NS1显著上调了TLR2的表达水平。并且,TLR2激动剂显著增强了PPV NS1促进IκBα降解和诱导p65磷酸化的能力,而TLR2抑制剂处理后,PPV NS1促进IκBα降解和诱导p65磷酸化的能力受到抑制。结果表明,TLR2参与了PPV NS1介导的NF-κB通路的激活。 A.pCAGGS-HA-NS1诱导TLR2表达;B.pCAGGS-HA-NS1通过TLR2诱导IκBα降解;C.pCAGGS-HA-NS1通过TLR2诱导p65磷酸化。*表示0.01 2.5 PPV NS1介导炎症反应依赖于TLR2如图5所示,当使用TLR2的激动剂处理细胞后,再转染pCAGGS-HA-NS1,相比于只转染pCAGGS-HA-NS1的细胞,IL-6和TNF-α mRNA的表达量更高(P<0.01)。而使用TLR2的抑制剂后再转染pCAGGS-HA-NS1,相比于只转染pCAGGS-HA-NS1的细胞,IL-6和TNF-α mRNA的表达水平显著受到了抑制(P<0.01)。结果表明,TLR2参与了PPV NS1介导的炎症反应。 A.TLR2激动剂Pam3CSK4对IL-6 mRNA表达的影响;B.TLR2激动剂Pam3CSK4对TNF-α mRNA表达的影响;C.TLR2抑制剂C29对IL-6 mRNA表达的影响;D.TLR2抑制剂C29对TNF-α mRNA表达的影响。**表示P<0.01 PPV是导致母猪繁殖障碍的主要原因之一,给我国养猪业造成一定的经济损失[19]。我们之前的研究表明,PPV可以在体外激活NF-κB信号通路并诱导炎症反应[16]。NS1在PPV基因组的转录和复制过程中起重要作用,但NS1在PPV诱导炎症反应中的作用尚不清楚,因此本研究旨在探讨PPV NS1对NF-κB信号通路的影响。 IL-6和TNF-α是与宿主先天免疫反应相关的重要促炎细胞因子,具有清除病原微生物的作用。我们前期的研究表明,PPV感染可诱导IL-6的表达。因此,为了确定PPV NS1是否也可以诱导促炎细胞因子的表达,我们用RT-qRCR检测了IL-6和TNF-α mRNA的转录水平。本试验结果表明,PPV NS1重组质粒的转染增强了IL-6和TNF-α的表达,且与PPV NS1重组质粒的质量呈剂量依赖关系。为了进一步研究NF-κB在诱导促炎性细胞因子表达中的作用,本试验使用了NF-κB抑制剂BAY 11-7082。BAY 11-7082对IL-6和TNF-α表达的抑制作用表明,NF-κB通路的激活是促炎性细胞因子表达上调的关键。 当受到外界刺激时,NF-κB信号通路会迅速被激活,并且可以影响宿主细胞生命活动中的关键步骤,这使得NF-κB通路成为病毒入侵时一个有吸引力的目标[20]。而NF-κB通路的激活主要依赖于IκB蛋白的降解,使p65释放并磷酸化[21]。p65是NF-κB信号通路的主要亚单位,其磷酸化状态影响其转录活性[22-23]。据报道,PPV感染可以激活NF-κB信号通路,并诱导下游炎性细胞因子转录[16,24]。此外,还有研究发现,人细小病毒B19的非结构蛋白NS1转染细胞后可以刺激TLRs的表达和先天免疫反应[25]。鉴于非结构蛋白NS1在PPV感染中的重要作用,我们在本研究中研究了非结构蛋白NS1的作用机制。WB分析表明,PPV NS1转染细胞后,IκBα表达水平显著下降,且p65的磷酸化显著增加。 众所周知,TLRs在宿主对病毒感染的先天免疫反应中起着重要作用。TLRs可以识别病毒成分并启动信号转导途径,包括触发NF-κB信号通路的激活。据报道,细小病毒Kilham大鼠病毒可以通过TLR信号通路激活NF-κB并进一步诱导IL-12β的产生[26]。为了确定TLR信号通路的激活是否与PPV NS1诱导的NF-κB激活有关,我们通过RT-qPCR和WB检测了NS1转染后TLR2的表达,结果表明PPV NS1可以上调TLR2的表达;而当TLR2被激动或抑制后,TLR2、NF-κB和促炎性细胞因子的表达均受到促进或抑制。因此,我们的数据清楚地表明,PPV NS1转染细胞后可以通过TLR2激活NF-κB信号通路,并诱导炎性细胞因子的表达。 综上,本试验证明PPV非结构蛋白NS1可以通过TLR2激活NF-κB信号通路来诱导IL-6和TNF-α的表达,为揭示PPV调节先天免疫应答的潜在机制,以及阐明PPV的发病机制提供了基础。但是,PPV非结构蛋白 NS1被TLRs,特别是TLR2识别的机制中的功能区域所识别,以及促进宿主细胞的天然免疫反应,还需要进一步的研究。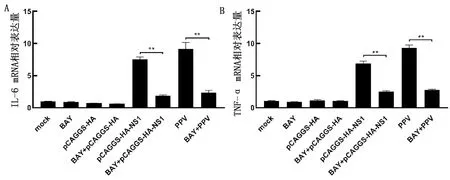


3 讨论

