基于gL蛋白的牛传染性鼻气管炎间接ELISA检测方法的建立及初步应用
张 鹿,付 祥,柳翠翠,陈钰彬,郭珂宇,赵桂新,张志强,史秋梅,吴同垒
(河北科技师范学院 河北省预防兽医学重点试验室,河北 秦皇岛 066004)
牛传染性鼻气管炎病(infections bovine rhinotracheitis,IBR)是由牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)引起的一种接触性传染病,临床上以严重的呼吸道感染、结膜炎、流产、外阴阴道炎、龟头炎等为主要症状[1]。感染牛常呈现隐性感染,进而不断传染其他健康牛,在牛群免疫力低下或发生应激时,可发展为急性感染,造成大量经济损失[2-3]。世界动物卫生组织(OIE)将该病列为B类疫病,也是我国进境动物必检疾病之一[4-5]。近年来,国内关于牛发生IBR的报道迅速增加,分析其原因主要包括几个方面:一是牛繁育基地往往不是牛肉或牛奶产地,不同地区间牛运输频繁;二是从国外输入精液、胚胎、种牛等动物或动物产品时,存在漏检的情况;三是集约化养殖导致IBR的传播速度加快,阳性率增高[6-7]。
有效控制IBRV发生扩散的关键所在是建立快速准确的检测方法。针对IBR的检测往往采用iELISA方法,试剂盒多为进口,成本较高,国产试剂盒较少,供应量严重不足,且存在漏检等问题。IBRV属疱疹病毒科,α疱疹病毒亚科,有囊膜,相对分子质量大,编码70余种蛋白,其中gL蛋白相对分子质量约为17 kDa,主要功能为介导病毒对宿主细胞的侵入和病毒在细胞间的扩散,可诱导产生抗体[8]。本试验在对gL蛋白原核表达的基础上,建立了检测IBR血清抗体的iELISA方法,为IBR的检疫防控提供了重要的技术手段。
1 材料与方法
1.1 细胞、病毒和质粒IBRV的分离株为河北省预防兽医学重点实验室分离并保存;牛肾细胞(MDBK)和质粒pET-32a均保存于河北省预防兽医学重点实验室。
1.2 主要试验试剂限制性内切酶BamHⅠ、EcoRⅠ、T4连接酶,购自赛默飞公司;IPTG诱导剂、Ni-Agarose His标签蛋白纯化试剂盒、鼠源抗His标签单克隆抗体、HRP标记兔抗牛IgG抗体,购自北京康为世纪;牛血清白蛋白购自Biosharp;马血清购自浙江天杭生物科技股份有限公司;IBRV阴、阳性血清均购自中国兽医药品监察所;IBR抗体检测试剂盒(gB)购自美国IDEXX。
1.3 临床样品171份临床牛血清样品由本试验室保存,采自石家庄、唐山、承德、廊坊。IBR、牛病毒性腹泻(BVD)、牛布鲁菌病和牛O型口蹄疫(FMD)的阳性牛血清均由本试验室提供。
1.4 引物设计及合成根据GenBank已登录的IBRV全基因组序列(NC_001847),用Primer premier 5.0软件设计IBRVgL基因相应的引物,引物序列如下,gL-F:5′-GAGGATCCCTGGCGGCGCTGCTGTGGCTCC-3′(BamHⅠ酶切位点),gL-R:5′-ATGAATTCCTAGCGGTAGATGCCG-TCGCC-3′(EcoRⅠ酶切位点)。引物合成服务由上海生工生物有限公司提供。
1.5 重组真核表达质粒的构建及蛋白的表达纯化以提取的IBRV DNA作为模板,通过PCR扩增gL基因。回收并纯化,用BamHⅠ、EcoRⅠ对gL基因双酶切,克隆至pET-32a表达载体构建重组质粒pET32a-gL,经菌落PCR鉴定后由生工生物工程(上海)有限公司测序鉴定。将pET32a-gL质粒转化BL21(DE3)中,1 mmol/L IPTG诱导5 h,离心后超声破碎,收集上清沉淀和全菌样品进行可溶性分析,然后用Ni-NTA亲和层析对重组蛋白进行纯化,并用SDS-PAGE电泳分析纯化效果。诱导表达后的gL蛋白通过转膜后,用稀释的标准阳性血清为一抗,稀释的兔抗牛IgG(HRP)为二抗进行Western blot检测。
1.6 间接ELISA方法的优化及建立采用方阵法确定抗原最佳包被质量浓度和血清稀释度。优化以下条件:包被抗原最佳质量浓度(197.945,98.970,49.486,24.743,12.372,6.185,3.093,1.546,0.773 mg/L);抗原包被条件(4℃过夜、37℃ 1 h+4℃过夜、37℃ 2 h+4℃过夜、37℃ 3 h+4℃过夜;室温1 h+4℃过夜、室温2 h+4℃过夜、室温3 h+4℃过夜)、血清最佳稀释度(1∶20,1∶40,1∶80,1∶160,1∶320,1∶640);封闭条件(5%脱脂牛奶、10%脱脂牛奶、1%BSA、3%BSA、10%马血清、10%明胶);封闭条件(37℃ 1 h、37℃ 2 h、37℃ 3 h、室温1 h、室温2 h、室温3 h);血清孵育时间(37℃ 30 min、37℃ 60 min、37℃ 90 min、室温30 min、室温60 min、室温90 min);兔抗牛IgG-HRP稀释度(1∶3 000,1∶5 000,1∶7 000,1∶10 000,1∶50 000,1∶20 000);孵育条件(37℃ 15 min、37℃ 30 min、37℃ 60 min、室温15 min、室温30 min、室温60 min);TMB显色时间(37℃ 5,10,15 min;室温5,10,15 min)。测定样品D450 nm值。最佳条件判定标准为P/N值最高,阳性血清D450 nm≥1,阴性血清D450 nm较小的值,所对应的条件作为ELISA最佳条件。
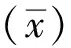
1.8 间接ELISA特异性试验用已建立的间接ELISA方法对IBRV、BDV、牛布鲁菌病和FMD阳性牛血清进行检测,确定该方法的特异性。
1.9 间接ELISA敏感性试验将IBRV阳性血清按2倍倍比稀释1∶20~1∶3 000,按照优化后的条件进行ELISA试验检测,确定该方法的敏感性。
1.10 间接ELISA重复性试验对2种不同批次的酶标板进行包被,随机选取4份阴阳性血清样品稀释后用筛选出的优化条件对其进行检测,每组设置3个平行重复,测定D450 nm值进行统计,计算变异系数,评价该间接ELISA方法的批内、批间重复性。
1.11 间接ELISA临床样品检测用本研究建立的IBRV间接ELISA方法和IDEXX公司的gB-ELISA试剂盒对本试验室保存的171份血清进行检测,并分析IBRV抗体总阳性率。
2 结果
2.1 gL重组蛋白表达及纯化经PCR鉴定验证后,阳性菌落扩大培养提取质粒进行双酶切验证,酶切后获得628 bp的目的片段,与预期大小一致,测序结果显示无突变和移码,表明pET-32a-gL表达载体正确构建。SDS-PAGE结果显示得到 37 kDa 的蛋白条带,与预期大小相符(图1A)。Western blot鉴定结果显示,在约 37 kDa处出现了特异性目的条带,与预期相符(图1B),表明成功获得了gL蛋白且该重组蛋白具有良好的反应原性。

M.蛋白质预染Marker;A1.空载;A2.沉淀;A3.上清;A4.全菌;B1.空载;2.gL蛋白
2.2 间接ELISIA方法的建立及反应条件的确定以重组gL蛋白作为包被抗原建立iELISA检测方法,经优化试验后各反应条件见表1。

表1 iELISA反应条件
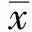
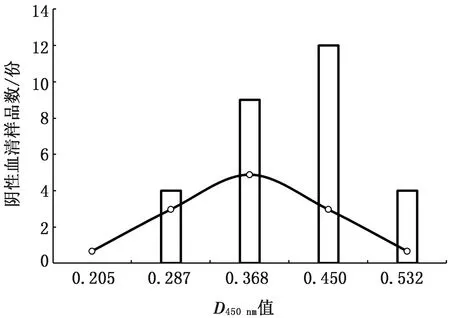
图2 阴性样品检测正态分布图
2.4 特异性试验结果选择优化后的gL-iELISA方法对FMD、BVD、布鲁菌病、IBR阳性血清进行检测,结果显示IBRV阳性血清检测结果为阳性,其余检测结果均为阴性。结果表明,该方法具有较强的特异性,仅对IBRV阳性血清有良好的反应,而对其他血清无反应。
2.5 敏感性试验结果选择优化后的gL-iELISA方法检测经1∶20,1∶40,1∶80,1∶160,1∶320,1∶640,1∶1 280,1∶2 560等梯度稀释IBRV阳性血清,结果显示,阳性血清经最高稀释度为1∶640稀释后检测结果仍为阳性,表明该方法具有较高的敏感性(图3)。

图3 敏感性试验结果
2.6 重复性试验结果用2种不同批次的酶标板包被抗原检测4份阴性血清样品和4份阳性血清样品,计算变异系数,结果显示阴性血清样品批内变异系数为1.9%~6.2%,批间变异系数为2.6%~4.0%;阳性血清样品批内变异系数为2.9%~7.7%,批间变异系数为2.7%~4.6%(表2)。结果表明,该方法的重复性较好。
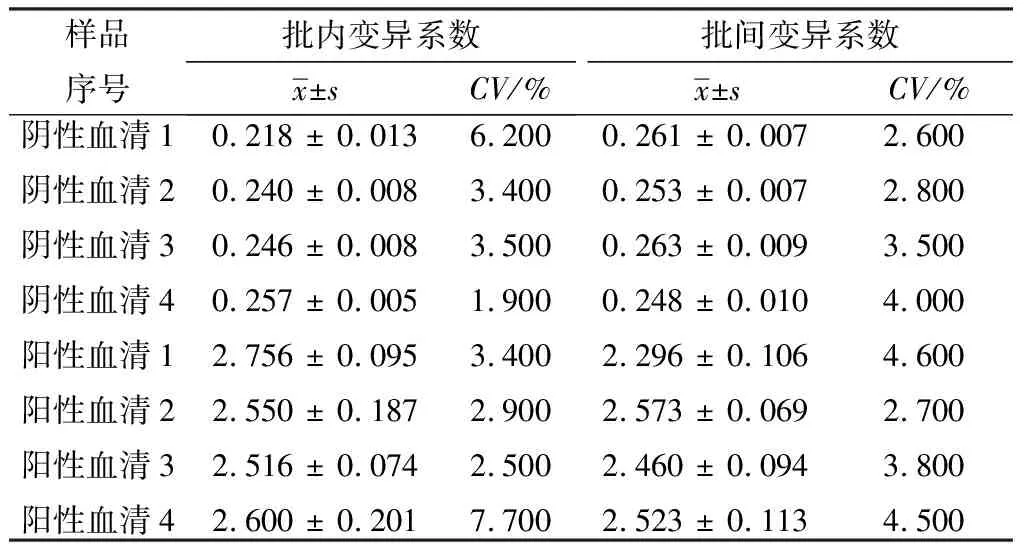
表2 重组蛋白gL重复性试验
2.7 临床样品的检测用所建立的gL-iELISA对采自河北省内的171份血清进行检测,检测出阳性血清67份,抗体总阳性率为39%(67/171),IDEXX公司的gB-ELISA试剂盒检测结果阳性率为35%,二者的阳性符合率为89.6%,阴性符合率为93.6%(表3)。结果表明,该方法具有较高的准确性。

表3 临床样品检测结果
3 讨论
自1980年以来我国不断有牛群感染IBR的报道,阳性率迅速攀升[9-11]。病毒侵入牛体后,以潜伏感染和持续性感染为特征,病牛长期乃至终生带毒,给控制和消灭本病带来极大困难,一旦牛群发生此病将很难根除[12]。当牛群受应激时可造成大规模感染,可严重影响牛群健康,导致肺炎、流产、产奶量下降,同时可造成免疫抑制,从而继发感染,进一步加重病情,给养牛业带来严重的经济损失[4]。根据目前的防控措施,在不接种疫苗的情况下,抗体阳性牛即可被认定为传染源,需进行严格检疫。因此,血清学检测方法是进行IBR防控的关键技术手段[13]。本试验选择对gL蛋白进行原核表达,建立了检测IBR血清的iELISA方法,并进行了临床样品的检测,为IBR的防控提供了重要技术支撑。
IBRV可感染牛的多个脏器,但由于多数牛呈隐性感染,间歇性排毒,导致病原检出率较低,不适用于普筛。而该病毒一旦侵入机体,可不断刺激免疫系统,引起抗体的持续分泌,因此,血清学检测能够较为客观地反映牛群的感染情况[14]。目前,IBRV特异性抗体的检测方法有多种,国外已经有利用体外表达gB蛋白作为诊断抗原建立的ELISA诊断试剂盒(如荷兰赛迪、美国爱德士、西班牙海博莱等),但价格昂贵且购买周期长;国内近几年有几家公司生产基于gB抗原的iELISA试剂盒,但一般仅能用于科研需要,其敏感性、特异性不足,尚无法满足临床检测的需要[15],有鉴于此,本试验选择gL蛋白建立iELISA方法,期望能够用于大规模临床样品的检测,同时大大降低检测成本。本试验结果表明,以gL蛋白为包被抗原建立的IBRV间接ELISA抗体检测方法,与FMD、BVD、布鲁菌病阳性血清不发生交叉反应,且该方法具有良好的重复性。
为进一步验证该iELISA方法的实用性,本试验选择171份牛血清,同时利用该iELISA方法和进口试剂盒(爱德士)对样品进行检测,结果显示本方法阳性率为39%(67/171),IDEXX试剂盒的阳性率为35%,二者的阳性符合率为89.6%,阴性符合率为93.6%,表明本试验建立的IBR抗体检测iELISA方法具有良好的临床应用前景。
综上,本试验建立了一种基于gL蛋白的检测IBR抗体的iELISA方法,具有良好的敏感性、特异性、重复性等,可以用于大规模临床样品检测。

