敲减泛素结合酶E2T的表达抑制肺癌细胞A549生长、侵袭和裸鼠成瘤性①
段方方 赵晓丽 侯小霞 王留晏 陈 露 周寒丽 张玉洁 孔天东
(河南省郑州市第三人民医院肿瘤科,郑州 450000)
由于空气、环境污染等诸多因素,肺癌在世界范围内的发病率均较高,严重威胁公众的生命安全[1]。肺癌患者中最为常见的类型是非小细胞肺癌(non-small cell lung cancer,NSCLC),可占80%左右[2]。临床显示,NSCLC患者确诊时已发展为中晚期阶段,其病死率较高,五年生存率仅有20%左右[3-4]。尽管目前可采取手术、放疗、化疗等多种手段治疗肺癌,以期达到清除病灶、延缓患者生命周期的目的,但部分患者治疗效果不佳,后续仍可能会出现肿瘤复发、转移等情况[5-6]。因此,肺癌的预防以及治疗已成为癌症研究的热点。
泛素结合酶E2T(ubiquitin-conjugating enzyme E2T,UBE2T)基因早期被发现其可介导Fanconi贫血互补家族成员FANCD2、FANCL、FANCI等多种蛋白的泛素化降解,影响DNA损伤的修复,在Fanconi贫血的发病过程中扮演了重要角色[7]。近年来随着研究的深入,有学者发现UBE2T还参与了肝癌、乳腺癌等多种肿瘤的发生、发展过程,其表达水平与肿瘤患者的TNM分期、病理学分级、肿瘤血管浸润等临床特征及无病生存期、总体生存期等预后情况均具有一定的相关性[8-10]。有研究显示,UBE2T基因可抑制NSCLC细胞的增殖和侵袭,但其确切作用机制仍有待进一步探讨[11]。基于此,本研究利用RNA干扰技术,观察敲减UBE2T的表达后对肺癌细胞A549增殖、凋亡、侵袭能力及裸鼠体内成瘤的影响,初步探讨UBE2T基因对肺癌细胞A549增殖、凋亡及侵袭的作用及其机制。
1 材料与方法
1.1材料
1.1.1细胞NSCLC A549细胞系购自中国科学院(上海)生物化学与细胞生物学研究所。
1.1.2动物 雄性BALB/c裸小鼠40只,8~12周龄,体质量20~25 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0011。
1.1.3试剂与仪器 慢病毒载体及辅助载体由上海吉凯基因技术公司提供;TRIzolTMReagent和LipofectamineTM2000试剂盒购自美国Invitrogen公司;反转录RNA试剂盒、PCR试剂盒购自日本TaKaRa生物股份有限公司;Transwell小室及细胞培养皿购自美国BD公司;PVDF膜、ECL发光液购自美国Millipore公司;CCK-8试剂盒、Ki67、p21抗体、Caspase-3、cleaved cas3、Caspase-9、cleaved cas9、VEGF、N-cad抗体购自英国Abcam公司;UBE2T抗体购自美国Abgent公司;辣根酶标记的羊抗兔IgG购自北京中杉金桥公司;10%FBS、RPMI1640培养基、其他常规分析纯化学试剂均购自美国Sigma-Aldrich公司或国药集团化学试剂有限公司;DNM-9606酶标分析仪购自中国北京朗普新技术有限公司;FACSCalibur流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞培养 肺癌A549细胞在含有10%FBS的RPMI1640培养基中培养,置于37℃、含5%CO2的培养箱中培养至对数期,0.25%胰酶+0.02%EDTA(1∶1)消化,制成细胞悬液,每2~3 d更换培养基进行传代。
1.2.2慢病毒包装及转染 在细胞对数生长期,细胞密度达80%时进行转染。参照说明书,将LipofectamineTM2000分别与shRNA-NC、shRNA1、shRNA2、shRNA3进行稀释、混合,完成转染。其中靶向UBE2T基因的shRNA1、shRNA2、shRNA3载体转染A549细 胞 为UBE2T-shRNA1组、UBE2T-shRNA2组、UBE2T-shRNA3组,以空载体质粒转染为阴性对照组(shRNA-NC组),未转染质粒的细胞为空白对照组(Control组)。采用RT-PCR法检测转染各组肺癌A549细胞中的UBE2T mRNA表达水平,UBE2T正向引物:5'-CGGAATTCCGATGCAGAGAGATTCACGTCTG-3',反向引物:5'-CGGGATCCCGGTCCCCTAAACATCAGGATG-3',以GAPDH作 为 标准内参,以2-ΔΔCt值表示UBE2T mRNA的相对表达量。Western blot法检测转染各组肺癌A549细胞中的UBE2T蛋白相对表达水平。选择其中干扰效果较好的UBE2T-shRNA3进行后续实验。
1.2.3CCK-8取对数生长期的各组细胞制成细胞悬液,调整细胞为2×104个/L,接种于96孔板,每组设6个复孔,边缘孔加入适量无菌PBS溶液填充,将其置于37℃、5%CO2培养箱中常规培养。在接种前后不同时间点上向每孔滴加10 µl配好的CCK-8溶液,继续培养4 h后,用DNM-9606酶标分析仪检测各孔在450 nm处的OD值,观察细胞的增殖情况,绘制生长曲线。
1.2.4流式细胞术 收集各组细胞于离心管中,每组设3个复孔。1 000 r/min离心5 min,PBS洗涤2遍,弃上清,加入缓冲液混匀后,再加入5 µl Annexin V-FITC、10µl PI混合,4℃避光孵育20 min,采用FACSCalibur流式细胞仪进行上样检测,CellQuest软件分析计算细胞凋亡率。
1.2.5Transwell小室法 细胞侵袭检测在Transwell小室中进行。取Matrigel稀释液用移液器均匀涂抹在小室底部,待其均匀凝固。取处于对数生长期的各组细胞制备成细胞悬液,调整细胞浓度,于小室内加入1×105个/孔细胞,每组设3个复孔。将其置于37℃、5%CO2培养箱中常规培养24 h。取出小室,PBS洗涤3次,10%中性甲醛溶液固定30 min,结晶紫染色10 min,室温晾干后将微孔薄膜刮下,固定在载玻片上。在显微镜下随机选择10个高倍(×400)视野,采用双盲计数法统计侵袭过膜的细胞数目。
1.2.6Western blot实验 培养48 h后,提取各组细胞的总蛋白,Bradford调节蛋白浓度。经SDSPAGE凝胶电泳、电转至PVDF膜,密封2 h,添加一抗,4℃孵育过夜,用TBST漂洗40 min,加入HRP标记的二抗,孵育1 h,TBST漂洗40 min,ECL发光液显色,暗室曝光于X线片上,采用Imaging System软件分析各组条带灰度值。以GAPDH为标准内参,使用相对灰度值进行统计学分析。
1.2.7裸鼠分组及体内成瘤实验 将40只SPF级雄性BALB/c裸鼠随机分为2组,每组各20只。于裸小鼠腋下或背部皮下分别注射shRNA3感染的肺癌A549细胞(UBE2T-shRNA3组)和shRNA-NC感染的肺癌A549细胞(UBE2T-shRNA-NC组),每次注射5×106个活细胞。常规饲养31 d后将所有小鼠处死,取出皮下肿块并称取质量。
1.2.8免疫组化法检测小鼠瘤体Ki67、VEGF蛋白表达 取各组小鼠瘤体组织标本经脱水、透明、石蜡包埋,将其制成3 µm切片。参考SP免疫组化试剂盒说明书进行免疫组化实验,在显微镜下随机选择10个高倍(×400)视野,统计阳性着色细胞所占百分比。Ki67以细胞核呈棕黄色为阳性表达,VEGF以细胞浆或细胞膜呈棕黄色为阳性表达。
1.3统计学处理 研究结果均以±s表示,采用GraphPad Prism、SPSS22.0软件处理数据,组间比较采用独立样本t检验,检验水准:α=0.05。
2 结果
2.1重组慢病毒感染肺癌细胞A549后UBE2T基因干扰效果RT-PCR结果显示,shRNA-NC组和Control组的UBE2T mRNA相对表达水平比较差异无 统 计 学 意 义(P>0.05),UBE2T-shRNA1组、UBE2T-shRNA2组、UBE2T-shRNA3组 的UBE2T mRNA相对表达水平依次下降,且均明显低于shRNA-NC组(P<0.05),见图1A。
Western blot结果显示shRNA-NC组和Control组的UBE2T蛋白相对表达水平比较差异无统计学意义(P>0.05),UBE2T-shRNA1组、UBE2T-shRNA2组、UBE2T-shRNA3组的UBE2T蛋白相对表达水平依次下降,且均明显低于shRNA-NC组(P<0.05),见图1B。

图1 重组慢病毒感染肺癌细胞A549后UBE2T基因干扰效果Fig.1 Interference effect of UBE2T gene after recombinant lentivirus infection in lung cancer cells A549
2.2UBE2T-shRNA3转染对肺癌细胞A549增殖的影响CCK-8结果显示,shRNA-NC组和Control组在24 h、48 h、72 h、96 h各时间点的细胞增殖率比较差异无统计学意义(P>0.05),但UBE2T-shRNA3组在各时间点的细胞增殖率均低于shRNA-NC组(P<0.05),见图2A。
Western blot结果显示,shRNA-NC组和Control组的Ki67、p21蛋白相对表达水平差异无统计学意义(P>0.05),但UBE2T-shRNA3组的Ki67蛋白的相对表达水平明显低于shRNA-NC组(P<0.05),p21蛋白的相对表达水平明显高于shRNA-NC组(P<0.05),见图2B、C。
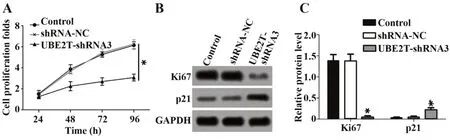
图2 UBE2T-shRNA3转染对肺癌细胞A549增殖的影响Fig.2 Effects of UBE2T-shRNA3 transfection on proliferation of lung cancer cells A549
2.3UBE2T-shRNA3转染对肺癌细胞A549凋亡的影响 流式细胞术结果显示,shRNA-NC组和Control组的细胞凋亡率比较差异无统计学意义(P>0.05),但UBE2T-shRNA3组的细胞凋亡率明显高于shRNA-NC组(P<0.05),见图3A、B。Western blot结果显示,shRNA-NC组和Control组的cleaved cas3/cas3、cleaved cas9/cas9比较差异无统 计 学 意 义(P>0.05),但UBE2T-shRNA3组 的cleaved cas3/cas3、cleaved cas9/cas9明显高于shRNANC组(P<0.05),见图3C、D。

图3 UBE2T-shRNA3转染对肺癌细胞A549凋亡的影响Fig.3 Effects of UBE2T-shRNA3 transfection on apoptosis of lung cancer cells A549
2.4UBE2T-shRNA3转染对肺癌细胞A549细胞侵袭的影响Transwell小室结果显示,shRNA-NC组和Control组的穿膜细胞数比较差异无统计学意义(P>0.05),但UBE2T-shRNA3组的穿膜细胞数明显低于shRNA-NC组(P<0.05),见图4A、B。
Western blot结果显示,shRNA-NC组和Control组的VEGF、N-cad蛋白相对表达水平比较差异无统计学意义(P>0.05),但UBE2T-shRNA3组的VEGF、N-cad蛋白相对表达水平明显低于shRNA-NC组(P<0.05),见图4C。
2.5干扰UBE2T对裸鼠成瘤的影响RT-PCR结果显示,UBE2T-shRNA3组的UBE2T mRNA相对表达水平明显低于shRNA-NC组(P<0.05),见图5A。体内实验结果显示,UBE2T-shRNA3组小鼠的瘤体质量明显低于shRNA-NC组(P<0.05),见图5B。免疫组化结果显示,UBE2T-shRNA3组小鼠瘤体组织中的Ki67、VEGF蛋白阳性表达率明显低于shRNANC组(P<0.05),见图5C、D。

图5 干扰UBE2T对裸鼠成瘤的影响Fig.5 Effects of interfering with UBE2T on nude mouse tumorigenicity
3 讨论
肺癌是临床较为常见的肿瘤之一,其确切的发病机制至今尚未完全明确,多数学者认为,长期大量吸烟、大气污染等因素均与肺癌的发生有密切联系[12]。近几十年来,有多个国家报道肺癌的发病率、病死率显著提升,对患者的生命安全造成巨大威胁[13]。因此,寻找肺癌治疗的新突破对于提高患者生存周期具有重要的积极意义。
UBE2T基因位于人1号染色体长臂32.1,共编码197个氨基酸,其能够介导泛素从泛素激活酶E1转移到底物蛋白或E3连接酶,现已被证实与Fanconi贫血关系密切[14]。此外,有国内外学者报道UBE2T基因在肿瘤的疾病进程中可能也起到癌基因的作用[15]。据报道,一方面,UBE2T可以干预细胞DNA的损伤和修复,从而参与调节细胞周期和细胞凋亡的过程;另一方面,UBE2T还能泛素化肿瘤抑癌基因(如p53、BRCA1等),从而起到促进肿瘤细胞的生长作用[11,16]。PEREZ-PEÑA等[17]研究显示,UBE2T可能在乳腺和肺肿瘤的病理生理学中发挥作用,且与患者预后相关。LUO等[18]研究报道,UBE2T在胃癌细胞中呈高表达,干扰UBE2T表达能够引起胃癌细胞周期阻滞、凋亡,抑制肿瘤细胞生长,且能够通过改变EMT相关因子的表达来抑制肿瘤细胞的迁移与侵袭能力,可能是胃癌患者的一个有用的预后生物标志物和治疗靶点。
本研究通过RNA干扰技术来抑制肺癌细胞A549的UBE2T基因表达,并筛选出干扰效果较好的UBE2T-shRNA3进行后续实验。CCK-8和流式细胞术结果显示,敲减UBE2T表达后,肺癌细胞A549的增殖率明显降低,提示敲减UBE2T表达后能抑制肺癌细胞A549的增殖能力。同时,本研究还通过Western blot检测了Ki67、p21蛋白的表达情况,结果显示,敲减UBE2T表达后,A549细胞中的Ki67蛋白表达下调,p21蛋白表达上调。Ki67的功能与有丝分裂密切相关,是常见的调控细胞增殖的蛋白之一,其表达水平与细胞增殖能力呈正相关[19];p21是p53抑癌基因的下游基因,其能够通过调节细胞周期而影响细胞的增殖[20]。本研究推测,敲减UBE2T表达后A549细胞的抑制增殖能力能与Ki67蛋白表达下调,p21蛋白表达上调有关。Annexin V-FITC/PI双染流式细胞术结果显示,肺癌细胞A549受到sh-RNA3干扰后,细胞凋亡率显著增高,提示敲减UBE2T表达后可诱导A549细胞发生凋亡。凋亡是细胞极为重要的生物学特征之一,其受到多种相关蛋白的调控,如Caspase家族等。本研究发现,肺癌细胞A549受到shRNA3干扰后,cleaved cas3/cas3、cleaved cas9/cas9比值明显增高,提示UBE2T被抑制后,可能会激活Caspase家族的凋亡启动子Caspase-3、Caspase-9,从而促进A549细胞发生凋亡。
此外,本研究还发现敲减UBE2T表达后能抑制肺癌细胞A549的侵袭能力,下调VEGF、N-cad蛋白的表达水平。VEGF是一种高度特异性的促血管内皮细胞生长因子,与血管内皮细胞迁移、增殖及血管生成密切相关[21-22];N-cad是EMT的重要标志物,其表达升高可能会导致肿瘤细胞的骨架系统排列出现异常,改变细胞的生理学形状,造成黏附功能下降,增加肿瘤细胞向周围组织侵袭、转移的风险[23]。推测UBE2T可能通过调控血管生成关键因子VEGF和EMT标志物N-cad来影响A549细胞的侵袭,但其具体的调控机制仍有待进一步的探索。
在体外实验的基础上,本研究还进行了裸鼠成瘤实验,发现肿瘤生长明显受抑制,其成瘤质量明显下降,证实了UBE2T基因能够抑制裸鼠成瘤。同时,采用免疫组化法观察到UBE2T-shRNA3组小鼠瘤体组织中Ki-67、VEGF蛋白表达明显低于shRNANC组,提示Ki-67、VEGF蛋白在肺癌的发生、发展过程中起到重要作用;敲减UBE2T表达能降低瘤体组织中Ki-67、VEGF蛋白表达。
综上所述,敲减UBE2T基因的表达可以抑制肺癌细胞A549的增殖、侵袭,促进细胞凋亡,并能抑制裸鼠成瘤,其作用机制与调节Ki67、p21、Caspase-3、Caspase-9、VEGF、N-cad等蛋白表达有关。然而,有关UBE2T基因对相关蛋白的具体调控机制仍有待进一步的实验研究。

