下调lncRNA Neat1表达通过减少NF-κB P65的细胞核转位保护大鼠心肌缺血再灌注损伤①
崔勤涛 王学惠 刘永强 刘晓晨 段长恩(新乡医学院第一附属医院心血管外科,新乡 453100)
急性心肌梗死是指冠状动脉出现急性堵塞,导致部分心肌缺血性坏死的一种严重冠心病,心肌缺血后实现再灌注,虽然可以有效恢复血流、限制心肌梗死范围,但会加重心肌缺血后损伤,表现为心功能障碍、内皮功能损伤、心肌组织代谢异常、细胞坏死及凋亡等[1-2]。心肌缺血再灌注损伤过程中,涉及氧化应激、炎症反应、心肌纤维能量代谢、钙超载等多种生理过程的相互作用[3-4]。核转录因子NF-κB可调节许多促炎细胞因子和免疫调节因子,参与心肌缺血再灌注损伤[5]。随着基因组学的飞速发展,发现长链非编码RNA(long non-coding RNA,lncRNA)可能参与各类冠心病的发生发展[6]。lncRNA核内富集转录物1(nuclear enriched abundant transcript 1,lncRNA Neat1)表达于细胞核内,可与核蛋白物质结合形成亚核结构paraspeckle,调节炎症反应和脂质代谢,参与动脉粥样硬化相关疾病[6]。最新研究表明,lncRNA Neat1可减轻缺氧诱导的心肌细胞损伤[7]。同时,ZOU等[8]研究发现,沉默lncRNA Neat1可通过抑制转录因子NF-κB的活性,抑制心肌细胞的凋亡。但lncRNA Neat1是否可介导NF-κB作用于心肌缺血再灌注损伤尚不清楚,基于此,本研究通过构建心肌缺血再灌注损伤大鼠模型,深入探讨lncRNA Neat1介导NF-κB在心肌缺血再灌注损伤的作用,以期为临床治疗心肌缺血再灌注损伤提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物48只健康Wistar大鼠,清洁级,雄性,体质量280~320 g,6周龄,购自北京维通利华实验动物技术有限公司,动物生产许可号:SCXK(京)2019-0015,大鼠均饲养于新乡医学院第一附属医院实验动物中心,动物使用许可证号:SYXK(豫)2018-0320,各项操作均符合3R原则,伦理审批号为IACUC-2020-08。
1.1.2实验试剂 无序序列和lncRNA Neat1慢病毒干扰载体由北京海创科业生物技术有限公司提供;ELISA试剂盒、生化试剂盒、蛋白二抗购自武汉博士德生物工程有限公司;蛋白一抗购自美国Cell Signaling;lncRNA Neat1、IL-6和TNF-α引物由上海信帆生物科技有限公司提供;SYBR Premix Dimer Eraser荧光剂购自日本TaKaRa。PhysioSuite呼吸机购自美国Kent;Vevo770动物超声仪购自加拿大Visual Sinics。
1.2方法
1.2.1心肌缺血再灌注大鼠模型的构建 腹腔注射40 mg/kg戊巴比妥钠麻醉大鼠,进行气管插管后打开PhysioSuite呼吸机,距离胸骨左缘约0.5 cm处作切口,打开胸腔、暴露心脏,于左心耳根部下方2 mm进针,肺动脉圆锥旁出针结扎左前降支,当心尖处变苍白、心脏搏动减弱提示左前降支结扎成功,结扎30 min后解开结扎线,恢复灌注120 min,逐层缝合后关胸,术后注意保温。
1.2.2动物分组与处理 将48只Wistar大鼠随机分为假手术组、模型组、shRNA NC组和sh-Neat1组,每组12只,除假手术组外,其余各组大鼠采用左前降支结扎法构建心肌缺血再灌注损伤大鼠模型,假手术组开胸后仅穿线但不结扎,其他操作一致。shRNA NC组和sh-Neat1组建模前24 h于心肌表面选取5个注射点,分别注射无序序列和lncRNA Neat1慢病毒干扰载体(正向序列:5'-gatccATTCGTCAGGGTTGTAAACGAATTTACAACCCTACTGACGAATTTTTTTg-3',反 向 序 列:5'-aattcAAAAAAATTCGTCAGTAGGGTTGTAAATTCGTTTACAACCCTACTGACGAATg-3'),注射10µl,病毒滴度为2×108TU/ml,共50µl,假手术组和模型组注射等量生理盐水。
1.2.3超声检测大鼠心功能变化 各组大鼠处理结束后,采用Vevo770动物超声仪采集二维心脏超声图像,记录心率(heart rate,HR)和左心室射血分数(left ventricular ejection fraction,LVEF)。
1.2.4ELISA检测血清心损伤标志物 各组大鼠处理结束后,腹主动脉取血,分离血清置于-20℃待测。参照ELISA试剂盒说明书,检测血清肌红蛋白(myoglobin,Mb)、心肌肌钙蛋白(cardiac troponin,cTnⅠ)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)的含量。
1.2.5生化试剂盒检测大鼠血清SOD和MDA含量 取适量血清,参照生化试剂盒说明书,检测血清超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)含量。
1.2.6大鼠心肌组织病理染色的观察 各组大鼠处理结束后,快速分离大鼠心肌组织,经4%多聚甲醛固定48 h,石蜡包埋切片,进行常规HE染色和MASSON染色,显微镜下观察大鼠心肌组织病理变化情况,其中MASSON染色后心肌组织呈红色,癜痕组织呈蓝色。
1.2.7Western blot检测心肌组织中相关蛋白的表达 预先配制蛋白裂解液,取适量心肌组织加入蛋白裂解液,匀浆后置于冰上裂解40 min,4℃、12 000 g离心10 min,吸取上清液测定蛋白浓度,取等量蛋白水浴变性后点样至SDS-PAGE凝胶,于90 V下电泳90 min,再以恒定电流300 mA将蛋白条带电转至PVDF膜,取出PVDF膜浸泡至5%脱脂奶粉中,室温下孵育90 min,再分别置于一抗中,4℃孵育过夜,再置于二抗中,37℃孵育40 min,最后进行显影。以ACTIN为内参,计算α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、TGF-β、纤维连接蛋白(fibronectin,FN)、NF-κB P65及p-NF-κB P65的相对蛋白表达。
1.2.8荧光定量PCR检测心肌组织中lncRNA Neat1、IL-6和TNF-α mRNA的表达 取适量心肌组织,根据RNA提取试剂盒说明书,提取总RNA,再经反转录试剂盒合成cDNA链,混合SYBR Premix Dimer Eraser荧光剂,进行荧光定量PCR。采用2-ΔΔCt法计 算lncRNA Neat1、IL-6和TNF-α mRNA的 表达量。
1.2.9免疫荧光检测NF-κB P65细胞核转位情况 取心肌组织石蜡切片(厚度2µm),置于丙酮中浸泡20 min,用10 mmol/L枸橼酸钠缓冲液高温抗原修复20 min,置于1%Triton中浸泡1 h,血清封闭1 h后,孵育NF-κB P65抗体(稀释比为1∶50),4℃下反应过夜,然后孵育FITC抗兔荧光二抗(稀释比为1∶50),37℃反应1 h,最后经激光扫描共聚焦显微镜采集图像。
1.3统计学处理 数据经SPSS21.0统计学软件分析处理,以±s表示,各组数据比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠心肌组织中lncRNA Neat1的表达
荧光定量PCR检测心肌组织中lncRNA Neat1水平,结果显示,假手术组、模型组、shRNA NC组及sh-Neat1组心肌组织中lncRNA Neat1表达分别为
1.00±0.15、8.34±0.58、8.29±0.46、1.92±0.37,各组lncRNA Neat1的表达差异具有统计学意义(F=446.850,P=0.000,n=5)。与假手术组比较,模型组大鼠lncRNA Neat1表达上调(P<0.05);与模型组比较,sh-Neat1组lncRNA Neat1表达下调(P<0.05),但模型组和shRNA NC组lncRNA Neat1表达比较差异无统计学意义(P>0.05),提示sh-Neat1干扰lncRNA Neat1成功。
2.2各组大鼠心损伤标志物水平的比较 与假手术组比较,模型组大鼠外周血Mb、cTnⅠ、CK-MB水平均升高(P<0.05);与模型组比较,sh-Neat1组Mb、cTnⅠ、CK-MB水平降低(P<0.05),但模型组和shRNA NC组的上述指标水平比较差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠心损伤标志物水平的比较(±s,n=5)Tab.1 Comparison on levels of myocardial injury markers among all groups(±s,n=5)
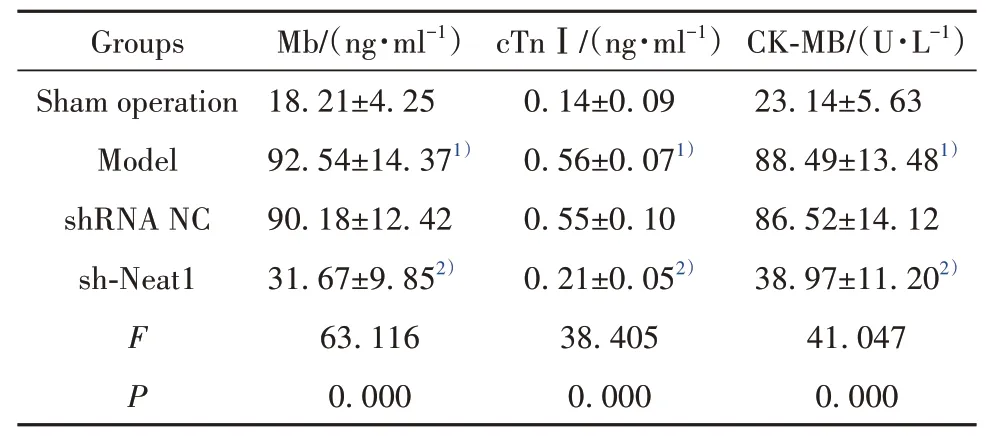
表1 各组大鼠心损伤标志物水平的比较(±s,n=5)Tab.1 Comparison on levels of myocardial injury markers among all groups(±s,n=5)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05.
?
2.3各组大鼠心功能情况的比较 与假手术组比较,模型组大鼠HR和LVEF降低(P<0.05);与模型组比较,sh-Neat1组HR和LVEF升高(P<0.05),但模型组和shRNA NC组上述指标比较差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠心功能情况的比较(±s,n=5)Tab.2 Comparison of cardiac function among all groups(±s,n=5)

表2 各组大鼠心功能情况的比较(±s,n=5)Tab.2 Comparison of cardiac function among all groups(±s,n=5)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05.
?
2.4各组大鼠氧化应激指标水平的比较 与假手术组比较,模型组大鼠MDA升高,SOD降低(P<0.05);与模型组比较,sh-Neat1组MDA降低,SOD升高(P<0.05),但模型组和shRNA NC组上述指标比较差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠氧化应激指标水平的比较(±s,n=5)Tab.3 Comparison on levels of oxidative stress indexes levels in rats of each group(±s,n=5)

表3 各组大鼠氧化应激指标水平的比较(±s,n=5)Tab.3 Comparison on levels of oxidative stress indexes levels in rats of each group(±s,n=5)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05.
?
2.5各组大鼠心肌组织病理变化的比较 如图1 HE染色显示,假手术组大鼠心肌纤维排列整齐,纤维结构清晰;模型组和shRNA NC组心肌排列紊乱,细胞间隙加大;sh-Neat1组心肌纤维排列趋于整齐,细胞间隙较模型组减小。

图1 各组大鼠心肌组织病理变化的比较Fig.1 Comparison of pathological changes in myocardial tissues of rats in each group
2.6各组大鼠心肌纤维化情况的比较 如图2,MASSON染色显示,假手术组表现为正常心肌细胞结构,无明显的细胞损伤和坏死;模型组和shRNA NC组有大量纤维癜痕组织形成;与模型组相比,sh-Neat1组纤维癜痕组织明显减少。
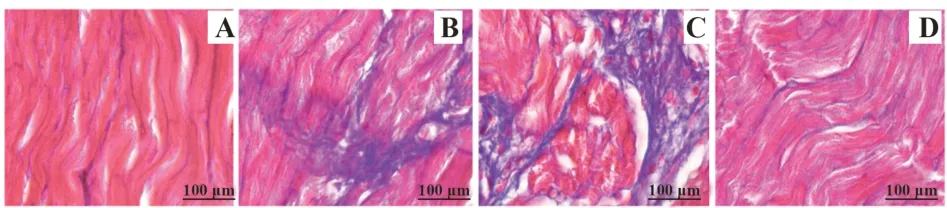
图2 各组大鼠心肌纤维化情况的比较Fig.2 Comparison of myocardial fibrosis in each group
2.7各组大鼠心肌组织中纤维化相关蛋白表达的比较 与假手术组比较,模型组大鼠心肌组织中α-SMA、TGF-β、FN表达上调(P<0.05);与模型组比较,sh-Neat1组α-SMA、TGF-β、FN表达下调(P<0.05),但模型组和shRNA NC组比较上述指标差异无统计学意义(P>0.05)。见图3、表4。
表4 各组大鼠心肌组织中纤维化相关蛋白表达的比较(±s,n=5)Tab.4 Comparison on expressions of fibrosis-related proteins in myocardial tissues of rats in each group(±s,n=5)
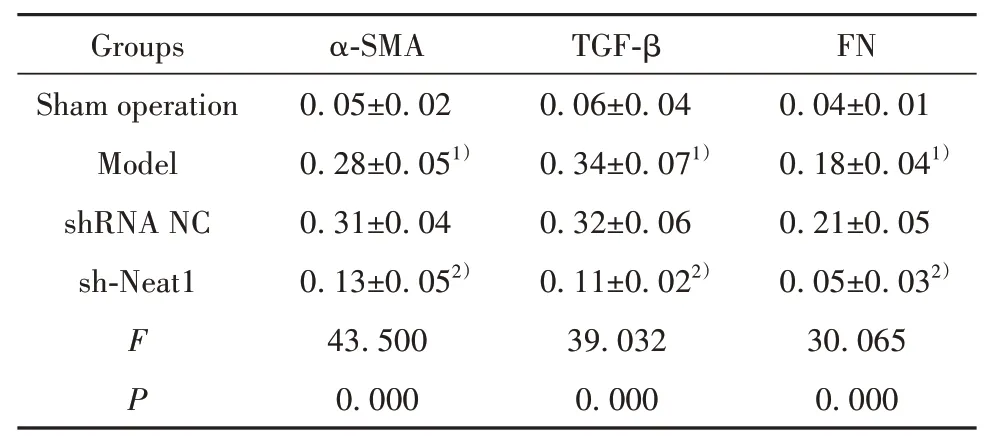
表4 各组大鼠心肌组织中纤维化相关蛋白表达的比较(±s,n=5)Tab.4 Comparison on expressions of fibrosis-related proteins in myocardial tissues of rats in each group(±s,n=5)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05.
?
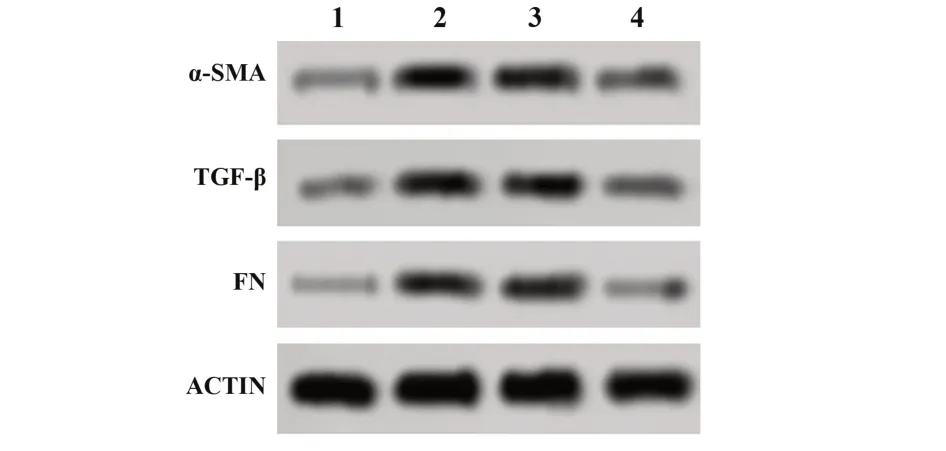
图3 各组大鼠心肌组织中纤维化相关蛋白表达Fig.3 Expressions of fibrosis-related proteins in myocardial tissue of rats in each group
2.8各组大鼠心肌组织IL-6、TNF-α及NF-κB P65磷酸化水平的比较 与假手术组比较,模型组大鼠心肌组织IL-6和TNF-α mRNA、p-NF-κB P65/NF-κB P65水平上调(P<0.05);与模型组比较,sh-Neat1组IL-6和TNF-α mRNA、p-NF-κB P65/NF-κB P65水平下调(P<0.05),但模型组和shRNA NC组比较上述指标差异无统计学意义(P>0.05)。见图4、表5。
表5 各组大鼠心肌组织IL-6、TNF-α及NF-κB P65磷酸化水平的比较(±s,n=5)Tab.5 Comparison on phosphorylation levels of IL-6,TNF-α and NF-κB P65 in myocardial tissues rats in each group(±s,n=5)

表5 各组大鼠心肌组织IL-6、TNF-α及NF-κB P65磷酸化水平的比较(±s,n=5)Tab.5 Comparison on phosphorylation levels of IL-6,TNF-α and NF-κB P65 in myocardial tissues rats in each group(±s,n=5)
Note:Compared with sham operation group,1)P<0.05;compared with model group,2)P<0.05.
?

图4 各组大鼠血清心肌组织NF-κB P65磷酸化表达Fig.3 Comparison on expression of NF-κB P65 phosphorylation in serum myocardial tissues of rats in each group
2.9各组大鼠NF-κB P65细胞核转位情况 如图5,假手术组心肌细胞NF-κB P65表达于胞浆,模型组和shRNA NC组NF-κB P65在胞浆和胞核均有表达,但以胞核表达为主,而sh-Neat1组NF-κB P65表达以胞浆为主。
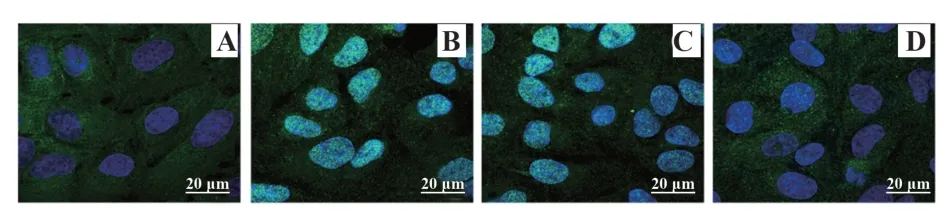
图5 各组大鼠NF-κB P65细胞核转位情况Fig.5 Nuclear translocation of NF-κB P65 cells in each group
3 讨论
再灌注是治疗心肌缺血的必要途径,但无法避免会加重心肌损伤[9]。因此,了解心肌缺血再灌注损伤具体机制,对于其临床防控具有重要的临床意义。Neat1广泛表达于各种组织中,对于多种生物学活动具有调控作用[10]。早期研究发现,Neat1作为促癌因子,参与肺癌、宫颈癌、肝癌等多种肿瘤的发生发展[11-13]。近年来,研究显示,WU等[14]通过建立心肌细胞缺氧复氧模型,发现敲低Neat1可能通过调控凋亡通路蛋白,抑制心肌细胞凋亡,从而起到保护心肌细胞的作用。但Neat1在心肌缺血再灌注损伤中的具体作用机制,仍有待进一步分析。
本研究结果显示,Neat1在心肌缺血再灌损伤大鼠模型中高表达,提示Neat1可能参与心肌缺血再灌注损伤的发生发展。心肌缺血再灌注损伤后,心肌收缩功能障碍,导致LVEF降低、HR升高,干扰Neat1表达后明显提高模型大鼠LVEF、降低HR,保护大鼠心功能,可能与减少Mb、cTnⅠ、CK-MB释放,减轻心肌细胞损伤有关。慢性纤维化是机体应对缺血损伤的一种修复过程,主要表现为间质纤维化和胶原沉着(FN、胶原蛋白等),α-SMA可反映成纤维化细胞的活化状态,而TGF-β信号转导在多种疾病的纤维化中有多重调节作用[15-16]。心肌缺血再灌注损伤后,心肌组织有大量纤维癜痕组织形成,心肌组织中α-SMA、TGF-β、FN表达上调,干扰Neat1后心肌纤维化程度减轻,可能与下调α-SMA、TGF-β、FN水平有关。同时,氧化应激损伤在缺血再灌注过程中也有重要的生理意义,CHEN等[17]研究发现,Neat1可促进炎症反应和氧化应激,参与动脉粥样硬化进程。本研究中,干扰Neat1表达后可以提高心肌SOD水平,减少MDA的合成,表明干扰Neat1对氧化应激水平的抑制,可能是减轻心肌损伤的途径之一。
心肌组织损伤是多因素共同作用的结果,既往研究证实,炎症反应是心肌缺血再灌注损伤的主要因素之一[18]。P65是NF-κB的一个亚基,正常生理状态下,NF-κB P65与NF-κB抑制因子(ⅠκB)以结合形式分布于细胞质中,当心肌缺血再灌注损伤发生时,刺激IκB的磷酸化和泛素化,磷酸化NF-κB P65将转移至细胞核中,会增加多种炎症因子的表达,加剧心肌损伤[19-20]。本研究显示,心肌缺血再灌注损伤中NF-κB P65磷酸化水平明显升高,NF-κB P65表达以胞核为主,提示损伤状态下,NF-κB P65异常激活进行核转移。干扰心肌中Neat1表达后,NF-κB P65表达以胞浆为主,NF-κB P65磷酸化水平明显降低,炎症因子IL-6、TNF-α mRNA水平也降低,提示干扰Neat1可抑制NF-κB P65的核移位,从而减轻心肌缺血再灌注损伤。
综上所述,lncRNA Neat1在心肌缺血再灌注损伤中高表达,干扰lncRNA Neat1后可保护大鼠心肌缺血再灌注损伤,改善心肌纤维化,可能与减少NF-κB P65细胞核转位有关。心肌缺血再灌注损伤的发生机制较为复杂,Neat1是否还可通过调控其他途径作用于心肌缺血再灌注损伤,还有待进一步研究。

