CX3CL1、CXCL10及CXCL5在慢性阻塞性肺疾病急性加重期患者中的表达及其预后评估价值①
李玄丹 李材忠 唐咏婕 蔡潇阳(儋州市人民医院呼吸内科,儋州 571799)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续性呼吸道症状和气流受限为主要特征的常见呼吸系统疾病。慢性阻塞性肺疾病急性加重期(acute exacerbation chronic obstructive pulmonary disease,AECOPD)是由COPD患者气道炎症反应进一步加重引发的急性呼吸道疾病,可导致肺功能恶化,增加了患者的住院时间、经济负担及病死率,严重危害患者的生命健康[1]。目前研究认为,AECOPD的发生发展与多种类型的炎症细胞、炎症介质和各种趋化因子有关[2]。CX3趋化因子配体1(CX3 chemokine ligand 1,CX3CL1)是一种具有趋化和促进炎症反应功能的跨膜糖蛋白,可活化T淋巴细胞及单核细胞募集,进而释放促炎因子,参与肺部疾病的炎症反应过程[3]。CX趋化因子配体10(CX chemokine ligand 10,CXCL10)是一种与免疫调节相关的趋化因子,可激活T细胞、巨噬细胞及杀伤细胞,参与免疫性炎症反应,在调节呼吸道疾病的免疫反应中发挥重要作用[4]。CXCL5作为一种趋化粒细胞的小分子蛋白,可参与调节气道的免疫应答及炎症反应,在呼吸道疾病的发生发展中发挥关键调控作用[5]。由此推测CX3CL1、CXCL10及CXCL5在AECOPD中具有巨大潜在价值。然而,CX3CL1、CXCL10及CXCL5在AECOPD中的表达情况及其与患者病情进展的关系尚未明确。为此,本研究通过检测COPD患者血清CX3CL1、CXCL10及CXCL5表达水平,分析其对AECOPD预后评估的价值,以期为AECOPD的治疗提供帮助。
1 资料与方法
1.1资料
1.1.1临床资料 选取2018年1月至2021年6月儋州市人民医院收治的COPD患者226例,其中男性141例,女性85例,年龄35~83岁,平 均 年 龄(62.85±11.42)岁。纳入标准:①COPD的诊断符合《慢性阻塞性肺疾病诊治指南(2021年修订版)》[6];②均为首次入院,病例资料完整,同意配合本次研究。排除标准:①合并恶性肿瘤、其他肺部疾病、感染性疾病及免疫性疾病者;②妊娠期、哺乳期女性。另选取体检正常的健康志愿者60例作为对照组,其中男性36例,女性24例,年龄37~80岁,平均年龄(63.48±10.50)岁。本研究经儋州市人民医院伦理委员会批准,患者知情同意。
1.1.2主要试 剂 与仪器CX3CL1、CXCL10及CXCL5 ELISA试剂盒均购自R&D公司;680型全自动酶标分析仪购自美国Bio-Rad公司。
1.2方法
1.2.1临床分组 所有患者入院后行心电监护,根据情况做机械通气,同时对患者进行去痰、吸氧、抗感染、纠正电解质及营养支持治疗。根据病情严重程度将226例COPD患者分为稳定期COPD组(124例)和AECOPD组(102例),并根据AECOPD患者发病入院后28 d的死亡情况将其分为存活组(64例)和死亡组(38例)。记录患者入院时的基线资料,包括年龄、性别、基础疾病、体质指数、心率、血压、白细胞数、动脉氧分压、动脉二氧化碳分压、第1秒用力呼气容积占预计值百分比(FEV1%)、第1秒用力呼气容积占用力肺活量的比值(FEV1/FVC)等。
1.2.2CX3CL1、CXCL10及CXCL5表 达 水 平 检测 所有受试者均于入院时或体检时采集空腹静脉血5 ml,以3 500 r/min、离心半径15.0 cm离心10 min分离血清待测。ELISA法检测CX3CL1、CXCL10及CXCL5表达水平。严格按照操作常规做高浓度和低浓度两个水平的室内质控,CX3CL1高浓度为>
205.60 pg/ml、低浓度为<145.30 pg/ml,CXCL10高浓度为>50.10 pg/ml、低浓度为<30.20 pg/ml,CXCL5高浓度为>120.40 pg/ml、低浓度为<95.80 pg/ml,质控结果均在控后才能进行样本检测。CX3CL1标准品的上限浓度为710.50 pg/ml、下限浓度为20.35 pg/ml,CXCL10标准品的上限浓度为350.60 pg/ml、下限浓度为5.20 pg/ml,CXCL5标准品的上限浓度为510.40 pg/ml、下限浓度为20.60 pg/ml。CX3CL1、CXCL10及CXCL5表达水平检测值均在标准品规定的上下限范围内。
1.3统计学方法 采用SPSS22.0统计软件分析数据,计量资料以±s表示,多组间比较采用单因素方差分析,组内采用SNK-q检验比较;两组间采用t检验比较。计数资料的比较采用χ2检验。应用多因素Logistic回归分析影响AECOPD预后的危险因素。绘制受试者工作特征(ROC)曲线分析CX3CL1、CXCL10及CXCL5对AECOPD患者预后评估的价值。相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1AECOPD患者死亡组和存活组临床资料比较 死亡组病程、FEV1%与存活组相比差异有统计学意义(P<0.001);其他指标比较差异均无统计学意义(P>0.05)。见表1。

表1 AECOPD患者死亡组和存活组临床资料比较Tab.1 Comparison of clinical data between death group and survival group of AECOPD patients
2.2AECOPD组、COPD组和对照组血清CX3CL1、CXCL10及CXCL5水平比较AECOPD组和COPD组血清CX3CL1、CXCL10及CXCL5水平均明显高于对 照 组,且AECOPD组 血 清CX3CL1、CXCL10及CXCL5水平均明显高于COPD组,差异有统计学意义(P<0.001)。见表2。
表2 AECOPD组、COPD组 和 对 照 组 血 清CX3CL1、CXCL10及CXCL5水平比较(±s,pg/ml)Tab.2 Comparison of serum CX3CL1,CXCL10 and CXCL5 levels in AECOPD group,COPD group and control group(±s,pg/ml)
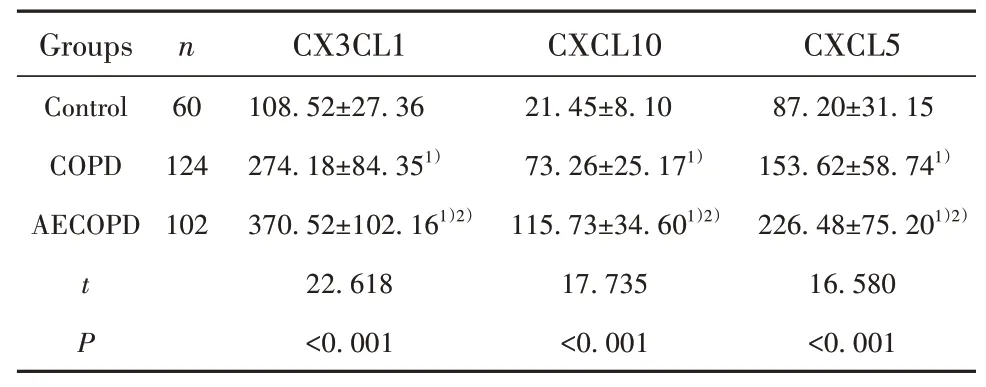
表2 AECOPD组、COPD组 和 对 照 组 血 清CX3CL1、CXCL10及CXCL5水平比较(±s,pg/ml)Tab.2 Comparison of serum CX3CL1,CXCL10 and CXCL5 levels in AECOPD group,COPD group and control group(±s,pg/ml)
Note:Compared with control group,1)P<0.05;compared with COPD group,2)P<0.001.
?
2.3AECOPD患者死亡组和存活组血清CX3CL1、CXCL10及CXCL5水平比较 死亡组患者血清CX3CL1、CXCL10及CXCL5水平均明显高于存活组,差异有统计学意义(P<0.001)。见表3。
表3 AECOPD患者死亡组和存活组血清CX3CL1、CXCL10及CXCL5水平比较(±s,pg/ml)Tab.3 Comparison of serum CX3CL1,CXCL10 and CXCL5 levels between death group and survival group of AECOPD patients(±s,pg/ml)

表3 AECOPD患者死亡组和存活组血清CX3CL1、CXCL10及CXCL5水平比较(±s,pg/ml)Tab.3 Comparison of serum CX3CL1,CXCL10 and CXCL5 levels between death group and survival group of AECOPD patients(±s,pg/ml)
Note:Compared with survival group,1)P<0.001.
?
2.4多因素Logistic回归分析影响AECOPD预后的危险因素 以AECOPD患者28 d是否发生死亡为因变量,有统计学意义的因素为自变量,进行多因素Logistic回归分析,结果显示病程、CX3CL1、CXCL10及CXCL5是影响AECOPD预后的危险因素。见表4。

表4 多因素Logistic回归分析影响AECOPD预后的危险因素Tab.4 Multivariate Logistic regression analysis of risk factors affecting prognosis of AECOPD
2.5CX3CL1、CXCL10及CXCL5对AECOPD患者预后评估的价值 以AECOPD患者28 d发生死亡组为研究对象,存活组作为参考线绘制ROC曲线,结 果 显 示CX3CL1为390.42 pg/ml、CXCL10为
124.38 pg/ml及CXCL5为241.35 pg/ml时,其 对AECOPD患者预后评估的曲线下面积(AUC)均>0.810。CX3CL1、CXCL10及CXCL5三 项 联 合 对AECOPD患者预后评估的AUC高达0.937,敏感度为96.8%,特异度为84.5%。见表5、图1。

表5 CX3CL1、CXCL10及CXCL5对AECOPD患者预后评估的价值Tab.5 Value of CX3CL1,CXCL10 and CXCL5 in evaluating prognosis of AECOPD patients

图1 CX3CL1、CXCL10及CXCL5对AECOPD患者预后评估的ROC曲线Fig.1 ROC curve of CX3CL1,CXCL10 and CXCL5 for prognosis of AECOPD patients
2.6CX3CL1、CXCL10及CXCL5间 的 相 关 性 分析Pearson相关分析显示,AECOPD患者血清CX3CL1水 平 与CXCL10呈 正 相 关(r=0.852,P<0.001),CX3CL1水平与CXCL5呈正相关(r=0.807,P<0.001),CXCL10水平与CXCL5呈正 相 关(r=0.783,P<0.001)。见图2。

图2 CX3CL1、CXCL10及CXCL5间的相关性Fig.2 Correlation between CX3CL1,CXCL10 and CXCL5
3 讨论
AECOPD患者在短期内可出现呼吸系统症状加重,并加速肺功能下降及病情恶化,进而导致肺心病和呼吸衰竭的发生,是造成患者病死的主要原因[7]。目前,关于AECOPD患者的预后评估尚缺乏可靠的生物学指标,寻找一种有效的分子标志物对AECOPD患者进行早期预后评估,有助于指导患者的救治及提高患者存活率。近年研究认为,气道炎症反应的放大和趋化功能、免疫调节功能的紊乱在AECOPD进展中发挥极为关键的作用[8]。CX3CL1是一种具有独特结构和功能的趋化因子,可通过诱导促炎因子的产生调节机体炎症反应,在肺部疾病炎症反应中具有重要促炎作用[9]。CXCL10作为趋化因子家族的重要成员之一,是定位于染色体4q21上的小分子分泌蛋白,可促进机体炎症反应,对COPD的发生发展过程发挥重要调控作用[10]。CXCL5是由上皮中性粒细胞产生的趋化因子,具有强大的粒细胞趋化作用,可促使中性粒细胞参与炎症反应及免疫应答,在炎症性呼吸疾病中发挥重大影响[11]。
本研究显示,AECOPD组和COPD组血清CX3CL1、CXCL10及CXCL5水平均明显高于对照组,且AECOPD组明显高于COPD组,说明CX3CL1、CXCL10及CXCL5水平与COPD患者病情严重程度有关,其水平越高,患者病情进展越快。WANG等[12]研究显示,CXCL10在COPD患者中高表达,与COPD患者肺功能的严重程度明显相关,可为COPD的诊断及预后提供重要信息。本研究中死亡组血清CX3CL1、CXCL10及CXCL5水平均明显高于存活组,说明CX3CL1、CXCL10及CXCL5水平与AECOPD患者预后有关,其水平越高,患者预后越差,发生死亡的风险较高。HAO等[13]研究发现,与健康对照组相比,COPD患者血清中CXCL10及CX3CL1水平显著提高,其参与COPD的发病机制,并对预测COPD患者的进展具有一定价值。另有研究认为,COPD患者血清CX3CL1水平显著升高,其水平升高与COPD患者的全身炎症、小气道阻塞有关,在COPD的发病机制中起关键作用,可能为COPD的诊断及治疗提供帮助[14]。
本研究多因素Logistic回归分析显示,病程、CX3CL1、CXCL10及CXCL5是影响AECOPD预后的危险因素。HAO等[15]研究也显示,COPD患者血清CX3CL1水平明显升高,且高水平的CX3CL1与COPD患者病情加重及肺气肿密切相关,是预测COPD患者病情加重的危险因素(OR=2.617,95%CI:1.018~6.121)。此外,本研究中病程长可加重AECOPD病情,对AECOPD患者的预后产生较大影响,与既往研究结果相似[16]。本研究应用ROC曲线 分 析 发 现CX3CL1为390.42 pg/ml、CXCL10为
124.38 pg/ml及CXCL5为241.35 pg/ml时,其 评 估AECOPD患者预后的AUC均大于0.810,三项联合的AUC高达0.937(95%CI:0.874~0.986),敏感度最高。相关性分也显示CX3CL1、CXCL10及CXCL5间具有良好的正相关性,说明三项联合评估AECOPD患者预后的效能最好,具有很好的临床应用价值。这可能是CX3CL1及CXCL10通过诱导促炎因子产生,促进CXCL5对中性粒细胞的趋化作用,三者间相互作用参与了机体炎症反应,在AECOPD的发生发展过程中发挥了重要作用。CHEN等[17]研究也发现,血清CXCL5水平在COPD患中显著升高,其与COPD发病过程及病情严重程度相关,可能作为COPD诊断及预后评估的潜在标志物。另有研究表明,与健康者相比,COPD患者CX3CL1水平显著升高,CX3CL1的上调与COPD患者肺功能不良显著相关,CX3CL1升高是导致COPD患者临床疗效差和预后差的独立因素,可作为COPD预后评估的可靠生物标志物[18]。
综上所述,血清CX3CL1、CXCL10及CXCL5水平在AECOPD患者中明显升高,是影响AECOPD预后的危险因素,三项联合检测对AECOPD患者预后评估具有较好的价值,有望作为评估AECOPD患者28 d死亡情况的生物学指标。但本研究为单中心的临床研究,随访时间短,无法全面评估CX3CL1、CXCL10及CXCL5在AECOPD中的长期变化,今后仍需更多的大样本前瞻性研究来进行深入分析。

