CD83重组蛋白的原核表达、复性纯化及多克隆抗体制备①
马 宁 李兴杰 姜鸿宇 徐国锋 王 星 张宗德
(西南医科大学附属医院炎症与变态反应实验室,泸州 646000)
CD83分子在许多细胞中均有表达,但主要由活化的免疫细胞,如树突状细胞(dendritic cells,DCs)、B细胞和T细胞等表达和分泌。CD83是成熟DCs高度稳定表达的Ⅰ型跨膜糖蛋白,被认为是DCs成熟的标志物。DCs是体内最重要的抗原呈递细胞,DCs成熟后通过释放特定细胞因子调控CD4+T细胞的分化,发挥其在抵抗病原感染引起免疫反应中的核心作用。大量研究表示,不同病毒可以调节CD83的表达水平改变DCs的功能。疱疹病毒能够通过靶向CD83形成获得性免疫逃逸机制[1]。水痘带状疱疹病毒感染时可选择性抑制DCs上CD83的表达[2-3]。相反,在前期研究中,本课题组发现禽流感病毒及其神经氨酸酶能够上调DCs和巨噬细胞表面CD83表达,进而促使小鼠产生急性肺部炎症[4]。由此可见,CD83在病毒感染致病过程中发挥重要作用。
CD83通常以膜结合型和可溶性型两种形式表达。在正常人类血清中能检测到从活化的DC和B细胞中释放的可溶性CD83(soluble CD83,sCD83),这种sCD83具有很强的免疫抑制功能[5]。有研究表明,sCD83可抑制单核细胞向DCs分化,改变DCs的细胞骨架,阻止DCs成熟,并降低DCs介导的T细胞增殖[6-8]。此外,sCD83可作为免疫抑制剂在自身免疫系统疾病及器官移植排斥反应中发挥抗炎作用[9-10]。另有研究表明,CD83单克隆抗体能够抑制DCs成熟发挥免疫抑制功能[11]。靶向CD83可以抑制小鼠自身免疫性疾病和过敏反应[12-13]。此外,特异性抑制CD83可减轻单纯疱疹病毒感染引起的小鼠全身炎症反应[14]。这些研究提示,在自身免疫系统疾病、过敏及病毒感染等条件下,使用sCD83或CD83抗体特异性靶向CD83处理,能够发挥免疫抑制作用,展现抗炎、抗病毒效果。
本研究首先通过构建鼠源CD83胞外结构域(Met1-Arg133)的重组质粒,将质粒在TOP10F'原核表达系统中表达。其次,通过包涵体变性、复性纯化获得了CD83重组蛋白。最后,使用纯化获得的CD83重组蛋白及QuickAntibody-2W免疫佐剂免疫SD大鼠2周,获得了滴度高、特异性强的CD83多克隆抗体。本研究为后续sCD83和CD83抗体在抗炎、抗病毒过程中的免疫抑制机制的研究提供了支持。
1 材料与方法
1.1材料
1.1.1菌种、细胞株及表达质粒 表达宿主菌TOP10F'感受态购自昂宇生物公司。肺巨噬细胞系Raw264.7购自中国科学院干细胞库。pGEX-2TCD83(Met1-Arg133)表达质粒由优宝生物构建。
1.1.2主要试剂LB肉汤、氨苄西林(Ampcillin,Amp)、Tris-HCl、NaCl、甘 油、EDTA、聚 乙 二 醇PEG6000、十二烷基肌氨酸钠(SKL)、二硫苏糖醇(DTT)、IPTG、氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)购自索莱宝科技有限公司;BeyoGoldTMGST-tag Purification Resin、考马斯亮蓝超快染色液、GST Mouse Monoclonal Antibody、辣根过氧化物酶标记山羊抗大鼠IgG(H+L)、辣根过氧化物酶标记驴抗山羊IgG(H+L)购自碧云天生物技术有限公司(Beyotime);CD83 Polyclonal Antibody(PA5-47138)、山羊抗大鼠IgG(H+L)交叉吸附二抗Alexa Fluor 488(A-11006)购自Invitrogen公司;CD83-Fc重组蛋白购自Sino biological公司。
1.1.3实验动物 体质量约300 g的SD大鼠购自西南医科大学实验动物中心。
1.2方法
1.2.1重组菌诱导表达 将pGEX-2T-CD83(Met 1-Arg 133)质粒转染至TOP10F'感受态后,涂布至LB+Amp(100 µg/ml)培养平板上,O/N培养。挑取单个克隆接种至5 ml LB+Amp培养液中,37℃、150 r/min扩增培养。当OD600nm达到0.6~0.9时,将5 ml培养液全部转移至含有400 ml LB+Amp培养液的三角瓶中继续培养至OD600nm约为0.8时,加入终浓度为0.2 mmol/L的IPTG,25℃诱导表达12~16 h。收集菌体,用无菌PBS悬浮洗涤沉淀3次后,保存于-80℃条件下。
1.2.2包涵体复性
1.2.2.1包涵体超声破碎 称重回收获得菌体沉淀,按照1 g/35 ml的比例加入buffer A(50 mmol/L Tris-HCl,0.5 mmol/L EDTA,50 mmol/L NaCl,5%甘油,5 mmol/L DTT,pH7.9)重悬菌体,液氮反复冻融3次;在冰浴中超声破碎菌体(功率200 W,工作8 s,间歇6 s);超声破碎5 min,4℃、10 000 r/min离心10 min,回收包涵体沉淀。
1.2.2.2包涵体洗涤 使用无菌PBS洗涤回收得到的包涵体沉淀,重复3次,4℃、10 000 r/min离心10 min,收集包涵体沉淀。
1.2.2.3包涵体变性 向1.2.2.2中回收得到的包涵体中按比例加入buffer A及20%SKL贮存液,使得SKL终浓度为0.3%,剧烈搅动使沉淀慢慢溶解,4℃静置约6 h溶解;将溶解悬液4℃、10 000 r/min离心10 min,收集上清。
1.2.2.4包涵体复性 向1.2.2.3中回收得到的上 清 液 中 加 入20%PEG6000、50 mmol/L GSSG和100 mmol/L GSH至终浓度分别为0.2% PEG6000、1 mmol/L GSSG和2 mmol/L GSH;4℃、O/N静 置复性。
1.2.2.5透析 将1.2.2.4中复性得到的溶液装入MD44(3500D)透析袋中;在4℃条件下,使用无菌PBS进行搅拌透析,每12 h换液1次,24 h后回收复性液。
1.2.2.6蛋白结合及洗脱 回收1.2.2.5中得到的复性液,按500 µl/35 ml的比例加入BeyoGoldTMGST-tag Purification Resin,4℃旋转结合3 h;将结合后的复性液加入亲和层析柱空柱管进行流穿,PBS洗涤GST-resin后,用溶出液(buffer A+50 mmol/L Tris-HCl、12 mmol/L GSH),按2 min/滴的流速洗脱溶出。每500µl为1个溶出组分,回收至第4个溶出组分。
1.2.3SDS-PAGE、Western blot及ELISA检测目的蛋白活性
1.2.3.1SDS-PAGE、Western blot将洗脱获得的样品进行SDS-PAGE,电泳完成后将凝胶用去离子水洗涤5 min,弃去离子水加入适量的考马斯亮蓝超快染色液,室温水平摇动染色1 h;染色完成后回收染色液,加入适量去离子水洗涤5 min;弃去离子水,将冰乙酸∶乙醇∶去离子水按1∶4∶5混合配制洗脱液洗脱凝胶;当蛋白条带清晰后拍照,使用Image J计算各蛋白条带灰度值;以BSA相应浓度制作标准曲线,定量洗脱样品中CD83蛋白的浓度;或将电泳完成后凝胶进行Western blot,检测CD83目的蛋白的特异性。
1.2.3.2ELISA检测蛋白活性 将唾液酸凝集素SNA(20 µg/ml)包被于ELISA板上,4℃孵育过夜。经1%BSA封闭后,将GST-CD83重组蛋白(10µg/ml)及CD83-Fc蛋白(10 µg/ml)加入到板孔中,与SNA在37℃孵育3 h。1×PBST洗平板2次,然后用CD83一抗在室温孵育1 h。经1×PBST洗涤后,加入辣根过氧化物酶标记驴抗山羊IgG标记的二抗。用TMB显色液显色,在450 nm下读取吸光值。
1.2.4制备多克隆抗体
1.2.4.1免疫大鼠 将纯化获得的CD83重组蛋白与QuickAntibody-2W免疫佐剂等体积混合,通过后腿小腿肌肉注射免疫SD大鼠,每只SD大鼠左、右腿各注射1针,免疫剂量约为200µg/只;待免疫7 d后等剂量加强免疫1次;当合计免疫14 d时尾静脉采血,检测血清效价;当血清效价达1∶104~1∶105时,取大鼠腹主动脉血;4℃、O/N静置后,3 000 r/min离心10 min回收血清。
1.2.4.2血清效价检测 将纯化得到的CD83重组蛋白稀释后按100µg/ml与包被液混合,4℃、O/N包被于酶标板中;经1×PBST洗涤3次、1%BSA封闭后,将免疫所得血清用1×PBST按1∶10稀释至1∶108后加入酶标板中,37℃孵育1 h;以未免疫大鼠的血清作为阴性对照;经1×PBST洗涤后加入辣根过氧化物酶标记山羊抗大鼠IgG(H+L)二抗,37℃孵育1 h;经1×PBST洗涤后加入TMB显色液显色,测定效价[28]。
1.2.4.3免疫荧光染色 将肺巨噬细胞Raw264.7在有盖玻片的24孔板中培养至对数期,经1×PBST洗涤后,用4%甲醛固定。经1×PBST洗涤3次后,用1%BSA封闭。用免疫大鼠所得的CD83多克隆抗体进行孵育,4℃过夜。次日,用Alexa Fluor 488山羊抗大鼠IgG二抗孵育1 h。最后,运用DAPI进行细胞核染色后观察。图像采用奥林巴斯FV1000共焦显微镜在恒定曝光时间下获得。
2 结果
2.1CD83载体的构建 首先,经NCBI检索,本课题组比对了Human、Rat及Mouse CD83细胞外结构域氨基酸序列,其中相同序列占总比的58.04%,相似序列占总比的92.26%(见图1)。由于鼠源CD83胞外结构域与人源CD83相似度较高,且鼠源CD83重组蛋白相关研究较少,因此选择鼠源CD83的NM_009856转录本,将该转录本编码CD83胞外结构域的399个碱基作为模板。其次,课题组设计了含有限制性内切酶BamHⅠ/EcoRⅠ基因序列的引物,通过PCR、限制性内切酶酶切、T4 DNA连接酶连接,将CD83胞外结构域399个碱基装载到pGEX-2T载体上。最后,通过BamHⅠ/EcoRⅠ酶切电泳得到了约400 bp的条带,如图2所示。此外,测序结果显示,装载在pGEX-2T载体上的399个碱基为编码CD83胞外结构域的相应碱基且无突变位点(图2)。表明CD83原核表达系统载体pGEX-2T-CD83(Met1-Arg133)构建成功。
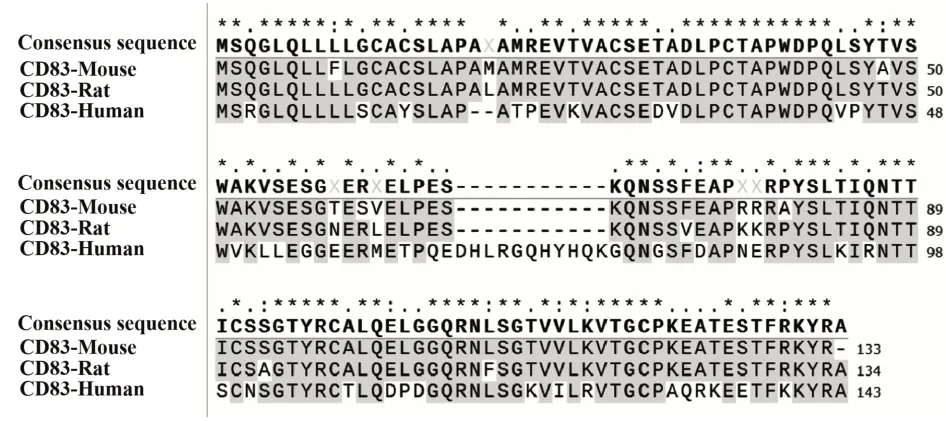
图1 Human、Rat、Mouse CD83细胞外结构域氨基酸序列对比图Fig.1 Comparison of amino acid sequences in extracellular domain of Human,Rat,and Mouse CD83
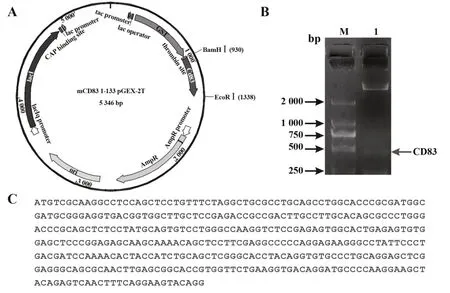
图2 CD83重组质粒模式图及电泳鉴定图Fig.2 Model diagram and electrophoresis identification diagram of CD83 recombinant plasmid
2.2CD83重组蛋白的表达 将构建所得CD83质粒转染至TOP10F'表达菌株中培养、IPTG诱导表达。使用裂解液裂解回收得到的菌体,通过SDSPAGE、考马斯亮蓝染色后分析发现,在上清液中并未检测到GST-CD83蛋白或检测到的表达量极少。调整IPTG浓度、诱导温度和诱导时间(0.1 mmol/L、37℃、4 h,0.1 mmol/L、16℃、O/N,0.2 mmol/L、25℃、O/N)以及检测裂解后回收的沉淀后发现,在沉淀中能检测到大量GST-CD83蛋白(约39.5 kD)。表明在原核表达系统中GST-CD83蛋白大多以包涵体形式表达,而诱导表达的最佳条件为:0.2 mmol/L IPTG、25℃、O/N(12~16 h)(图3)。
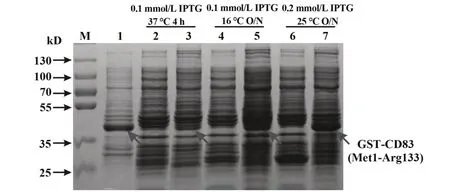
图3 SDS-PAGE分析CD83表达情况Fig.3 Analysis expression of CD83 by SDS-PAGE
2.3CD83重组蛋白的包涵体复性及纯化 首先,采用IPTG的最佳诱导条件诱导得到菌体,经PBS洗涤、裂解液裂解、超声波超声后回收得到菌体沉淀。其次,使用0.3%SKL将包涵体溶解变性,利用透析法进行包涵体复性。最后,使用GST亲和层析纯化获得GST-CD83蛋白,通过SDS-PAGE、考马斯亮蓝染色及Western blot分析CD83蛋白的纯化情况及特异性。使用BSA定量GST-CD83的蛋白浓度。如图4A、图5所示,GST-tag resin能够结合绝大部分复性液中的GST-CD83蛋白,且通过洗脱液洗脱下的GST-CD83蛋白特异性较高。因此表明,使用SKL溶解、透析复性、GST亲和层析纯化以及BSA定量,能够获得高效、稳定及高浓度的CD83重组蛋白。CD83是一种唾液酸糖蛋白,因此通过检测其与唾液酸凝结素SNA的结合情况检测蛋白活性。结果显示,GST-CD83与SNA的结合效果与商品化CD83-Fc相近(图4B)。
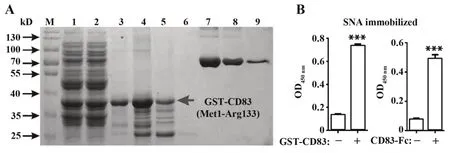
图4 CD83重组蛋白的活性测定Fig.4 Activity determination of CD83 recombinant protein
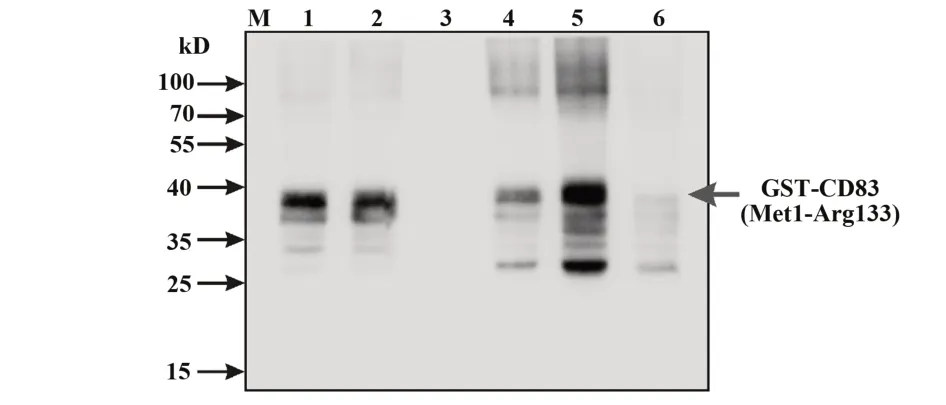
图5 Western blot分析CD83表达特异性Fig.5 Analysis specificity of CD83 by Western blot
2.4CD83多克隆抗体的制备及鉴定 以纯化得到的GST-CD83蛋白作为抗原,使用QuickAntibody-2W免疫佐剂与既定剂量抗原进行混合后免疫SD大鼠。在第1次免疫7 d后使用相同剂量抗原进行加强免疫1次。在免疫开始后的第14天进行采血回收血清,使用ELISA法检测血清中的抗体效价。如图6A所示,以未免疫的大鼠血清为阴性对照做对比后观察到,CD83多克隆抗体的效价约为1∶104~1∶105。此外,运用免疫荧光染色检测CD83多克隆抗体的活性(图6B)。结果显示,该多克隆抗体免疫结合肺巨噬细胞Raw264.7细胞表面CD83,与已发表论文中商品化CD83抗体的免疫染色结果一致[4]。表明从该原核表达系统中获得的GST-CD83蛋白能够作为稳定抗原免疫动物;而与传统免疫佐剂相比,QuickAntibody-2W免疫佐剂的抗体产生快、抗体滴度高等优点,缩短了抗体的制备周期,为免疫动物、抗体制备提供新的思路。
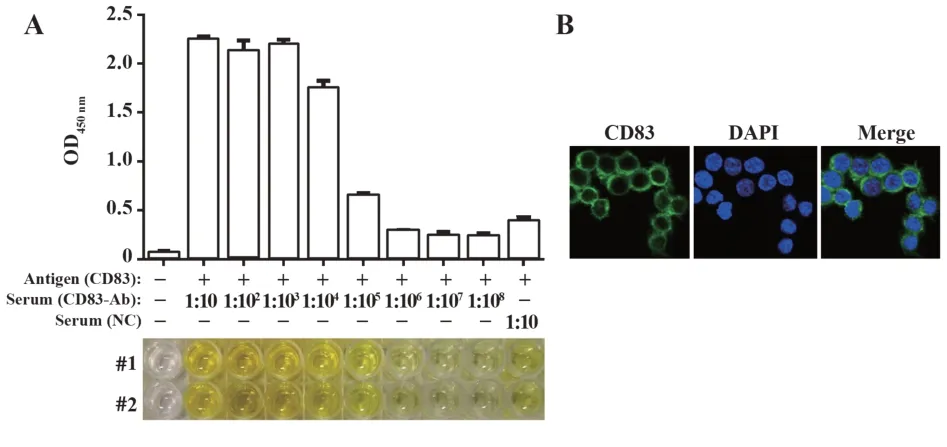
图6 ELISA检测CD83抗体的抗体效价及免疫活性Fig.6 Antibody titer and immunoactivity of CD83 antibody were detected by ELISA
3 讨论
CD83是免疫球蛋白超家族成员之一。CD83有两种蛋白质类型,一种是膜结合形式(membrane CD83,mCD83),另 一 种 是 可 溶 性 形 式(soluble CD83,sCD83)[5]。膜结合蛋白mCD83由胞浆结构域、跨膜结构域和胞外结构域组成。在哺乳动物中,mCD83表达于多种免疫细胞表面,被认为是免疫细胞表面的激活标志,包括T细胞、B细胞、DCs及巨噬细胞等。其中,mCD83在活化的DCs和其他抗原呈递细胞表面的表达使其成为一个有吸引力的治疗靶点,实现选择性免疫抑制。有研究显示,疱疹病毒能够靶向mCD83形成获得性免疫逃逸,建立潜伏期[1]。此外,水痘带状疱疹病毒感染时可选择性抑制DCs上mCD83的表达[2-3]。相反,有研究发现EB病毒(epstein-barr virus,EBV)能够促进B细胞上mCD83的表达[15]。同时,本课题组前期研究显示,禽流感病毒H9N2突变体强毒株能够上调DCs和巨噬细胞等免疫细胞表面mCD83的表达,进而促使小鼠产生急性肺部炎症[4]。
关于sCD83,有研究发现在健康人血清中可检测到低水平的sCD83,但在造血系统恶性肿瘤或自身免疫性疾病患者血清中可检测到较高水平[16-18]。另外,在健康小鼠血清中检测到的sCD83水平极低,但在孕期小鼠或诱导自身免疫小鼠血清中检测到sCD83的水平将会升高[13,19]。细胞培养实验则证实,大多数sCD83是由活化的B细胞和DC细胞,以及小鼠的Treg细胞分泌产生[19-21]。小鼠CD83与人类CD83的细胞外结构部分均包含一个V型免疫球蛋白结构域,且有63%的氨基酸同源性。虽然,这两物种天然sCD83的序列仍未被证实,目前还不清楚该产物是否来源于mCD83或CD83剪接变异体细胞外部分的剪切[22]。但有研究显示,重组可溶性CD83胞外结构域(recombinant soluble extracellular CD83,rsCD83)能够模仿天然sCD83变体,在自身免疫性疾病的动物模型和移植中显示了强大的免疫抑制特性[23-25]。
由于mCD83在多种免疫细胞表面表达且sCD83在恶性肿瘤及自身免疫性疾病中高分泌、高表达等特性,CD83将成为一个有效的治疗靶点,特异性靶向CD83将能为多种疾病的治疗提供手段。研究显示,在移植物抗宿主病(graft-vs-host disease,GVHD)的临床前模型中CD83特异性抗体具有清除CD83+细胞的能力[26]。另有研究表明,特异性抑制CD83可减轻单纯疱疹病毒感染引起的小鼠全身炎症反应[14]。此外,抗CD83抗体在其他炎症环境中也能够呈现免疫抑制效果,如在巨细胞动脉炎(giant cell arteritis,GCA)的异种小鼠模型中得到了证明[27]。本课题组的前期研究发现抗CD83多克隆抗体能够降低禽流感病毒H9N2突变株引起的细胞因子风暴,进而降低小鼠肺部急性炎症反应[4]。
本研究通过将鼠源CD83胞外结构域399个碱基装载到含有GST融合蛋白的pGEX-2T载体上,成功构建了CD83的原核表达质粒。将质粒转染至TOP10F'原核表达菌株并优化IPTG的诱导条件,明确了GST-CD83的包涵体表达形式及最佳诱导条件。将诱导表达得到的菌体沉淀,利用包涵体变性、复性及GST亲和层析获得了CD83重组蛋白。最后,将获得的重组CD83蛋白与QuickAntibody快速免疫佐剂免疫SD大鼠,快速、高效地获得了CD83的多克隆抗体。因此,本研究获得CD83重组蛋白及CD83多克隆抗体的方法,不仅能够为sCD83和CD83抗体的制备提供新思路,还能够为后续sCD83和CD83抗体在抗炎、抗病毒过程中免疫抑制机制的相关研究提供支持。

