枸杞多糖调控Wnt信号通路对子宫肌瘤细胞生物活性的影响
谭建福 饶丽娟 (南华大学附属长沙中心医院妇产科,长沙 410004)
子宫肌瘤是女性高发的非恶性肿瘤疾病,由子宫平滑肌增生导致,30~50 岁女性是高发人群,患者临床主要以腹部疼痛及月经量增多为主[1]。流行病调查显示,子宫肌瘤发病率占女性肿瘤的50%以上,被称为妇科第一瘤[2]。子宫肌瘤影响因素较多,包含雌激素和性激素等,同时受局部多肽类物质影响,在生育期产生,绝经期肿瘤病灶逐渐萎缩。文献证实,子宫肌瘤虽然不会导致患者死亡,但临床疼痛及其他症状会影响患者身心健康及生存质量[3]。Wnt 信号通路参与子宫肌瘤产生及发展,主要通过调节β-catenin 磷酸化和降解,导致β-catenin在细胞核内聚集,与受体结合时,细胞质中的β-catenin移位到细胞核中进而激活靶基因。相关研究表示,Wnt信号通路抑制剂能够通过减少子宫肌瘤细胞中细胞质和细胞核中β-catenin 表达进而下调与通路相关的靶基因[4]。因此,了解Wnt 信号通路在子宫肌瘤中的作用对临床研究具有重要意义。
中药在抗肿瘤研究中发挥关键作用,枸杞归肝肾经,性微寒无毒,味甘、平,具有滋肾、明目等功效。枸杞多糖(lycium barbarum polysaccharides,LBP)是枸杞的主要成分,能够通过增加淋巴细胞功能提高免疫功能,具有抗氧化、抗肿瘤的作用[5]。目前对子宫肌瘤细胞的研究文献较少,因此,本文以此作为创新点,观察LBP 对子宫肌瘤细胞生物活性、Wnt信号通路的影响。
1 材料与方法
1.1 材料
1.1.1 标本来源 选择2019年1月至2020年1月,在南华大学附属长沙中心医院妇产科室进行子宫肌瘤剔除术的10 例患者,平均年龄(43.50±1.50)岁,术前未经全身治疗,将子宫肌瘤组织置于青链霉素的预冷D-Hanks 溶液中保存,后进行实验室分离培养子宫肌瘤细胞。
1.1.2 实验动物、药品、主要试剂与仪器 健康SD大鼠30只购自上海斯莱克实验动物有限责任公司,SPF 级,雌性未孕。LBP(含量50%,批号:2014 1208)购自宁夏宏德生物技术;DMEM 培养基购自中国深圳市百恩维生物;胎牛血清购自加拿大Hy‐clone公司;Wnt5b和β-catenin抗体购自Abcam;MTT试剂盒、二甲基亚砜(DMSO)购自上海研谨生物科技;TRIzol 购自北京柏莱斯特科技。蛋白电泳仪购自北京由莱普特科学仪器;RT-PCR 试剂盒和仪器购自上海康朗生物科技。
1.2 方法
1.2.1 子宫肌瘤大鼠建模及药物干预 30 只健康SD大鼠,随机分为5组:对照组、模型组、LBP低剂量组、中剂量组和高剂量组每组6只。除对照组外,其余各组大鼠肌内注射苯甲酸雌二醇注射液0.5 mg/kg,每周3 次,共12 周,继而肌内注射黄体酮注射液5 mg/kg,每周2 次,共4 周,大鼠子宫重量、子宫系数明显提高,子宫平滑肌形态紊乱,子宫形态学改变类似于人体子宫肌瘤病理形态学结构,提示造模成功,对照组在相同时间给予等量生理盐水。造模结束后,低剂量组、中剂量组和高剂量组大鼠分别给予10、50和100 mg/kg LBP灌胃,1次/d,连续14 d,对照组和模型组大鼠相同时间内给予相同剂量的生理盐水灌胃。
1.2.2 大鼠子宫系数计算 实验结束后,颈椎脱臼处死大鼠,分离大鼠子宫,称量,计算子宫系数,子宫系数(%)=子宫重量/体质量×100%。
1.2.3 人子宫肌瘤组织分离及子宫肌瘤细胞培养 将保存的子宫肌瘤组织中瘤核去除,预冷DHanks 溶液清洗表层血污,剪切成小块放入离心管中,15%消化液消化,水浴后摇晃消化,连续5 次,每隔1 h 收集滤液(200 目过滤),将离心机调整至3 000 r/min离心5 min,弃上清,预冷D-Hanks溶液沉淀检测存活率。细胞培养:放入培养基中制成细胞悬液,接种于培养瓶中,生长至85%~90%融合时,1∶3传代,取对数细胞进行实验。
1.2.4 细胞分组及药物干预 取对数生长细胞,细胞密度为5×105个/ml,将细胞随机分为4 组:子宫肌瘤组、低LBP 组、中LBP 组和高LBP 组,每组设置6 个复孔。药物干预:子宫肌瘤组加入等量的生理盐水,低、中、高LBP 组分别加入100、200、400 µg/ml的LBP,连续干预72 h。
1.2.5 MTT 法检测子宫肌瘤细胞存活率 传代方法将子宫肌瘤细胞以5×105个/ml 接种至96 孔板,更换含1%牛血清的培养基中同步消化后,每组设6个复孔,均加入5 mg/ml 的MTT 溶液20 µl,培养24 h、48 h 及72 h 后,弃培养液,每孔中加入50µl DMSO,摇匀后放入490 nm 波长下检测OD 值,取3 次平均值,细胞存活率(%)=[A加药−A凋零]/[A对照−A凋零]×100%。
1.2.6 流式细胞仪检测子宫肌瘤细胞凋亡率 5×105个/ml 子宫肌瘤细胞以0.125%胰蛋白酶消化后,置于PBS 溶液,予以洗涤,将离心机调整为3 000 r/min 离心5 min后,收集100µl细胞悬液后进行重悬,5 µl 的FITC AnnexinⅤ与5 µl PI 混合后染色,无光条件下,孵育15 min 后注入400 µl 结合缓冲液混匀,洗涤3次后记录细胞凋亡情况。
1.2.7 Transwell 小室检测子宫肌瘤细胞迁移和侵袭 5×105个/ml 子宫肌瘤细胞以50 mg/L 的基质胶稀释后加入小室上层,37 ℃下呈凝胶状态,上室中加入细胞悬液,下室中加入少量胎牛血清培养基,拭去残留细胞,0.1%结晶紫染色,计算子宫肌瘤侵袭细胞数。
1.2.8 Western blot 检测子宫肌瘤细胞Wnt5b 和β-catenin 蛋白表达 5×105个/ml 子宫肌瘤细胞以0.125%胰蛋白酶消化,高速离心后,保留血清样本。进行电泳,转至PVDF膜,TBS浸泡10 min,反复PBS 冲洗,5 min/次,分别加入兔抗人单克隆抗体Wnt5b、β-catenin 和GAPDH 抗体(1∶500),二抗(1∶2 000),分别杂交,PBS 冲洗3 次。将膜浸入ECL 工作液进行检测,获取图像。
1.2.9 qRT-PCR 检测子宫肌瘤细胞Wnt5b 和β-catenin mRNA 5×105个/ml 子宫肌瘤细胞以0.125%胰蛋白酶消化,冲洗后置于无菌试管中,提取RNA,75%乙醇离心,−80 ℃保存。将RNA转化为cDNA,加入Wnt5b和β-catenin抗体,内参采用β-actin,60 ℃预变性10 min,95 ℃变性,72 ℃退火,各30 s,95 ℃延伸,5 min,循环次数以40 次为准,2−ΔΔCt方法计算各组肺组织中Wnt5b 和β-catenin mRNA 相对表达水平,引物序列见表1。
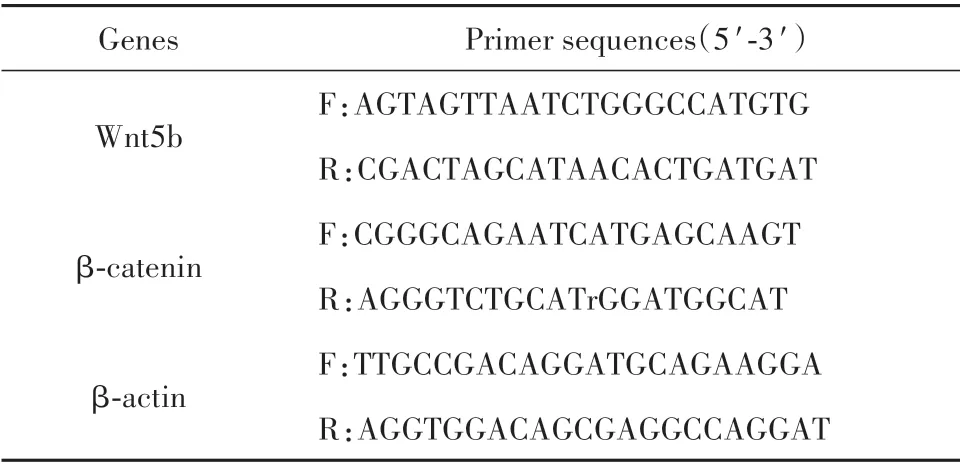
表1 引物序列Tab.1 Primer sequences
1.3 统计学分析 研究数据采用SPSS23.0软件分析,计量资料以±s表示,3 组及以上比较方差分析(单因素方法分析、重复测量方差分析),两组比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠子宫系数比较 与对照组相比,模型组大鼠体质量降低,子宫重量、子宫系数提高(P<0.05),与模型组相比,低、中及高剂量组大鼠子宫重量、子宫系数均降低,体质量增加,组间比较差异均有统计学意义(P<0.05)。见表2。
表2 各组大鼠子宫系数比较(±s,n=6)Tab.2 Comparison of rats uterine coefficients in each group(±s,n=6)
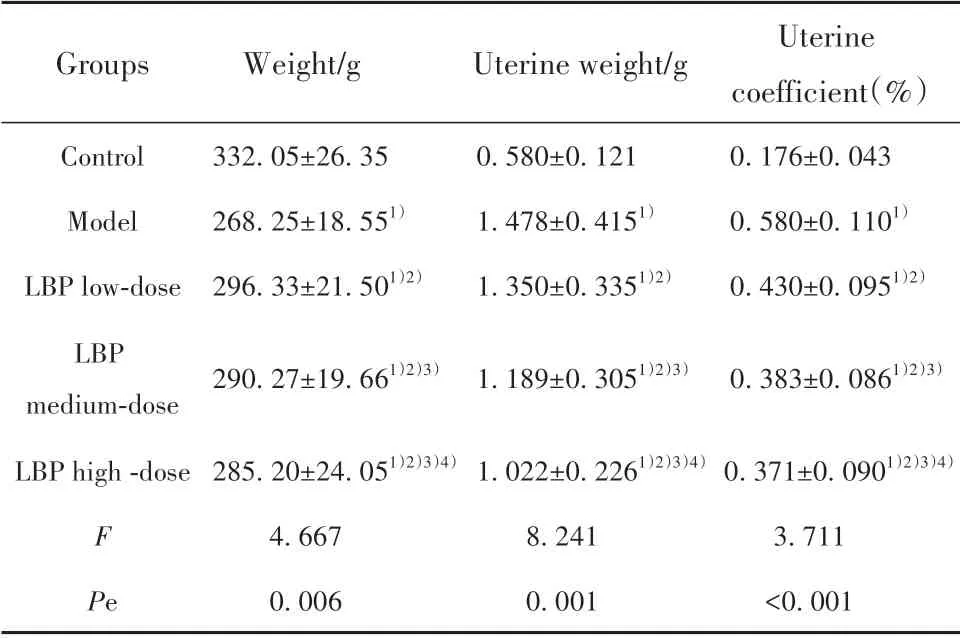
表2 各组大鼠子宫系数比较(±s,n=6)Tab.2 Comparison of rats uterine coefficients in each group(±s,n=6)
Note:1)P<0.05 vs control group;2)P<0.05 vs model group;3)P<0.05 vs LBP low-dose group;4)P<0.05 vs LBP medium-dose group.
Groups Weight/g Uterine weight/g Control Model LBP low-dose LBP medium-dose LBP high-dose F Pe 332.05±26.35 268.25±18.551)296.33±21.501)2)0.580±0.121 1.478±0.4151)1.350±0.3351)2)Uterine coefficient(%)0.176±0.043 0.580±0.1101)0.430±0.0951)2)290.27±19.661)2)3)1.189±0.3051)2)3)0.383±0.0861)2)3)0.371±0.0901)2)3)4)3.711<0.001 285.20±24.051)2)3)4)4.667 0.006 1.022±0.2261)2)3)4)8.241 0.001
2.2 CCK-8检测各组子宫肌瘤细胞存活率 CCK-8检测结果显示:低、中、高LBP 组24 h、48 h及72 h子宫肌瘤存活率均低于子宫肌瘤组(P均<0.05),子宫肌瘤组在24 h、48 h 及72 h 时差异无统计学意义(P均>0.05),低、中、高LBP 组在24 h细胞存活率差异无统计学意义(P>0.05),其余时间点均具有统计学意义(P均<0.05),见表3、图1。

图1 各组子宫肌瘤细胞存活率Fig.1 Survival rate of uterine fibroids in each group
表3 各组子宫肌瘤细胞存活率比较(±s)Tab.3 Comparison of cell survival rate of uterine fi⁃broids in each group(±s)
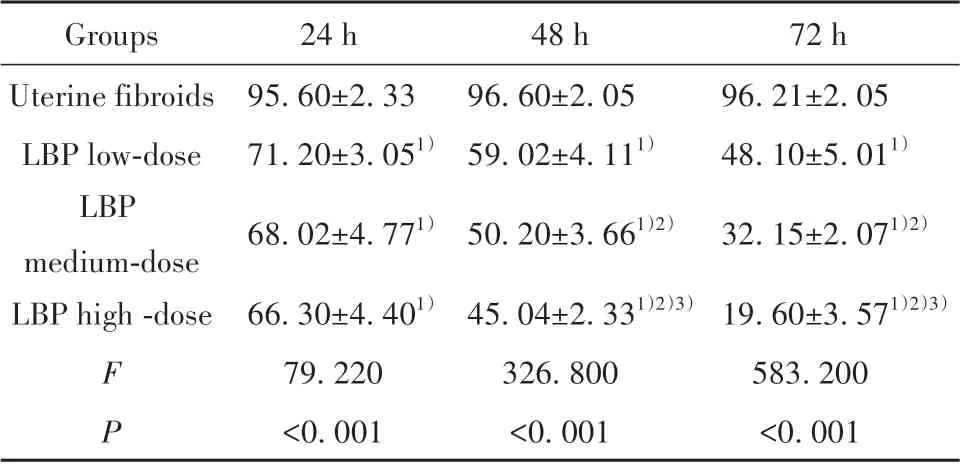
表3 各组子宫肌瘤细胞存活率比较(±s)Tab.3 Comparison of cell survival rate of uterine fi⁃broids in each group(±s)
Note:1)P<0.05 vs uterine fibroids group;2)P<0.05 vs low LBP group;3)P<0.05 vs middle LBP group.
72 h 96.21±2.05 48.10±5.011)32.15±2.071)2)19.60±3.571)2)3)583.200<0.001 Groups Uterine fibroids LBP low-dose LBP medium-dose LBP high-dose F P 24 h 95.60±2.33 71.20±3.051)68.02±4.771)66.30±4.401)79.220<0.001 48 h 96.60±2.05 59.02±4.111)50.20±3.661)2)45.04±2.331)2)3)326.800<0.001
2.3 流式细胞仪检测各组细胞凋亡率 流式细胞术结果显示:低、中、高LBP 组子宫肌瘤凋亡率分别为(15.48±1.20)%、(26.37±2.33)%及(42.37±4.12)%,均高于子宫肌瘤组[(4.58±0.20)%,F=205.000,P均<0.05],低、中、高LBP 组两两相比子宫肌瘤细胞凋亡率比较差异均有统计学意义(P<0.05),见图2。
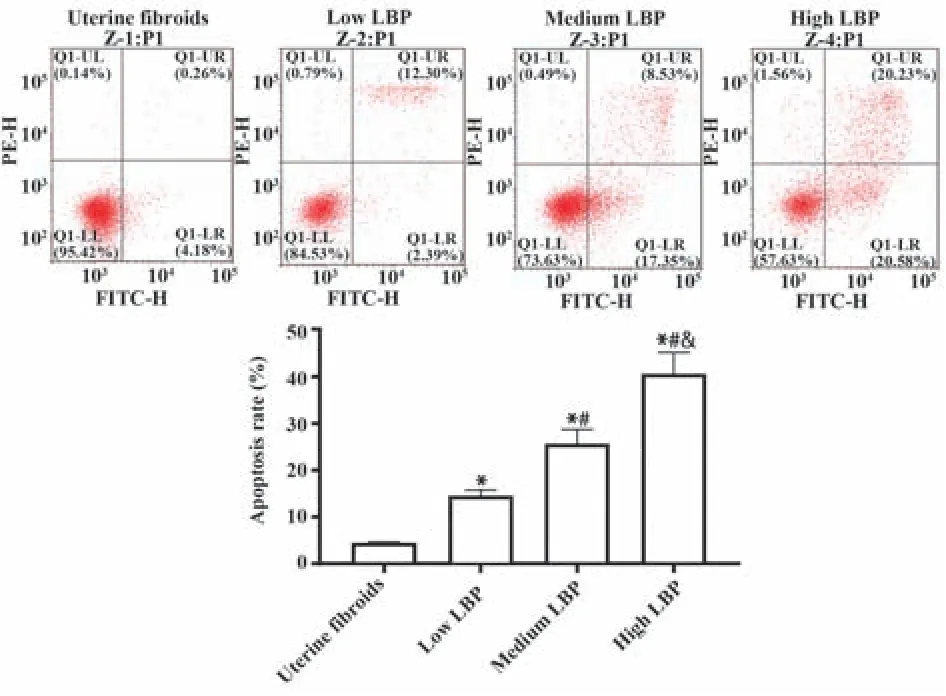
图2 流式细胞仪检测子宫肌瘤细胞凋亡率Fig.2 Flow cytometry to detect apoptosis rate of uterine fibroids
2.4 Transwell 检测各组子宫肌瘤细胞侵袭数目 Transwell 小室结果显示:低、中、高LBP 组子宫肌瘤细胞侵袭数目均低于子宫肌瘤组(均P<0.05),低、中、高LBP 组两两相比子宫肌瘤细胞侵袭数目均有差距(P均<0.05),见图3。
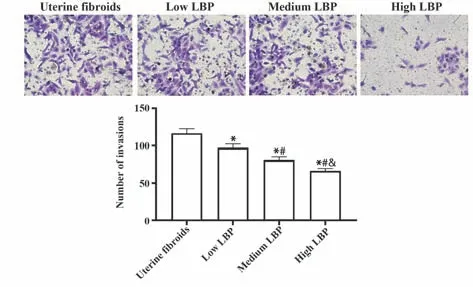
图3 各组子宫肌瘤细胞侵袭数目比较Fig.3 Comparison of number of uterine fibroids cell inva⁃sion in each group
2.5 各组子宫肌瘤细胞中Wnt5b 和β-catenin 蛋白水平比较 Western blot 结果显示:子宫肌瘤组细胞中Wnt5b 和β-catenin 蛋白水平表达均高于低、中、高LBP 组(均P<0.05),低、中、高LBP 组Wnt5b 和β-catenin 蛋白水平逐渐降低,组间两两比较差异均有统计学意义(P<0.05),见图4。
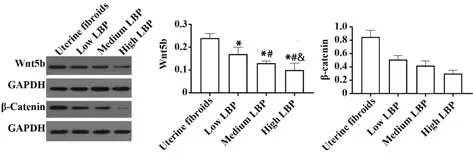
图4 各组子宫肌瘤细胞中Wnt5b 和β-catenin 蛋白水平比较Fig.4 Comparison of Wnt5b and β-catenin protein levels in uterine fibroids in each group
2.6 qRT-PCR 检测各组子宫肌瘤细胞中Wnt5b 和β-catenin mRNA表达 RT-PCR检测结果显示:子宫肌瘤组细胞中Wnt5b和β-catenin mRNA相对表达量高于低、中及高LBP 组(P均<0.05),低、中、高LBP组Wnt5b 和β-catenin mRNA 相对表达量逐渐降低,两两比较差异均有统计学意义(P<0.05),见图5。

图5 各组子宫肌瘤细胞中Wnt5b和β-catenin mRNA比较Fig.5 Comparison of Wnt5b and β-catenin mRNA in uterine fibroids in each group
3 讨论
既往研究证实能够通过干扰内源激素水平提高子宫肌瘤细胞凋亡率,改善病情。按照隋·巢元方在《诸病源候论》中记载,中医认为子宫肌瘤的产生与“寒湿不调,饮食失节及脏气相搏”相关,利用中药材治疗子宫肌瘤已经成为医学界研究的热点[6]。LBP 是一种生物活性物质,为枸杞进行提取纯化而获得,为淡黄色纤维状固体,可辅助用于多种中药制剂发挥作用[7]。本文通过建立子宫肌瘤大鼠模型,采用10、50 和100 mg/kg 的LBP 灌胃,14 d后发现大鼠子宫肿瘤及系数降低,体质量增加,说明LBP 能够通过减少肿瘤体积而降低子宫重量。黄霞等[8]体外培养人肝癌HepG2 细胞株,采用LBP干预72 h 时能够显著抑制细胞活性,加快凋亡,且存在浓度依赖性,证实LBP 具有抗肿瘤功效。本研究从子宫肌瘤病理组织中分离和培养子宫肌瘤细胞,无菌操作,制备出重复性好、稳定性高的子宫肌瘤细胞。
子宫肌瘤是主要由平滑肌演变细胞分裂产生的良性肿瘤,细胞增殖是子宫肌瘤形成的影响因素。子宫肌瘤细胞生长受多种生长信号通路调节,通过改变子宫肌瘤细胞中遗传因子而降低抑制肿瘤生长信号的活性,子宫肌瘤细胞增殖失控[9-10]。实验了解到子宫肌瘤细胞孕激素表达上调,能够抑制线粒体凋亡信号Bcl-2水平,发现其水平升高可能是子宫肌瘤细胞增殖的主要原因。凋亡是细胞最显著的生物学特征,细胞受到内在基因调控时主要发生自杀的现象,但细胞凋亡失控时能够诱导肿瘤产生[11]。子宫肌瘤细胞存在凋亡抑制,因此,增加其凋亡率对于改善病情具有一定作用。子宫肌瘤细胞侵袭是指从原发部位将周围组织浸润的过程,王一飞等[12]证实子宫肌瘤细胞存在侵袭性,主要由MMPs 激活发挥细胞外基质降解作用,该过程是肿瘤细胞发生侵袭的基础条件。中药因其来源广泛的特点在治疗子宫肌瘤中发挥主要作用。LBP能够显著改善大鼠子宫组织病理,下调血清性激素水平,证实具有治疗子宫肌瘤的作用[13]。本研究表明LBP 能够降低子宫肌瘤细胞生物活性,凋亡率随着LBP浓度升高而增加,侵袭数目降低,存在浓度依赖性,且与LBP 药物干预子宫肌瘤组细胞存在差异。证实LBP 能够抑制子宫肌瘤细胞生物活性。王晓丽等[14]表示,在子宫内膜损伤动物模型中,采用LBP干预后,子宫内膜组织损伤改善,雌激素水平降低,证实其具有保护子宫和卵巢作用。本研究表明LBP可抗子宫肌瘤细胞增殖,加快凋亡其机制可能在于通过调节p53、Bcl-2、Bax 表达而发挥作用。代海平等[15]表示LBP 在AS 动物模型中具有抑制MMP-2 和血管生成因子的作用。本研究推测LBP 发挥抗子宫肌瘤细胞侵袭的作用可能是通过改变子宫肌瘤细胞基质降解能力实现。
在正常细胞中,Wnt信号通路表达沉默,当受到癌基因调节活化,能够导致肿瘤细胞生长失控而促进肿瘤形成。经典信号通路中Wnt 能够结合β-catenin 蛋白的核易位活化靶向目标的转录活性,而发挥促癌作用[16]。在子宫肌瘤组织中存在Wnt信号通路表达异常,在对Wnt 信号通路进行关节基因筛查时发现,Wnt5b、β-catenin 水平升高而在正常组织中无表达。Wnt5b 存在于细胞质中,参与胚胎发育及疾病生理发展。瞿秋红等[17]和张潇迪等[18]研究子宫肌瘤组织检测Wnt5b 呈现高表达状态。β-catenin 是一种存在细胞膜中的蛋白,发挥细胞信号转导作用,在子宫肌瘤细胞中能够激活Wnt信号,游离的β-catenin 表达上调,恶化病情。槲皮素能够通过下调宫颈癌细胞Wnt5b 和β-catenin 表达水平,从而减少子宫肌瘤细胞生物活性[19]。说明外源性干预能够通过抑制Wnt5b 和β-catenin 含量而改善病情。LBP对于Wnt/β-catenin信号通路的研究在不同疾病中作用不同,在脑缺血再灌注实验大鼠空腹注射LBP 后能够上调Wnt/β-catenin 表达而改善病情[20]。本文研究与之不同,可能与疾病类型及LBP广泛的药理作用相关。本文研究发现低、中及高LBP 组Wnt5b 和β-catenin 含量均低于子宫肌瘤组,说明LBP 能够降低Wnt5b 和β-catenin 表达改善疾病。研究机制可能在于LBP 能够上调子宫肌瘤某种抑癌基因,降低性激素水平,对Wnt/β-catenin 信号通路发挥抑制作用,而降低子宫肌瘤细胞活性。
本研究存在局限性,实验时间及经费受限,采用的实验方法较为单一,动物实验样本量较小,未采用药物对照组,结果存在一定的局限性,后期本课题组会加强和其他相关研究单位合作,细化实验内容,为子宫肌瘤的临床研究提供参考依据。综上所述:LBP能够降低子宫重量及系数,抑制子宫肌瘤细胞活性,LBP浓度和凋亡呈正相关,其研究机制可能与抑制Wnt5b/β-catenin信号通路相关。