菠菜SoSWEET蛋白家族基因鉴定与表达分析
杨 蛟,张力劼,王雪美,翁 莉,刘梓涵,蔡晓锋
(上海师范大学生命科学学院,上海 200234)
0 引言
植物作为自养生物可以通过光合作用将无机碳同化为糖类,满足自身能量需求以及供应其他异养生物[1].这些同化物包括多种糖:单糖(葡萄糖和果糖)、蔗糖、淀粉和多元醇等,在植物的绿色组织中合成,以淀粉或其他有机化合物的形式运输到不同组织和器官中储存.这些糖类物质是各种代谢途径的前体、结构构件、短距离和长距离信号分子,及压力条件下的渗透保护剂成分[2].同时,糖的转运能调控茎和果实之间的碳分配,参与调节植物生长发育和能量传递[3-4].植物体内糖的积累受干旱、盐度、渗透胁迫、低温和高温等环境胁迫的影响[5].
植物通过多种糖转运蛋白调节碳水化合物的分配,这些糖转运蛋白协调参与感知生物和非生物胁迫反应,和适应环境的信号转导[6],包括糖外排转运蛋白(SWEETs)、蔗糖转运蛋白(SUTs)和单糖转运蛋白(MSTs)[7].SWEET家族成员是最近被发现的,主要参与韧皮部装载以及液泡糖的输出[8-10].SWEET广泛分布于各种生物中,包括原核生物、动物和植物[4,11].真核SWEET蛋白在结构上具有7次跨膜α-螺旋(TMH/TM),在细胞膜中以3-1-3拓扑排列,由2个具有3次重复的TMH组成的MtN3基序和位于其中起连接作用的1个TMH构成[12];与真核SWEET蛋白相反,原核SWEET蛋白(即半SWEET蛋白)仅含有一个3-TM,这可能表明真核SWEET蛋白是通过复制和融合原核半SWEET蛋白中存在的基本3-TM单元而进化来的.不同家族的膜转运蛋白具有膜转运蛋白正常运作和稳定性所需的共同拓扑结构[13].3-TM包含重复氨基酸序列,结构域带有高度保守的脯氨酸和谷氨酰胺基序,因此SWEET被称为PQ-loop家族转运蛋白[14],因为该结构域首先在豆科植物中发现,也被命名为MtN3家族转运蛋白[15].
菠菜是一种被广泛种植的重要绿叶蔬菜作物,可用于鲜食和加工[16],富含铁、叶黄素、叶酸、维生素、矿物质和抗氧化剂(http://ndb.nal.usda.gov/ndb/search/list).与大多数作物一样,菠菜的生产受到疾病、害虫和杂草侵扰的生物胁迫,以及盐分、干旱和高温等非生物胁迫的阻碍.目前,菠菜育种计划的主要目标是开发具有强抗病性(特别是抗霜霉病)、非生物胁迫耐受性、耐抽薹,以及高产量和高质量的优质种质资源[17].本研究以现有菠菜基因组信息为基础[18],通过生物信息学方法筛选鉴定菠菜SoSWEET蛋白家族成员,以上海师范大学植物种质资源中心保存的菠菜种质为材料,分析了SoSWEET蛋白家族的基因在菠菜功能叶、功能叶柄、薹叶、薹叶柄、根、茎和霜霉病胁迫处理下的抗病、感病材料叶片的表达谱,为后续深入研究菠菜SoSWEET蛋白家族成员的功能提供重要参考.
1 材料与方法
1.1 菠菜SoSWEET蛋白家族成员鉴定
为系统全面地鉴定菠菜SoSWEET基因家族成员,从Pfam(http://pfam.xfam.org/)网站下载SWEET保守结构域的隐马尔可夫模型文件(PF04193,PF03083),在菠菜数据库(http://spinachbase.org/?q=home)下载全基因组、蛋白序列及注释文件,利用TBtools软件[19]从菠菜全基因组蛋白序列中筛选得到候选蛋白序列,将去除重复后的候选蛋白序列提交到NCBI-CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)数据库进行蛋白保守结构域分析,结合Pfam和NCBI-CDD,剔除不含结构域或含结构域不完整的蛋白序列,对所有的菠菜SoSWEET蛋白序列根据染色体位置重命名.
1.2 基因结构、蛋白理化性质及功能域分析可视化
利用在线工具ExPASy(https://web.expasy.org/protparam/)分析编码氨基酸序列的理化性质;利用在线工具(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/)对蛋白质序列进行亚细胞定位.通过在线网站NCBI Conserved Domain(https://www.ncbi.nlm.nih.gov/cdd/)对蛋白序列的保守结构域进行预测;利用MEME suite(http://memesuite.org/tools/meme)进行蛋白质保守基序分析(数目设置为10);启动子序列用TBtools提取,并上传至PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式作用元件,通过TBtools软件结合基因组注释文件实现可视化.
1.3 SoSWEET蛋白家族系统进化分析
从拟南芥(Arabidopsis thaliana)基因组数据库(http://www.arabidopsis.org/)和水稻(Oryza sativa)基因组数据库(http://rice.plantbiology.msu.edu/)下载AtSWEET和OsSWEET蛋白序列,对菠菜、拟南芥、水稻SWEET基因家族成员蛋白序列进行ClustalW多重比对,用MEGA7.0软件邻位连接法构建系统进化树,自检值取1 000次抽样.
1.4 试验材料与采样
以上海师范大学植物种质资源中心保存的菠菜种质为材料,将种子播种于穴盘,以体积比为1∶1的草炭土/珍珠岩作为基质,在人工气候室中进行育苗.待幼苗长出两片真叶时,选取长势一致的幼苗移植到培养盆中,在人工气候室进行培养.设定人工气候室光周期为10 h光照/14 h黑暗,温度控制在21℃(光照)/18℃(黑暗),光照强度约为5 000 lx,湿度控制在70%左右,在菠菜植株开花期采集不同发育阶段的根、茎、功能叶、功能叶柄、薹叶、薹叶柄等样品.所有采集样本经液氮速冻后置于-80℃冰箱中保存.
1.5 霜霉病接种处理
霜霉病接种液以主流生理小种为接种病原物,接种液中孢子囊浓度为1×105mL-1.于第一片真叶4~6 cm长时接种,采用喷雾接种法,使病原孢均匀喷洒在真叶上,直至菌液将要从叶片上滴落.接种后于温度20℃左右、湿度100%左右的温室中,黑暗保湿约24 h,将植株置于15~20℃温室中培养.于接种后0,2,4,6,8 d采集菠菜高感材料(Sp73)、高抗材料(US61)叶片,各样本除霜霉病处理外其余生长条件均同步控制,所有采集样本经液氮速冻后置于-80℃冰箱中保存.
1.6 RNA提取及表达结果分析
使用Trizol法提取菠菜总核糖核酸(RNA),用于实时荧光定量聚合酶链式反应(QRT-PCR)的cDNA使用Primer-BLAST(https:www.ncbi.nlm.nih.gov/tools/primer-blast)进行引物设计,使用TaKaRa Prime Script™RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒将提取的RNA反转录成互补cDNA,使用TaKaRa TB GreenTMPremix Ex TaqTM(Tli RNase H Plus)试剂盒在Applied Biosystems 7500 Real Time PCR仪器上进行QRT-PCR.采用So18s基因作为内参基因,每个反应设定3次重复.用2-ΔΔCt法计算相对表达量,用软件SPSS 25.0统计分析,Origin 2018和TBtools 5.0对结果作图.
2 结果与分析
2.1 菠菜SoSWEET蛋白家族成员全基因组鉴定与理化性质分析
根据菠菜基因组数据信息,鉴定出16个菠菜SoSWEET蛋白家族成员,根据其在染色体上的位置进行命名排序(图1),依次命名为SoSWEET1~SoSWEET16.其中,1号和5号染色体上存在3个菠菜SoSWEET基因,2号和4号染色体上存在2个菠菜SoSWEET基因,3号染色体上存在1个菠菜SoSWEET基因,6号染色体上存在5个菠菜SoSWEET基因.

图1 菠菜SoSWEET蛋白家族成员染色体分布图
菠菜SoSWEET蛋白家族成员氨基酸数量在648~1 140之间,分子质量在54 070.32~95 868.64 u之间,理论等电点(pI)在5.06~5.19之间,不稳定系数、脂肪族氨基酸指数和亲水性(GRAVY)的平均值间都表现不同差异;亚细胞定位6个蛋白质于细胞膜,5个蛋白质定位于内质网,5个蛋白质定位于细胞膜、内质网(表1).
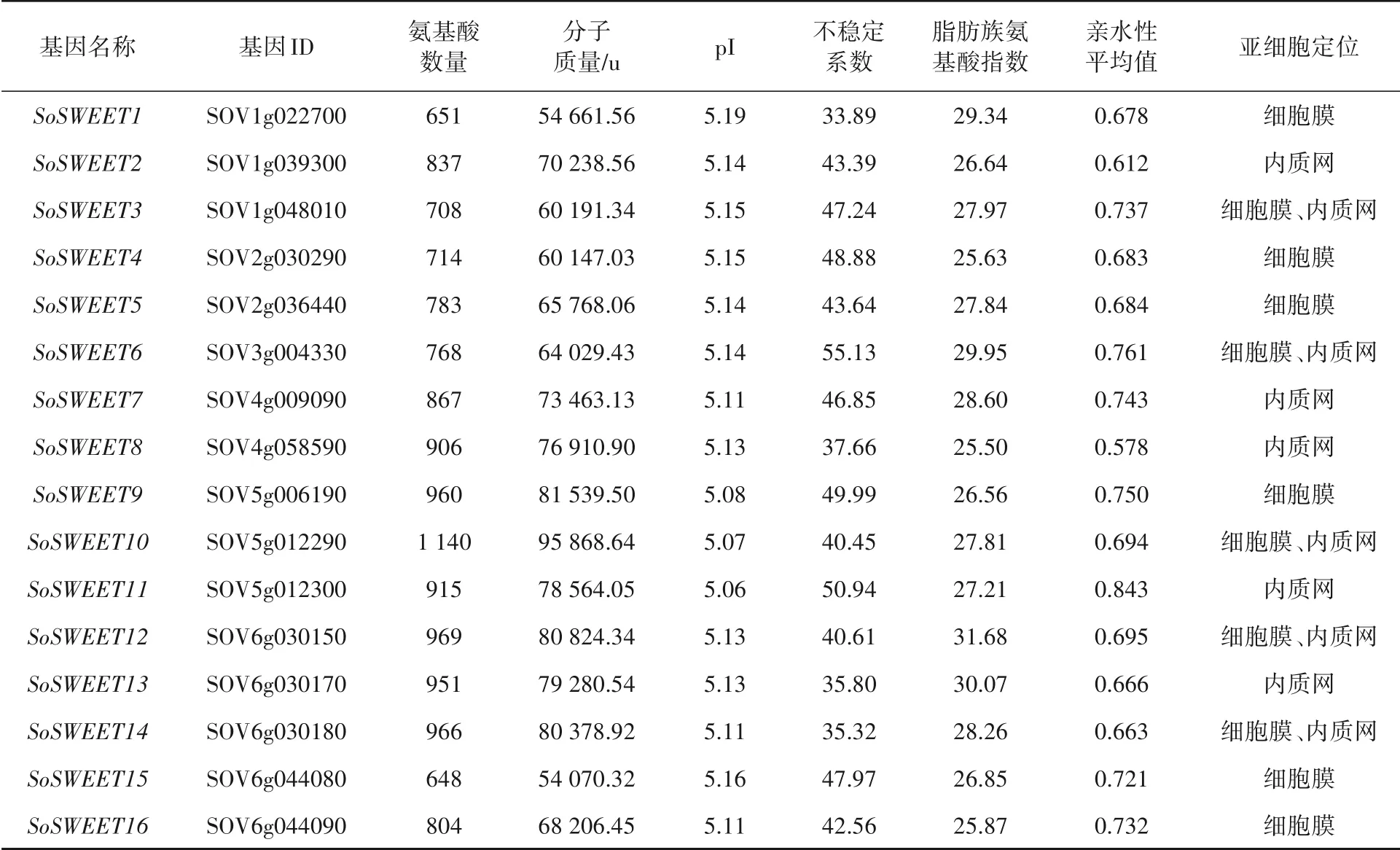
表1 菠菜SoSWEET蛋白家族理化性质
2.2 菠菜SoSWEET蛋白家族系统进化分析
为了研究菠菜SoSWEET蛋白家族的系统发育关系,将16个菠菜SoSWEET、17个水稻OsSWEET和17个拟南芥AtSWEET蛋白的氨基酸序列进行多序列比对,并构建系统进化树.依据进化树结果,将50个SWEET蛋白分成4个亚族(图2),其中第I亚族包含3个SoSWEET蛋白(SoSWEET5,6和8)、3个拟南芥AtSWEET蛋白和6个水稻OsSWEET蛋白;第Ⅱ亚族包含6个SoSWEET蛋白(SoSWEET1,2,4,9,15和16)、5个拟南芥AtSWEET蛋白和5个水稻OsSWEET蛋白;第Ⅲ亚族包含7个SoSWEET蛋白(SoSWEET 3,7,10,11,12,13和14)、7个拟南芥AtSWEET蛋白和5个水稻OsSWEET蛋白;而第Ⅳ亚族不含SoSWEET蛋白.

图2 菠菜、拟南芥、水稻SWEET蛋白系统进化树
2.3 菠菜SoSWEET蛋白家族保守基序分析
在构建的系统发育树的基础上,使用MEME在菠菜SoSWEET蛋白中鉴定了10个高度保守的基序,在相同进化树分支上的SoSWEET蛋白基序相对保守(图3),所有菠菜SoSWEET蛋白都包含基序1,2和4,它们构成了菠菜SoSWEET蛋白中最高度保守的部分;除SoSWEET15蛋白外,基序3存在于15个菠菜SoSWEET蛋白序列中;基序10存在于12个菠菜SoSWEET蛋白序列中;大多数基序的相对位置是相似的,总体而言来自同一分支的菠菜SoSWEET蛋白成员通常具有类似的基序组成,表明分支内的功能相似性和分支之间的多样化.
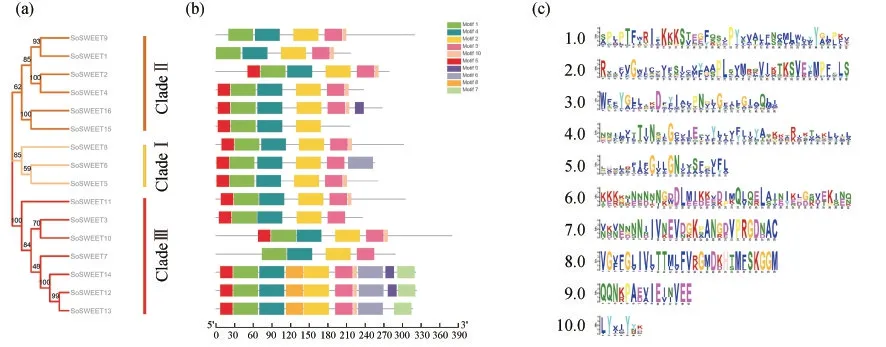
图3 菠菜SoSWEET蛋白家族保守基序分析.(a)进化树分析;(b)保守基序分布;(c)保守基序氨基酸残基序列
2.4 菠菜SoSWEET蛋白家族保守结构域分析
在构建系统发育树的基础上,对菠菜SoSWEET蛋白保守结构域进行了比较分析(图4),在同一进化树分支的SoSWEET蛋白所含的MtN3_slv(CDD登录号Pfam03083)和PQ-loop superfamily(CDD登录号cl21610)结构域具有一致的数量(2个)和相似的分布.其中,SoSWEET15只含有1个数量MtN3_slv和PQ-loop superfamily结构域;SoSWEET3还含有PQ-loop(CDD登录号Pfam04193)结构域;SoSWEET11,SoSWEET14和SoSWEET13还含有SemiSWEET_2(CDD登录号NF037968)和SemiSWEET_2 superfamily(CDD登录号cl40515).由此可知,菠菜SoSWEET蛋白家族MtN3_slv结构域具有一定的保守性,但该结构域的分布位置和数量具有一定分化.

图4 菠菜SoSWEET蛋白家族保守结构域分析.(a)进化树分析;(b)保守基序分布
2.5 菠菜SoSWEET蛋白家族基因结构分析
在构建系统发育树的基础上,对菠菜SoSWEET蛋白家族的外显子和内含子进行分析,进一步了解该基因家族的基因结构.由图5可知,菠菜SoSWEET蛋白家族基因被不同数量和大小的内含子打断.大多数SoSWEET蛋白家族的基因含有5个内含子,其中SoSWEET12,SoSWEET13和SoSWEET15含3个内含子,SoSWEET1,SoSWEET7,SoSWEET14和SoSWEET16含4个内含子,SoSWEET2最多含8个内含子.

图5 菠菜SoSWEET蛋白家族基因结构分析.
2.6 菠菜SoSWEET蛋白家族启动子顺式作用元件分析
在构建系统发育树的基础上,通过PlantCARE网站对菠菜SoSWEET蛋白家族基因起始密码子上游2 kp的序列进行了顺式作用元件预测(图6).结果表明,菠菜SoSWEET蛋白家族基因启动子上包含光响应、生长发育、植物激素响应和逆境胁迫响应等顺式作用元件,如与植物生长发育调控相关的细胞周期调节(cell cycle)和参与昼夜节律调控的顺式调控元件(circadian);植物激素调控元件中的脱落酸响应、赤霉素响应、茉莉酸甲酯和水杨酸反应;与逆境胁迫相关的干旱诱导和低温反应元件等.

图6 菠菜SoSWEET蛋白家族启动子顺式作用元件分析.(a)进化树分析;(b)保守基序分布
2.7 菠菜SoSWEET蛋白家族组织表达分析
为探究菠菜SoSWEET基因在菠菜不同部位表达情况,研究了其在菠菜不同组织的表达分析(图7).结果表明,所有基因在根、茎、叶和叶柄中都有表达;SoSWEET2,SoSWEET5,SoSWEET6,SoSWEET8等8个基因在根中的表达量高于其他部位,而SoSWEET13表达量较低;SoSWEET蛋白家族的基因在功能叶、功能叶柄和茎中的表达低于其他组织中的;SoSWEET1,SoSWEET3和SoSWEET13在薹叶中表达量较高;SoSWEET4,SoSWEET7,SoSWEET9和SoSWEET11在薹叶柄中表达量较高.各形态部位中,红色光泽尖叶中SoSWEET1,SoSWEET5,SoSWEET6,SoSWEET8等9个基因表达量高于其他部位,而SoSWEET2表达量最低;SoSWEET13在紫红叶柄中表达量最高;SoSWEET2除在红色光泽尖叶中表达较低外,在其他部位的表达量整体较高.总之,16个菠菜SoSWEET基因在不同组织和形态部位具有不同的表达模式.

图7 菠菜SoSWEET蛋白家族(a)组织表达分析和(b)在不同种质中的表达分析
2.8 菠菜SoSWEET蛋白家族霜霉病胁迫处理表达分析
接种病原菌后,16个基因表现出不同响应变化(图8),SoSWEET1,SoSWEET9,SoSWEET10,SoSWEET13和SoSWEET14基因在接种前6 d表达量较低,而在第8天表达量升高;SoSWEET2,SoSWEET4,SoSWEET5,SoSWEET8,SoSWEET10,SoSWEET11和SoSWEET15基因在接种后24 h、黑暗处理前2 d、霜霉病胁迫处理后2~8 d的表达量明显变化;SoSWEET3和SoSWEET5基因于接种后8 d表达量在抗性品种高于感性品种,在霜霉病胁迫时上调表达且表达量较高.

图8 菠菜SoSWEET蛋白家族霜霉病胁迫处理表达分析
3 讨论
糖是原核生物和真核生物的重要能量来源.生物体建立了不同的方法,通过维持糖流入和流出的速率来控制糖跨细胞膜的转运.过去的20年里,在细菌、真菌、植物和人类中发现了各种糖转运蛋白,它们在生长发育、新陈代谢和体内平衡中发挥着重要作用[8],如在植物发育过程中参与花粉壁形成[20]、种子灌浆[21]、韧皮部加载蔗糖距离运输[10]和调节赤霉素反应[22].在全基因组分析的基础上,已在植物中鉴定出多种SWEET基因,其中拟南芥中的17个[8]、高粱中的23个[23]、番茄中的29个[24]和葡萄中的17个[25].
本研究从菠菜基因组中共鉴定到了16个SWEET蛋白家族成员,按水稻和拟南芥分类方法,根据进化树分成4个亚族[8],第I亚族包含3个SoSWEET蛋白,第Ⅱ亚族包含6个SoSWEET蛋白,第Ⅲ亚族包含7个SoSWEET蛋白,而第Ⅳ亚族不含SoSWEET蛋白,菠菜SWEET蛋白家族基因与水稻和拟南芥具有一定的同源性,同一亚族中的基因具有相似的结构特征,与先前其他物种中SWEET蛋白家族结构特征相似[26-28].系统分析了染色体分布、理化性质、基因结构、保守基序、顺式作用调控元件等,每个家族成员都含有MtN3_slv/PQ-loop superfamily结构域,表明菠菜SWEET蛋白家族在进化中相对保守,但SoSWEET15蛋白氨基酸序列只含有1个数量MtN3_slv/PQ-loop superfamily结构域,与其他15个蛋白含2个结构域不同(图4).
菠菜的叶形态特征是具有高商业价值的关键表型特征[29],其他叶片特征,如叶柄颜色(紫色或绿色)和边缘形状(叶裂刻)也对消费者有吸引力[30];对野生粮食作物进行遗传改良、驯化育种促进了现代高产作物品种的发展,其中许多作物具有抗病虫害以及非生物形式胁迫的能力[31].菠菜SoSWEET基因在根、茎、叶和叶柄中都有表达,8个菠菜SoSWEET基因在根中表达量高于其他部位,红色光泽尖叶、野生型多深裂刻尖叶、野生型绿叶柄和光泽圆叶中各基因都有相应表达特征,16个基因在不同组织和形态部位具有不同的表达模式(图7).
许多病原体从宿主获取葡萄糖,可能劫持专门用于植物发育的宿主糖外排系统[32].研究证明,水稻OsSWEET11可以通过单向机制向病原体提供糖[33-34],病原体特异性调节SWEET蛋白基因表达水平可能会改变感染部位的糖外流,从而影响病原体生长和植物免疫[12].霜霉病是影响全球商业菠菜生产的最主要菠菜病害,主要感染叶面组织,降低产量并降低作物可销售部分的质量.使用携带显性抗性基因(Dm基因)的品种是控制该病害的最有效策略,然而病原菌迅速进化为新的毒力表型可以击败单个Dm基因.菠菜育种计划是不断寻找新霜霉病抗性来源和新的抗性基因[35].随着高等植物全基因组序列的公布,已在超过30个植物物种中鉴定出SWEET基因(在植物基因组中的数量为17~108不等).在这些物种中,一些SWEET基因起到S基因(功能易感性基因)的作用[12].水稻细菌性枯萎病是研究最广泛的例子,其中43个已知的抗性基因中有5个是SWEET基因的隐性等位基因[36].而在霜霉病胁迫处理下,菠菜感病品种、抗病品种中的SoSWEET2,4,5,8,10,11和SoSWEET15基因在霜霉病胁迫处理后表达量明显变化,SoSWEET3和SoSWEET5于接种后8 d表达量在抗性品种高于感性品种,在霜霉病胁迫时上调表达且表达量较高(图8);病原菌感染植物后,许多SWEET基因表达的变化会改变植物机体对疾病的抵抗力.然而,导致植物激素或其他防御相关基因上调是否是由糖改变引起的,值得进一步研究.

