小剂量荧光素钠术中显影辅助切除脑胶质瘤的临床研究
梁曦 凌国源 邓腾 莫立根
作者单位:537100 贵港 1贵港市人民医院神经外科;530021 南宁 2广西医科大学附属肿瘤医院神经外科
脑胶质瘤是最常见的脑恶性肿瘤,约占脑肿瘤的51.4%[1]。以显微外科手术为主导地位的综合治疗是脑胶质瘤治疗的标准模式,但因肿瘤组织与正常大脑组织边界难以区分,因此很难通过手术彻底切除肿瘤,这导致患者预后较差,5年生存率低于9.8%[2-4]。《脑胶质瘤诊疗规范(2018年版)》提倡通过多种新型辅助技术进行脑胶质瘤的显微手术治疗[5]。荧光辅助技术可提供脑部肿瘤的实时可视化,有助于神经外科医师术中最大限度地切除肿瘤和保护正常脑功能。近年来,显微镜内置的荧光模块促进了这一技术与显微外科技术的结合[6]。荧光素钠是一种水溶性荧光显影剂,激发峰位于460~490 nm,发射峰位于510~580 nm,术中将荧光手术显微镜调至荧光模式,可见肿瘤组织显示出独有的黄绿色或亮黄色荧光,而正常脑组织不染色[7]。荧光素钠使用方法简便,价格经济实惠,并发症发生率低,目前已成为神经外科常用的荧光显影剂[8]。同时,随着荧光手术显微镜的出现和发展,荧光素钠使用剂量已由20 mg/kg逐步下降至2~5 mg/kg,且手术中的荧光强度、手术切除效果并未随着剂量的下降而受到明显影响。有研究发现,临床应用荧光素钠所致的不良反应发生率会随着剂量的下降而减少[9],但目前小剂量(如1 mg/kg)荧光素钠显影的有效性及不良反应发生情况尚不明确[10-11]。因此,本研究选取在本院行显微外科手术治疗的脑胶质瘤初治患者,探讨小剂量荧光素钠引导显微手术在治疗脑胶质瘤中的临床疗效,为提高脑胶质瘤显微手术切除率提供新的策略。
1 资料与方法
1.1 研究设计及对象
选择2018年10月至2021年1月在广西医科大学附属肿瘤医院神经外科行手术治疗的脑胶质瘤患者为研究对象,并收集患者术前的基线资料。根据不同的手术方式分为观察组和对照组,其中观察组采用小剂量(1 mg/kg)荧光素钠引导下的脑胶质瘤显微切除术,对照组在常规显微镜下进行脑胶质瘤切除术;考虑本院2019年12月才开始使用荧光素钠引导技术,因此选择2018年10月至2019年11月入组的患者为对照组,2019年12月至2021年1月入组的患者为观察组。纳入标准:⑴初治患者;⑵术前Karnofsky(KPS)评分>60分;⑶术前、术后均行头颅磁共振成像(MRI)检查且资料完整;⑷未合并其他恶性肿瘤;⑸术后病理检查证实为脑胶质瘤。排除标准:⑴脑干胶质瘤;⑵合并凝血功能障碍、心肺肝肾功能严重障碍或其他严重基础疾病不能耐受手术;⑶术前有放化疗等辅助治疗史;⑷影像、病理等临床资料不全;⑸既往对荧光素钠有不良反应或对其他造影剂有严重反应。本研究通过广西医科大学附属肿瘤医院伦理委员会审批,所有患者及家属均在术前签署手术同意书及知情同意书。
1.2 手术方法
所有患者术前2周内均行头颅3.0T MRI平扫+增强、磁共振动脉成像(MRA)、磁共振静脉成像(MRV)、波谱分析(MRS)、弥散加权像(DWI)、弥散张量像(DTI)等序列影像学检查。根据术前MRI确定肿瘤部位、侵犯范围、最大直径,以及肿瘤与周围脑叶、脑干、血管、神经的位置关系。观察组和对照组的手术操作均由同一科室具有高级职称的医师完成。观察组:患者术前行荧光素钠过敏试验,如试验阴性(生命体征平稳及无皮疹发生),在术前30 min按1 mg/kg剂量给予静脉注射荧光素钠。麻醉后常规开颅,切开硬脑膜,分别使用显微镜的普通白光模式和YELLOW 560荧光模式判断肿瘤的边界、水肿脑组织、正常脑组织以及肿瘤与功能区的关系,明确手术切除范围。其中,YELLOW 560荧光模式主要用于观察肿瘤荧光情况及肿瘤边界,普通白光模式主要用于切除肿瘤。荧光模式下可见肿瘤实质组织呈现亮黄色或黄色(强荧光显影),术前头颅MRI强化明显的高级别胶质瘤表现为亮黄色,术前头颅MRI无强化的低级别胶质瘤表现为黄色;肿瘤的边缘组织呈浅黄色(弱荧光显影);正常脑组织不染色(无荧光显影)。头颅MRI强化越明显的肿瘤荧光染色越明显。术中通过反复切换荧光手术显微镜白光模式和黄荧光模式切除黄色区域,直至无黄荧光染色显影,按前、后、内、外分别切取切除的少量无染色组织送病理检查。常规止血、关颅,麻醉复苏平稳后送病房监护。病理标本根据术中显微镜荧光模式下黄荧光显影强烈程度,分别标记为“无荧光组织”、“弱荧光组织”、“强荧光组织”,送常规及免疫组化病理检查。对照组:患者麻醉后常规开颅,切开硬脑膜,在普通白光模式下通过显微镜进行肿瘤切除,并反复观察肿瘤边界。术者根据经验判断肿瘤边界、水肿组织和正常脑组织,切除完毕后常规止血、关颅,麻醉复苏平稳后送病房监护。肿瘤、瘤旁组织标本送常规及免疫组化病理检查。
两组患者术后均常规监测生命体征,并采取输氧、脱水减轻脑水肿、防治癫痫、营养脑细胞等治疗。术后24 h内行头颅CT检查,判断有无术后术区血肿及脑组织水肿程度;术后72 h内行头颅MRI平扫+增强检查判断肿瘤切除程度。对于低级别胶质瘤且肿瘤完全切除的患者,密切动态观察;对于高风险低级别胶质瘤患者(包括肿瘤未能完全切除、肿瘤最大径≥6 cm、肿瘤跨越中线、术前神经功能受损、年龄≥40岁的任意一项及以上者)和高级别胶质瘤患者,术后4周开始接受同步放化疗,放疗总剂量为54~60 Gy,1.8~2.0 Gy/次,每天1次,共42 d;放疗开始即同步口服替莫唑胺150~200 mg/m2,每天1次,连续5 d,每28 d为1个疗程,辅助化疗6个疗程。
1.3 观察指标
主要观察指标为全切率,全切率=(全切例数/总例数)×100%。术后72 h内复查头颅MRI并与术前头颅MRI对比,以判断肿瘤切除程度。肿瘤切除程度划分为全切除(切除100%或扩大切除)、次切除(切除>90%)、大部分切除(切除60%~90%)和部分切除(切除<60%)。次要观察指标为术后3个月的KPS评分、手术时间以及术中出血量。其中术后KPS评分通过电话、门诊和住院复诊等随访获得,随访截至2021年4月31日;KPS评分越高,表示患者健康状况越好。安全性指标包括使用荧光素钠的不良反应、术后并发症以及术后出血等。
1.4 统计学方法
采用SPSS 20.0软件进行数据分析。采用Shapiro-Wilk检验对计量资料进行正态性检验,服从正态分布的计量资料采用均数±标准差(x±s)描述,组间比较采用独立样本t检验;不服从正态分布的计量资料采用中位数(P25,P75)描述,组间比较采用Wilcoxon秩和检验。分类资料采用n(%)描述,组间比较采用χ2检验或Fisher精确概率法。采用logistic回归分析两组患者全切率的差异,其中模型1为单因素logistic回归,未校正潜在的混杂因素,模型2为多因素logistic回归,校正年龄、性别、肿瘤部位、肿瘤病理分级、肿瘤最大直径、颅内压是否增高、是否有肢体运动感觉功能障碍、是否癫痫等潜在混杂因素,计算优势比(OR)及其对应的95%可信区间(CI)。采用一般线性模型分析两组患者术后KPS评分的差异,其中模型1校正术前KPS评分,模型2在模型1的基础上再校正年龄、性别、肿瘤部位、肿瘤病理分级、肿瘤最大直径、颅内压是否增高、是否有肢体运动感觉功能障碍、是否癫痫等潜在混杂因素。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线特征
共100例患者符合标准纳入研究,均顺利完成手术,其中观察组47例,对照组53例。观察组男性26例、女性21例,平均年龄(45.4±14.9)岁;对照组男性30例、女性23例,平均年龄(42.4±18.9)岁。两组患者的基线特征比较见表1。

表1 两组患者的基线特征*Tab.1 Baseline characteristics of the two groups of patients*
2.2 两组患者手术全切率、KPS评分的比较
与对照组比较,观察组的全切率明显升高(58.5%vs80.9%,P=0.028)。多因素logistic回归校正年龄、性别、肿瘤部位、肿瘤病理分级、肿瘤最大直径、颅内压是否增高、是否有肢体运动感觉功能障碍、是否癫痫等潜在混杂因素后,观察组全切率是对照组的6.94倍(OR=6.94,95%CI:1.96~24.65,P=0.003),见表2。
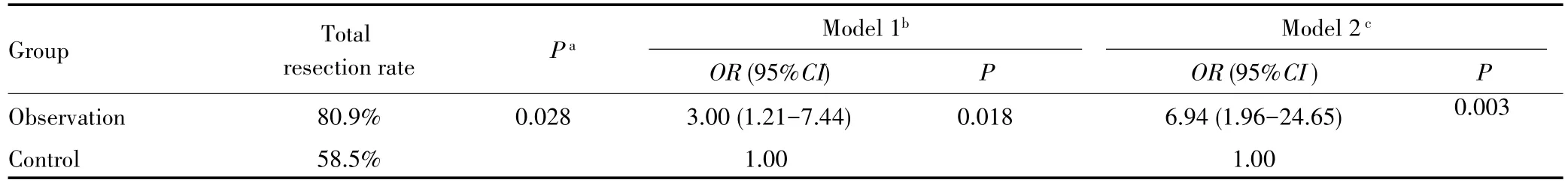
表2 两组患者手术全切率的比较Tab.2 Comparison of the total resection rate between two groups of patients
观察组和对照组患者的平均手术时间[(6.27±1.79)hvs(6.81±2.75)h,t=1.148,P=0.254]、中位术中出 血 量[500.0(300.0,700.0)mLvs300.0(200.0,800.0)mL,Z=1 075.500,P=0.238]比较差异均无统计学意义。两组患者术前的KPS评分差异亦无统计学意义(P=0.204),但观察组术后的KPS评分明显高于对照组(P=0.047)。考虑术前KPS评分对术后KPS评分的影响,应用模型1校正术前KPS评分后,结果显示,观察组术后KPS评分较对照组高9.28分(P=0.010);模型2进一步校正年龄、性别、肿瘤部位、肿瘤病理分级、肿瘤最大直径、颅内压是否增高、是否有肢体运动感觉功能障碍、是否癫痫后,结果显示,观察组术后KPS评分较对照组高7.94分(P=0.037),见表3。

表3 两组患者术前及术后KPS评分比较Tab.3 Comparison of preoperative and postoperative KPS scores between two groups of patients
2.3 两组患者术后并发症的比较
两组患者主要并发症均为颅内感染以及术后出血,其中观察组颅内感染3例,术后出血1例,对照组分别为1例和2例。两组颅内感染及术后出血的发生率差异均无统计学意义(均P>0.05)。见表4。

表4 两组患者术后并发症的比较Tab.4 Comparison of postoperative complication between two groups of patients
3 讨论
1948年MOORE等[12]首次报道将荧光素钠用于脑肿瘤手术,此后荧光素钠逐渐被用于脑膜瘤、胶质瘤、脑转移瘤等穿刺活检手术。但受技术及设备限制,在此后的几十年中鲜有报道荧光素钠在神经外科领域的应用[13-14]。近年来,荧光素钠引导技术已被作为规范用于脑胶质瘤手术。然而,荧光素钠的使用剂量目前尚缺乏统一标准。既往研究表明,荧光素钠使用剂量在1~20 mg/kg之间,其中2~5 mg/kg常被作为常规剂量且获得满意的切除效果[13,15-20]。有学者使用大剂量的荧光素钠(15~20 mg/kg)后,在显微镜普通白光下实现脑胶质的可视化,提高了脑胶质瘤的全切率[13]。ACERBI等[15]通过使用装配有 YELLOW 560特殊滤镜的Pentero蔡司显微镜,以及在荧光素钠(剂量为5~10 mg/kg)显影辅助下,分别对12例高级别胶质瘤(WHOⅣ级)患者进行显微手术,结果肿瘤全切率高达75%。CAVALLO等[16]通过文献回顾发现应用较小剂量(2~5 mg/kg)荧光素钠在脑肿瘤中即可达到良好的术中显影效果,且在使用荧光素纳全程中未出现不良反应。王笑亮等[17]使用小剂量(1 mg/kg)荧光素钠显影辅助显微镜下切除15例脑胶质瘤,同样获得了高达100%的全切率。本研究回顾性分析47例使用小剂量(1 mg/kg)荧光素钠引导显微手术治疗脑胶质瘤患者的临床资料,也获得了80.9%的肿瘤全切率,与常规显微镜下行脑胶质瘤切除术患者的全切率(58.5%)相比明显提高;进一步在多因素分析中控制潜在的混杂因素后,观察组全切率仍然是对照组的6.94倍,表明小剂量荧光素钠引导技术可以获得良好的治疗效果。此外,与常规显微镜下进行切除术的脑胶质瘤患者比较,小剂量荧光素钠引导下的显微切除术并未明显增加术中出血量、手术时间及术后并发症发生率等,在使用小剂量荧光素钠全程中也未出现不良反应,表明使用小剂量荧光素钠辅助脑胶质瘤手术不会增加手术风险,是安全可靠的荧光显影辅助技术。
目前大多研究显示荧光素钠引导下的显微手术可改善脑胶质瘤患者生存,如JACQUESSON等[21]报道应用荧光素钠辅助切除22例高级别脑胶质瘤,可显著延长患者的无病生存期和总生存期。王国堰等[22]研究报道荧光素钠引导手术切除脑恶性胶质瘤的术后KPS评分较术前明显提高,且术前术后差值较常规显微镜下行脑胶质瘤切除术组大。本研究虽然未能对患者的无病生存期和总生存期进行分析,但是观察组术后3个月的KPS评分高于对照组,这在一定程度上表明小剂量荧光素钠引导下的显微切除术,可以减少脑功能损伤,提高患者术后生存质量。值得注意的是,由于低级别胶质瘤的血脑屏障保持相对完整,术中肿瘤显影往往较差[23]。本研究也尝试将荧光辅助技术用于低级别胶质瘤的显微外科手术中,结果发现对MRI没有明显强化的肿瘤组织,其黄染程度及肿瘤边界的识别没有高级别胶质瘤明显,但对MRI肿瘤周边强化的毛细胞星形细胞瘤,荧光辅助技术可以准确判断肿瘤的边界,由此可见荧光辅助技术在低级别胶质瘤的显影特点仍有待进一步研究。
综上所述,脑胶质瘤在小剂量荧光素钠引导下进行显微切除术,与常规显微外科切除术相比可显著提高全切率并改善术后生活质量,是一种安全、有效的辅助技术。然而,本研究为单中心的回顾性研究,样本量有限,且尚缺乏与不同剂量荧光素钠进行对比分析,因此有关结论仍需开展大样本、多中心临床对照研究加以证实。

