中药中有害元素残留、体内代谢及其对肾血管的损伤机制研究进展
刘艺旋,张景嘉,汤凯璇,李 笑
(山东中医药大学1.中医学院,2.医学院,3.病理学教研室,山东济南 250355)
中药在中医防治疾病中占有不可或缺的地位,其有害元素残留在一定程度上影响了其安全性,既降低中药本身的疗效,又危害健康。叶国华等[1]分析300余种中药材有害元素残留结果显示,作为国内外中药有害元素残留量的监控指标[2-3],铅、镉、铜、汞和砷的超标率分别达到8.9%,26.4%,23.3%,6.7%和13.2%,远超过国际标准[4]。肾是人体重要的排泄器官之一,进入血液的有毒物质能够迅速到达肾,随尿液排出体外,如99%铅可通过肾代谢[5]。肾小球毛细血管内皮细胞直接接触血液,易受血液有害元素攻击,引起肾血管损伤,导致慢性中毒[6]。本文就中药中有害元素的来源、残留现状、体内代谢及其对肾血管的损伤和机制研究进行综述,以期为其对肾血管损伤的防治提供科学依据。
1 中药有害元素来源
中药有害元素主要来自其生长环境及加工过程。根据性质不同,中药包括植物类、动物类和矿物类。其中,植物类中药含有有害元素的风险最高[7]。植物类中药生长的水源、空气、土壤等环境均可使有害元素在其中富集。土壤中常见的具有显著毒性的元素有铅、镉、铬、汞和砷等,具有一般毒性的元素有铜、锌和镍等。未处理完全的工业废水中含有汞元素,工业冶炼及汽车尾气会排放铅和镉元素,农业种植所用的消毒剂、杀虫剂、除草剂和杀鼠剂中含有砷元素[8-9]。
研究表明,植物类和动物类中药在生长过程中具有主动吸收和富集有害元素的特性。其中,植物类中药人工栽育过程受有害元素富集影响尤为明显。植株从一粒种子到成为药材各个阶段都有可能受到有害元素不同程度的污染[10],影响因素可大致分为外来因素和自身因素。自身因素主要指中药本身所具有的特性,如一些菌类植物具有超强的富集重金属的能力[6]。外来因素包括人为因素和非人为因素。人为因素的影响是指因人的参与而对中药产生的影响,如在中药种植过程中进行杀虫和施肥等人为活动;非人为因素的影响是由自然环境、技术措施和设备因素等产生的影响,如土壤母质和污染。另有调查发现,许多海洋生物对重金属具有较强的富集能力,当含大量有害物质的废水被排入海洋中时,贝类等中药的重金属含量增加[11]。矿物类中药多为天然矿石,易掺入杂石和杂质,增加有害元素含量。
2 中药中有害元素残留
2.1 植物类中药
有害元素在不同的植物类中药中的分布具有明显差异。根据植物类中药药用部位的不同,主要分为根型、叶型、花果型、草本型、茎型和植株皮型药材。从药用部位来看,叶型药材重金属超标率最高。研究发现,铅的残留部位较广,可分布在根、叶、花和果实中,镉主要分布在花果和茎叶中,汞主要分布在植株皮中,砷主要分布在茎中,铬主要分布在茎、花和果实中[12]。《中华人民共和国药典》参考《药用植物及制剂进出口绿色行业标准》限定了铅、镉、铜、汞和砷的指标:铅≯5 mg·kg-1,镉≯0.3 mg·kg-1,铜≯20 mg·kg-1,汞≯0.2 mg·kg-1,砷≯2 mg·kg-1[13]。由此可见,严格限定中药有害元素的含量,遵从限量标准,从源头减少来源与残留,是保证中药质量与信誉,促进中医药向世界推广的关键。
马鸣等[14]整理归纳了近20年的文献资料发现,某些中药中有多种有害元素含量超标,如丹参存在铅、镉、铜、汞和镍及总金属含量超标,党参中的铅、镉、汞和砷含量超标。冯云霞等[15]调查了100种常见中药的重金属含量并分析其残留情况发现,汞超标量最多的是来自四川雅安的牛膝,其汞含量高达1.35 mg·kg-1;铅超标量最多的是来自湖南的厚朴,其铅含量高达13.30 mg·kg-1。
2.2 动物类中药
动物类中药包括动物的全部或部分、生理病理产品及其加工产品。人通过食物链摄入受污染的动物类中药会导致污染物在人体内积累。水蛭是一种典型的动物类中药,《中华人民共和国药典》委员会规定,水蛭中铅、镉、汞和砷的最大允许限值分别为10,1,1和5 mg·kg-1。研究报道,在中国多个省市收集的83批动物类中药中,有36.1%样品有害元素含量超标[16]。其中蚯蚓和蜂巢中铅蓄积超标;蚯蚓和蝎子中镉水平超标;汞在僵蚕和臭虫中的残留量显著高于其他动物类中药,但仍在标准范围之内;蚯蚓和水蛭是强效蓄积物,砷浓度超过国家标准;动物类中药中铜的平均浓度远高于其他4种有害元素,蝎子中的铜含量最高,蝮蛇中的铜含量最低[17]。
2.3 矿物类中药
矿物类中药是传统中医药独特的组成。现代药理学研究表明,多种矿物类中药对恶性肿瘤的治疗有很好的效果,但由于其有害元素含量高、毒性大等问题,限制了其临床应用。如含汞的矿物类中药朱砂和甘汞等受汞毒性作用的影响,其安全性与合理性受到质疑,使用不当会引起肝肾毒性[18]。稀土中含有三氧化二砷(arsenic trioxide,AS2O3),由于砷具有显著的细胞毒性,可诱导细胞凋亡。长期大量食用雄黄,可引起肾铜积蓄,产生肾毒性[19]。
3 中药中有害元素体内代谢
中药中有害元素可由消化系统进入人体,首先通过血液被肝部分吸收,再随胆汁缓慢排入肠腔,最终与粪便一起排出体外[20]。另外,其还可经肾代谢途径从尿液中排出。肾代谢过程中,有害元素首先进入肾小球,毛细血管内皮细胞易受其攻击,导致慢性中毒[21]。随后通过肾小管浓缩作用,有害元素浓度增加,加剧了急性中毒期肾小管的损伤[22]。但这种损伤是可逆的,因肾具有排泌氢离子的功能,而氢离子可使肾中的有毒物质分解并释放[23]。此外,许多腺体,如汗腺、唾液腺和乳腺等也可排泄少量有害元素[24-25]。
当摄入人体的有害元素含量超过机体的解毒和排泄能力时,就会在部分器官蓄积。如铅易蓄积在中枢神经系统和骨骼中[26]。有数据表明,镉、铅和汞等重金属容易在肾和肝中蓄积,却不易在肌肉组织中蓄积[27]。有害元素可通过与体内多种酶和蛋白质相结合,或置换出活性中心的锌离子,影响其正常的生理生化功能,甚至使其失去生物活性,导致蛋白质和糖类代谢紊乱等病症[28]。此外,核酸[29]、神经递质[30]和激素[31]等也可与有害元素结合,使其生化功能改变,引发病变。
4 中药中有害元素对肾血管的损伤及作用机制
有害元素残留可影响肾血管结构及功能,其损伤机制主要包括氧化应激、炎症反应、细胞凋亡、抑制内皮细胞增殖与修复和促进血管收缩等(图1)。
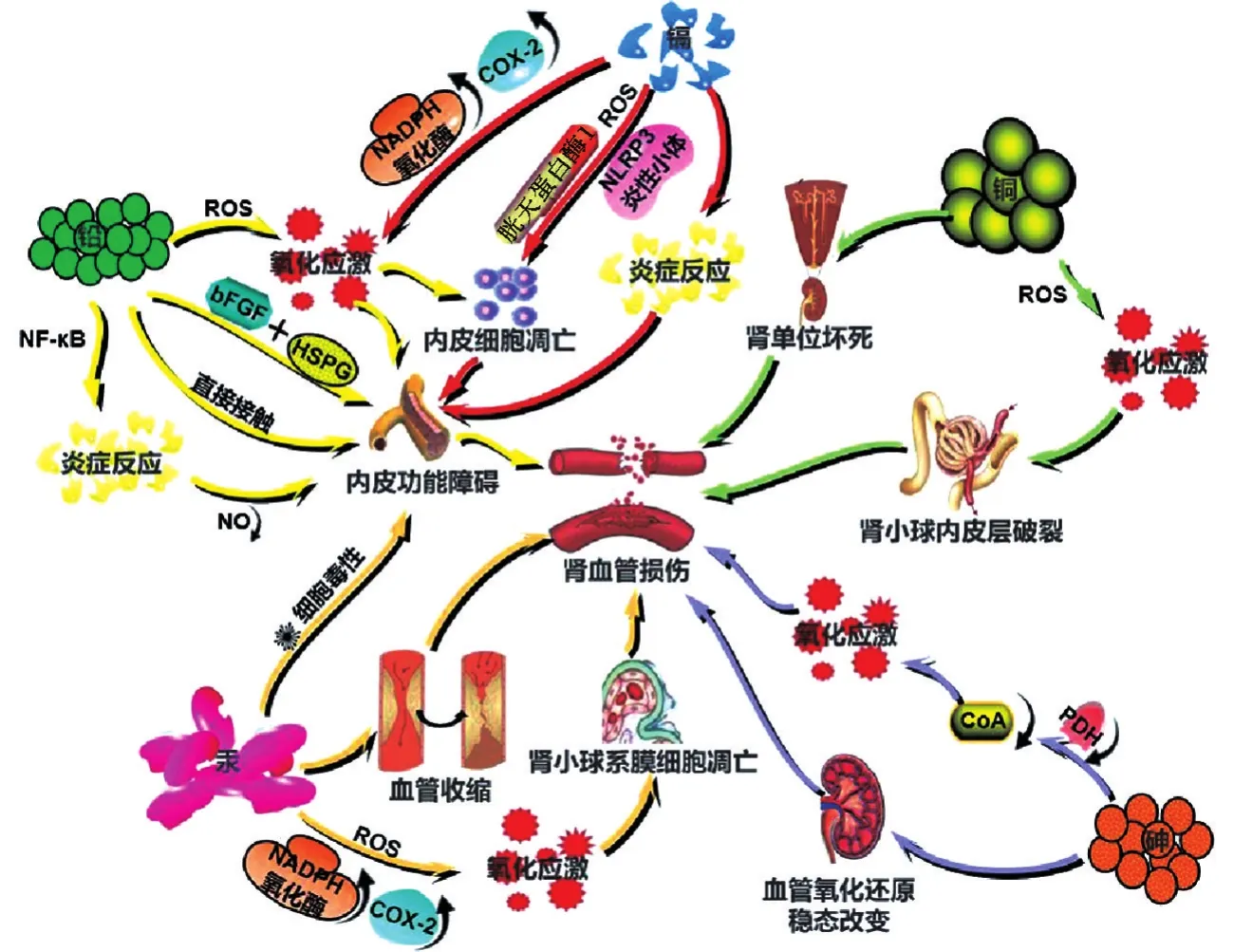
图1 铅、镉、铜、汞和砷对肾血管的损伤机制.ROS:活性氧;bFGF:碱性成纤维细胞生长因子;HSPG:硫酸肝素蛋白聚糖;NO:一氧化氮;NADPH:还原型烟酰胺腺嘌呤二核苷酸磷酸;COX-2:环氧化酶2;CoA:乙酰辅酶A;PDH:丙酮酸脱氢酶;NLRP3炎性小体:Nod样受体蛋白3炎性小体.
4.1 影响肾血管结构和功能
铅及含铅化合物可通过吸入、摄入以及皮肤接触等途径进入机体。体外实验表明,铅无明显的遗传毒性,但动物实验表明其具有致癌性,可能与铅抑制DNA合成和修复以及诱导氧化损伤有关[32]。肾小球毛细血管内皮细胞因直接接触血液,对铅格外敏感,铅暴露可以引起内皮细胞功能障碍,从而诱发血管系统疾病[33]。长期接触含铅化合物会使血管舒张功能下降,形成血栓,引起动脉粥样硬化[34]。
血管内皮细胞是镉产生毒性作用的重要靶点。最新研究表明,镉离子会导致高渗透性,从而破坏肾小球中的内皮细胞屏障[35]。金属硫蛋白(metallothionein,MTT)是一种低相对分子质量的金属结合蛋白,含有丰富的半胱氨酸,在镉和汞等金属解毒、维持必需金属的稳态等方面发挥不可或缺的作用[36]。MTT可与进入人体的镉结合,减少游离镉的数量,是细胞免受急性镉中毒的主要保护机制[37]。由于其相对分子质量低,镉-MTT复合物能够在肾小球滤出并进入近端肾小管细胞中,经过肾小管的重吸收作用,使镉在肾脏蓄积,随后可能引起肾损伤。如果镉-MTT受体受到抑制,会导致镉-MTT诱导的肾毒性降低[35]。体外培养人足细胞实验表明,镉对肾小球的结构和功能都有影响,能够引起肾小球肾病和足细胞损伤[38]。有数据表明,短期、低剂量的镉暴露不会诱导细胞毒性,但会增加单层肾小球内皮细胞的通透性。血液中的镉可能直接破坏肾小球内皮细胞屏障,并引起肾小球疾病临床症状[39]。长期的镉暴露能够引起肾损伤,包括肾小球萎缩和近端肾小管损伤等,并伴有细胞骨架的紊乱,可能与体内严重的肾血流动力学改变有关[40]。
铜主要损伤肾小管上皮、肾小球基底膜和毛细血管。绵羊体内实验表明,铜可引起溶血、肾功能受损和各种形态学缺陷,其中以肾小球内皮层破裂最为明显[41]。将大鼠肾组织亚慢性暴露于氧化铜纳米颗粒后,用投射电子显微镜技术评估肾组织超微结构的变化。结果显示,肾小球改变包括内皮细胞肥大、毛细血管扩张和闭塞、足细胞肥大、蒂细胞紊乱、系膜细胞增生以及晶体沉淀等[42]。
汞是毒性最强的重金属之一,长时间汞中毒能够导致慢性肾损害,引起肾小管功能损伤、低分子量蛋白尿、肾炎及肾病综合征等。汞化物也具有一定毒性,高浓度的氯化汞可产生细胞毒性,对内皮细胞的负面影响表现为损伤细胞屏障,导致血管内皮功能障碍[10]。在注射氯化汞引起的急性肾衰竭过程中,可以观察到肾血管形态的改变,肾小球前肾血管中段发生纤维蛋白样损伤,表现为血管扩张。汞造成血管病变机制尚不明确,推测可能与持续或反复的血管痉挛、血管舒张伴局部缺血和血管壁张力增加有关,血管壁结构和功能的改变在一定程度上可导致肾功能不全。
砷主要通过吸入和摄入进入人体,增加各种癌症的患病风险[43]。砷对血管生成具有双重作用,低剂量砷(AS2O30.25~0.5 μmol·L-1)具有促进血管生成的作用,而高剂量砷(AS2O30.5~2 μmol·L-1)则抑制血管生成[44]。砷对大多数器官和系统有毒性作用,最敏感的靶器官是肾[45]。动物实验表明,砷化合物,如氢化砷暴露能够引起大鼠肾小球和肾小管周围内皮细胞的毒性作用,严重者可导致肾功能不全[46]。
4.2 损伤肾血管
4.2.1 诱导氧化应激
氧化应激是多种疾病的发病机制,有害元素暴露能够使机体产生过量的活性氧(reactive oxygen species,ROS),打破体内氧化还原平衡稳态,造成多种生物大分子氧化损伤,从而导致细胞凋亡、坏死以及组织器官代谢紊乱。研究表明,铅可通过芬顿型哈伯·韦斯(Haber-Weiss)反应产生血管内ROS,使抗氧化酶如过氧化氢酶和谷胱甘肽过氧化物酶活性降低,进而诱发氧化应激,同时降低一氧化氮(nitric oxide,NO)的生物有效性[47]。由于NO是重要的血管保护因子,铅在肾内的富集增加了血管损伤概率,导致血管内皮功能障碍,减少肾血流量并降低肾小球滤过功能[48]。血液中铅含量增加能够使同型半胱氨酸水平升高,高同型半胱氨酸血症可以促进血管平滑肌细胞增殖,改变血管壁弹性[49],同时又可抑制NO合成以及促进氧化应激,引起血管损伤[1]。此外,铅暴露还能通过影响肾小球滤过功能引起肾损伤,导致肾功能改变,使肾功能血清标志物(尿素和肌酐)升高[50]。
镉暴露引起的氧化应激可导致血管内皮细胞功能失常,进而引起动脉粥样硬化和高血压等疾病。镉暴露还可损害肾,尤其是近端肾小管细胞,因其主动重吸收镉和肾小球滤液中的锌、葡萄糖和氨基酸等[51],引起肾血管和肾小球充血以及肾小管上皮肿胀[52]。研究表明,急性镉暴露能够促进血管紧张素Ⅱ的局部释放,进而使还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶和环氧化酶2(cyclooxygenase-2,COX-2)活性增加,使自由基产生增多,促进超氧阴离子与NO作用形成过氧亚硝酸盐,降低NO的生物利用度[53]。同时,镉还可通过抑制抗氧化酶活性,降低血管抗氧化能力,促进氧化应激[3]。
铜也可通过氧化应激损伤肾血管。铜参与ROS的产生和防御,可通过得失电子改变氧化还原状态,参与过氧化氢和超氧自由基的产生过程,促进ROS的合成。有害的ROS会降低内皮细胞功能,导致铜的氧化还原反应失控,从而损伤血管内皮细胞[54]。目前,铜通过氧化应激损伤肾血管的案例未见报道,相关研究表明[55],铜与肝损伤及肝疾病的关系更为密切。
氧化应激是汞对血管结构和功能损伤的主要机制,临床表现为蛋白尿和肾功能不全。氯化汞可诱导血管紧张素Ⅱ局部释放增加,导致NADPH和COX-2活性增加,从而释放更多的ROS,诱导氧化应激。汞化合物还对一氧化氮合酶基因的表达有抑制作用并能够减少NO的产生[56]。除了增加ROS的产生,氯化汞的亲巯基活性会抑制抗氧化酶,耗竭谷胱甘肽,引起硫醇酶失活,从而诱导氧化应激[3]。
砷也可以引起氧化应激[57-58]。三价砷与二氢硫脂酰胺的巯基结合能减弱丙酮酸脱氢酶的作用,使丙酮酸转化为乙酰辅酶A(acetyl coenzyme A,CoA)的数量减少,降低柠檬酸循环的效率并减少细胞ATP的生成[59]。三价砷通过与巯基结合也能够减弱许多酶活性,抑制细胞摄入葡糖糖以及糖异生、脂肪酸氧化等反应,进一步生成CoA,抑制谷胱甘肽的产生,使细胞遭受氧化损伤[53]。另有研究发现,通过饮用水接触亚慢性砷会引起血管氧化还原稳态的改变,高浓度会严重影响身体健康,主要表现为肝肾损伤,甚至改变肝肾器官指数[60]。
4.2.2 诱导炎症反应
研究表明,接触铅的工人体内具有更高水平的炎症细胞因子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素10(interleukin-10,IL-10)[61]。铅暴露后的血管炎症反应与 NF-κB 激活有关[62]。铅损伤肾的主要表现为肾小管间质性病变[63],但其诱导炎症反应损伤肾血管的案例暂未见报道。
镉可促进多种炎症因子释放,如IL-6,IL-8,IL-1β和TNF-α等,引发炎症反应,增加血管壁通透性,使内皮屏障受损,易形成动脉粥样硬化,引发肾小球血管炎[64]。研究表明,人肾小球内皮细胞镉暴露会促进IL-6和IL-8的分泌,在肾炎症中起重要作用,可能是镉诱导IL-6通过NF-κB依赖途径分泌的结果[65]。
大量铜会导致自由基产生,进而引起炎症或毒性反应。铜首先在肝中蓄积,随后被其释放入血进入红细胞,使谷胱甘肽浓度降低,红细胞脆性增加引起血管内溶血,导致肾中的铜浓度增加,血红蛋白在肾小管内形成管型,引起肾小管阻塞,从而引起肾功能衰竭、肾单位坏死和血红蛋白尿等,严重者可发展为尿毒症。同时,血浆肌酸酐磷酸激酶的浓度增高,引起骨骼肌的损伤。此外,铜的氧化还原反应还可能改变神经递质的生物合成、血管生成和其他生理过程,介导中枢神经系统的损伤[66]。
Lemos等[67]研究氯化汞(6 nmol·L-1)对主动脉环内皮功能的影响,发现急性汞暴露会导致血管炎症、血管损伤和动脉粥样硬化等,还会增加血管外周阻力。研究表明,大鼠反复接触氯化汞后会引起CD4+辅助性T细胞2细胞亚群诱导的多克隆B细胞活化,从而导致自身免疫综合征,其特征主要为自身抗体合成、肾小球IgG线性沉积、蛋白尿以及肾小管间质性肾炎[68]。
砷能否引起肾血管的炎症反应及其机制尚不明确。
4.2.3 诱导细胞凋亡
铅暴露后激活NF-κB,NF-κB是体内众多趋化因子、黏附因子以及促炎细胞因子的通用转录因子,经过氧化应激,NF-κB活化,从而引起炎症反应,甚至导致血管纤维化和细胞凋亡[1]。林哲绚等[11]观察暴露于不同浓度氯化镉24 h对脐静脉内皮细胞骨架的作用发现,镉在较低浓度(0.1 μmol·L-1)可降低血管内皮细胞活性,而较高浓度(10~20 μmol·L-1)则引起内皮细胞凋亡。另外,脐静脉内皮细胞接触镉后能够导致线粒体ROS释放,介导Nod样受体蛋白3炎性小体激活,引起胱天蛋白酶1激活,诱导DNA损伤,导致内皮细胞凋亡[69-70]。慢性镉暴露也可抑制自噬,导致肾小管上皮细胞凋亡和损伤[71]。汞暴露诱导的氧化应激能够促进肾小球系膜细胞凋亡,是肾小球硬化的重要机制之一,可导致严重的蛋白尿,促进糖尿病肾病的发展[72]。研究显示,无机砷还能够通过调节母系表达基因3的表达影响细胞凋亡,但AS2O3对肾血管的损伤是否通过该机制尚不明确[73]。
4.2.4 抑制内皮细胞增殖和修复
研究表明,铅可阻碍血管内皮细胞的增殖,可能和抑制内皮细胞表面碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)与硫酸肝素蛋白聚糖的结合有关,亦可能与硫酸肝素促进bFGF与其受体的结合有关[74]。同时,铅还可通过抑制硫酸肝素的合成降低内源性bFGF的表达,抑制血管内皮细胞的增殖[1],从而导致血管损伤。
镉被认为是一种金属激素,能够通过干扰机体内分泌引起血管结构和功能的损伤[75-76],抑制血管内皮细胞增殖和修复,促进动脉粥样硬化[1]。
4.2.5 促进血管收缩
研究表明,铅暴露能够促进血管收缩,一种途径为增加蛋白激酶C的活性,使血管收缩增加;另一种途径为增加肾上腺素、内皮素以及血管紧张素Ⅱ等发挥收缩血管的效应[77-78]。另有研究发现,离体肾血管床注入氯化汞能够引起血管收缩,可能与内皮激动剂和血流介导的血管舒张减少有关,验证了氯化汞损害肾血管反应性的假设[79]。长期砷暴露导致的肾组织损伤以近曲小管上皮细胞和Bowman囊的足细胞损伤尤为明显[80],易引起肾毒性,能够观察到肾小球收缩、Bowman囊空间增加,肾小管中凋亡和坏死的细胞增多、管间间隙减少以及刷状缘细胞高度增加等[81]。
4.2.6 其他机制
还有多种机制参与有害元素引起的肾血管损伤。临床研究表明,铅会加速慢性肾疾病的发展,主要通过升高血压、加速微血管血流和损伤肾小管间质等途径[82]。AS2O3能够引起内质网应激,提高细胞内游离钙离子浓度并引起线粒体膜的破坏[83]。
5 结语
不同种类中药含有的有害元素成分和含量有所差异,其来源与中药从获取到售卖的整个过程密切相关。有害元素主要通过消化系统和泌尿系统代谢,以粪便和尿液的形式排出体外,少部分还可经其他分泌腺排出。中药中常见有害元素铅、镉、铜、汞、砷的残留能够不同程度损伤肾血管结构和功能,主要通过氧化应激、炎症反应、细胞凋亡、抑制内皮细胞增殖与修复和促进血管收缩等介导肾血管损伤,此外,还可通过其他机制造成肾血管损伤。对中药有害元素残留损伤血管机制的深入研究,可以提高业界对中药有害元素残留的重视程度,同时为中药材的规范、安全使用提供理论依据。

