融合魏斯氏菌安全性、益生潜力及功能特性研究进展
严 鑫, 艾连中, 夏永军, 宋 馨, 张 辉, 倪 斌, 杨昳津*
1. 上海理工大学健康科学与工程学院, 上海 200093;2. 上海金枫酒业股份有限公司, 上海 201501
融合魏斯氏菌(Weissellaconfusa,W.confusa),为非孢子形成,过氧化氢酶阴性,革兰氏阳性球菌,因其在微观和宏观形态方面与乳酸菌的其它代表菌种相似,经常被传统和商业表型鉴定方法误鉴定为乳酸菌和明串珠菌属(Leuconostoc)[1-2]。1993年,魏斯氏菌属(Weissella)由COLLINS等人根据16S rRNA序列分类命名[3],目前已鉴定出的魏斯氏菌达22种[4]。融合魏斯氏菌是一种广泛存在于发酵食品、肉类、牛奶、蔬菜和土壤的微生物[5],因能增加对肠黏膜的粘附、产生抗菌物质,具有免疫调节、抗氧化等功效[6],被认为是潜在的益生菌。此外,融合魏斯氏菌能正常存在于人类胃肠道(Gastrointestinal tract, GIT)中,并已有研究人员将其从健康人体的粪便中分离出来[7],这也是其被认为是潜在的益生菌的重要原因之一。
融合魏斯氏菌能专性异型发酵葡萄糖,产生乳酸的两种旋光异构体。除乳酸外,融合魏斯氏菌发酵葡萄糖还产生二氧化碳、乙醇和乙酸[8]。融合魏斯氏菌高产胞外多糖(Exopolysaccharides, EPS),其具有显著的生物活性和理化特性[9],可以提高食品的安全性,改善食品的感官特性,对发酵食品的品质有重要的影响,在食品工业中起着重要的作用。在酸奶、奶酪等乳制甜点中,可用于解决酸奶和奶酪的脱水的问题[10]。在发酵烘焙产品中,融合魏斯氏菌的胞外多糖可以改善发酵乳制品和谷物产品的结构特性,以减少或替代某些添加成分,如牛奶蛋白、淀粉、果胶和其他亲水胶体等[11]。在发酵食品中,融合魏斯氏菌还可以作为附属发酵剂以提升发酵产品最终的感官品质。在面团发酵阶段加入融合魏斯氏菌可显著提高产品的质量[12],如提高产品黏度[13]、抗老化性能[14],降低产品硬度[15]等,也能在发酵食品中产生更多的营养成分和风味物质,如提高游离氨基酸的含量[16],使酯类含量也更加丰富等[17]。
也有一些报道表明融合魏斯氏菌的存在会对相关食品产生一些负面效应,如融合魏斯氏菌产生的葡聚糖可能导致全粒饼干厚度的增加[18],酱油中氨基甲酸乙酯(Ethyl carbamate, EC)的生成与融合魏斯氏菌密切相关[19]。此外,融合魏斯氏菌的安全性也存在一定的争议,有研究报道了在人类的临床病例样本中罕见的分离出了融合魏斯氏菌。这些都直接限制了融合魏斯氏菌在食品领域中的广泛应用,未来对于融合魏斯氏菌的食品安全性方面还需要更加深入的研究。
近年来,由于融合魏斯氏菌良好的益生潜力与在发酵食品中独特的功能特性,其在微生物学、发酵食品工业、食品加工等方面都表现出极大的应用潜力,也受到越来越多研究者的关注。基于此,本文将对融合魏斯氏菌的安全性、益生潜力、胞外多糖,及其在发酵食品中的功能特性、在食品中的应用研究进展进行综述,旨在为融合魏斯氏菌在食品行业进一步研究与应用提供参考价值。
1 融合魏斯氏菌的安全性
尽管一些文献报道了融合魏斯氏菌表现出了良好的益生潜力[20-21],但美国食品药品管理局(U.S. Food and Drug Administration, FDA)和欧洲食品安全管理局(European Food Safety Authority, EFSA)暂未将其纳入安全资格认定(Qualified Presumption Of Safety, QPS)的列表中[22]。有研究认为,在22种已知的魏斯氏菌中,融合魏斯氏菌是与人类感染有关的菌种,HURT W等人则认为它是导致人类疾病的罕见病因[23],表现出对万古霉素天然的耐药性,最低抑菌浓度高达256 μg/mL。与融合魏斯氏菌相关的病例主要包括:菌血症、心内膜炎、脑膜炎、假体关节感染等。融合魏斯氏菌广泛存在环境中,并且可定殖在人类肠道中,有研究人员认为手术或化疗引起的肠道菌群改变,以及黏膜屏障的破坏可能导致融合魏斯氏菌的移位,使宿主容易感染这种微生物[2]。总的来说,融合魏斯氏菌致病机理目前还不清楚,未来还需要更加深入的探讨与研究。
1.1 融合魏斯氏菌感染病例
目前有19篇文献报告了共50例由融合魏斯氏菌感染引起的病例,其中免疫缺陷有24例(50%),万古霉素作为主要的治疗抗生素也有27例(54%)[24]。菌血症是融合魏斯氏菌感染的典型临床表现。1997年至2007年,台湾报告了10 例由融合魏斯氏菌感染引起的菌血症病例,这些病例有免疫抑制、多微生物感染和中心导管放置等共同特征[25,26]。2017年,ABERKANE等人报道的融合魏斯氏菌与阴沟肠杆菌联合感染引起的菌血症,也具有上述特征[25]。该患者有髓母细胞瘤病史。之后患骨肉瘤,在化疗过程中出现发热,最开始使用哌拉西林、他唑巴坦、万古霉素联合治疗,效果不佳。最终在四次血培养中(三次在植入式腔室中,一次在导管清洗)检测出融合魏斯氏菌与阴沟肠杆菌。耐药性检测发现阴沟肠杆菌表达低水平的天然头孢菌酶,无相关耐药性,而融合魏斯氏菌对万古霉素、替可普兰、头孢他啶、头孢噻肟、磺胺甲恶唑、甲氧苄啶有耐药性。
2020年,CHEAITO等人报道了第一例由融合魏斯氏菌感染引起的脑膜炎病例[5]。该患者78岁,因中风长期卧床,患有阿尔茨海默症、2型糖尿病、冠状动脉疾病,有肺炎链球菌脑膜炎病史、胆管炎病史。患者最初的临床表现加上实验室检查证实了细菌性脑膜炎的诊断,万古霉素和头孢菌素被经验性的用于细菌性脑膜炎治疗,而融合魏斯氏菌对这两种抗生素都有耐药性。确诊为融合魏斯氏菌脑膜炎感染后,停用万古霉素并给予美罗培南、氨苄西林持续8 d,患者恢复到正常健康状态。研究发现,在该年龄段和特征相似的病例中分离出融合魏斯氏菌并不是细菌性脑膜炎的典型病因。患者的高龄、糖尿病状态和其他合并症状可能造成免疫损害状态。推测患者胆管炎病史以及对胆道的手术操作可能导致黏膜损伤造成微穿孔,从而导致继发性脑膜炎。
目前一共报道过3例由融合魏斯氏菌感染引起的心内膜炎病例。第一例是一名营养不良的酒精性肝硬化患者,第二例是伴有主动脉瓣关闭不全的免疫活性宿主,最近一例发生在2021年[23],该患者46岁,有2型糖尿病、高胆固醇血症、高血压和先天性二尖瓣主动脉瓣病史。与上面的第二例患者有许多相似之处,该患者无症状,无发热报告,在常规超声心电图监测中偶然发现融合魏斯氏菌感染。抗生素抑菌实验确定最低抑制浓度(mg/L)∶万古霉素>256、替考拉宁≥256、青霉素= 0.38、庆大霉素= 0.75、利奈唑胺= 2、头孢曲松= 3、头孢噻肟= 0.5、阿莫西林= 0.125、红霉素= 0.5、米诺环素= 1。最后使用阿莫西林与庆大霉素治愈。
目前报道的融合魏斯氏菌感染引起的病例,患者大都有严重的基础性疾病,加之免疫缺陷、器官移植、侵入性手术、联合感染等因素[24]造成自身免疫力下降,以及万古霉素等(产生天然耐药性)的使用才是在人类临床病例样本中罕见分离出融合魏斯氏菌最可能的原因,融合魏斯氏菌并非是导致疾病直接发生的因素。在临床病例中,融合魏斯氏菌很难用传统的表型方法鉴别,患病初期易被诊断为一般的细菌性感染,导致经验性的使用万古霉素等抗生素进行治疗。根据临床病例治愈经验,使用基质辅助激光解吸电离飞行时间质谱(Matrixassisted laser desorption ionization-time of flight mass spectrometry, MALDI-TOF MS),结合16S rRNA,可快速、准确鉴定出融合魏斯氏菌。之后进行体外药敏实验,确定抗生素最低抑菌浓度,最后使用抗生素进行针对性治疗[5,23,25]。
1.2 毒理实验及耐药性
鲸魏斯氏菌(Weissellaceti)已被证明是引起鱼类疾病的病原体,体内编码几个与毒力有关的基因,但这些基因在融合魏斯氏菌中缺失,表明鲸魏斯氏菌和融合魏斯氏菌之间存在远距离进化关系[27]。CUPI等人对Sprague-Dawley大鼠进行口服融合魏斯氏菌(灌胃)实验,90 d后大鼠体内融合魏斯氏菌的剂量水平高达9.2×108CFU/kg bw/day,剂量体积为5 mL/kg,结果显示大鼠耐受性良好,没有引起任何需要治疗的相关效应。此外,融合魏斯氏菌在反向突变研究中未显示任何诱变活性,在活体红细胞微核研究中也未显示任何遗传毒性,未发现皮肤刺激,仅在实验中观察到轻微的眼睛刺激[28],结果表明融合魏斯氏菌是无毒、安全的物种。
除了对万古霉素等少数抗生素具有天然的耐药性,融合魏斯氏菌对用于人类和动物传染病的常用抗生素都很敏感。目前还没有建立魏氏菌属抗生素敏感性的标准方法和解释标准,临床上常使用肉汤稀释法、琼脂法以及电子检测等方法来测定融合魏斯氏菌对抗生素的敏感性。迄今已发现的融合魏斯氏菌抗生素最低抑菌浓度(Minimum Inhibitory Concentration, MIC)与 EFSA 规定的明串珠菌种的 MIC 抗生素特异性断点大致相似[27]。BOURDICHON在实验中也发现,除卡那霉素和氯霉素外,所有实验菌株的MIC值均等于或低于专性乳酸杆菌异型乳酸发酵菌种的EFSA临界值[24]。
1.3 临床分离现状
研究显示,没有具体特征能够区分食物和临床来源的融合魏斯氏菌之间的差异性,加之其能够正常存在于健康人体的肠道中,表明融合魏斯氏菌是可作为潜在的益生菌的安全物种。BOURDICHON等人分离得到了 17株临床和26株食物来源的融合魏斯氏菌,两个来源的融合魏斯氏菌表现出非常高的泛基因组和较小的核心基因组,表明在不同菌株之间存在着遗传多样性。对其全基因组和3个额外的可用序列比较时,均未发现任何聚类,也未发现按G +C比例插入的序列[24]。
2020年,有研究人员采用培养组学的方法从人粪便中分离纯化得到31株乳酸菌株,先通过MALDI-TOF质谱和16S rRNA基因测序对其进行鉴定,并对获得的菌株进行溶血活性、抗生素敏感性、耐酸性和耐胆盐性、抗菌活性、形态和生理特性测试。最终选择了三株融合魏斯氏菌:YM5Y、YM5S1和YM5S2作为潜在的益生菌候选菌株。这三株融合魏斯氏菌均没有溶血活性,不会引起绵羊血液中红细胞的溶解,并且对所测试的大多数抗生素都很敏感[7]。
1.4 安全应用现状
目前,许多文献都认为融合魏斯氏菌可安全的用于家禽、鱼类等动物的饲喂,并且有潜力成为鱼类养殖的一种新型益生菌。2018年,STURINO基于相关文献研究,表明融合魏斯氏菌是动物正常胃肠道微生物群的成员,也能作为食物和饲料存在于饲养动物的胃肠道[27]。在CUPI的灌胃实验的测试条件下,融合魏斯氏菌并未显示出任何毒性作用[28],也表明其是可以作为饲喂微生物的安全产品。2020年,KAHYANI等人为探究融合魏斯氏菌对虹鳟鱼的益生作用,用不同浓度的融合魏斯氏菌(1.5 × 107CFU/g、3 × 107CFU/g和4.5 × 107CFU/g) 饲喂虹鳟鱼。2个月后,发现虹鳟鱼体内溶菌酶活性显著增加、肿瘤坏死因子-α(TNF-α)和白细胞介素8(IL-8)显著上升,同时体内乳酸菌水平显著增加,表明融合魏斯氏菌具有改善虹鳟鱼的生长性能、血清免疫参数、免疫相关基因表达和调节肠道菌群的益生作用[29]。
融合魏斯氏菌已被列入2011年国际乳品业联合会(International Dairy Federation, IDF)的清单中,德国生物制剂委员会也已确定融合魏斯氏菌属于风险组1(Risk Group 1, RG1)微生物,这意味着它们不太可能引起人类疾病。美国典型培养物保藏中心(The American Type Culture Collection, ATCC)建议将融合魏斯氏菌ATCC 10881TM作为生物安全一级(Biosafety level-1, BSL-1)微生物移交使用,根据美国公共卫生服务指南,BSL1是“基本保护水平”,适用于已知不会导致正常健康人疾病的微生物[27]。考虑到融合魏斯氏菌在各种食品基质中的分离和安全使用已有较长时间,并且已经成功从健康人体中分离出来,目前也没有任何有害相关代谢活性基因和毒力基因证据证明融合魏斯氏菌的有害性[24]。因此,融合魏斯氏菌应当被视为在食品链、发酵过程中的食品培养物和益生菌候选菌株中的安全物种。
2 融合魏斯氏菌的益生潜力
发酵食品是益生菌的丰富来源,传统发酵食品中分离的乳酸菌很多具有益生特性。具备益生特性的乳酸菌一般需要符合以下条件:首先需要耐胃酸、耐胆盐,能通过人体消化道环境存活;其次具有肠道粘膜上皮细胞的黏附能力,能够进入肠道后定植并生长繁殖;再次必须通过对动物进行急性、亚急性毒性等试验,证明无致病性、不产生生物胺等有害物质,对多数抗生素敏感,无溶血活性等[30]。近些年来,研究人员从发酵食品中分离出的融合魏斯氏菌都有较好的胃酸和胆汁耐受性,并对单增李斯特菌、大肠杆菌、金黄色葡萄球菌等致病菌有较好的抗菌活性,表现出良好的益生潜力。
2.1 肠道生存能力
良好的肠道生存能力是益生菌能成功作用于人体的首要条件。人体在禁食期间胃部pH可低至1.5,餐后pH可升至3甚至更高[31]。人体胆汁的相关生理浓度在0.3% ~ 0.5%之间,胆盐有洗涤活性,能溶解细胞表面蛋白,破坏细胞膜的结构完整性,对细菌细胞是有害的[32]。益生菌通常是口服的,必须具有通过胃和肠的能力,所以需要益生菌能够在高酸性条件下存活,并通过保持足够的数量对胆盐表现出可接受的耐受性。在低的pH 下,乳酸菌能够将乳酸和质子释放出细胞以保护细胞膜[20,33]。乳酸菌分泌的胆盐水解酶是一种重要的益生菌标记物,它有助于微生物抵抗胃肠道中毒性的胆汁环境,也增加了乳酸菌菌株的肠道存活率。目前文献所报道的具有益生潜力的融合魏斯氏菌大都能够在pH为2~3以及含有0.3%胆盐的环境下正常存活[20-21,34-36](见表1)。LAKRA等人从印度传统发酵食物中分离出的融合魏斯氏菌MD1,在 pH为2的条件下,培养3 h和24 h后存活率分别为6.81 log10CFU/mL和5.47 log10CFU/mL,同时能耐受0.3%的胆盐混合物3 h,具有较好胃肠道耐受性[20]。NATH等人从印度酸大米中分离出的融合魏斯氏菌strain GCC_19R1,在pH为3时表现出显著的生长,无显著的活力损失,同时可抵抗1%的牛胆汁盐3 h,显示出对胆汁盐的强耐受性[21],具有作为潜在益生菌的应用价值。
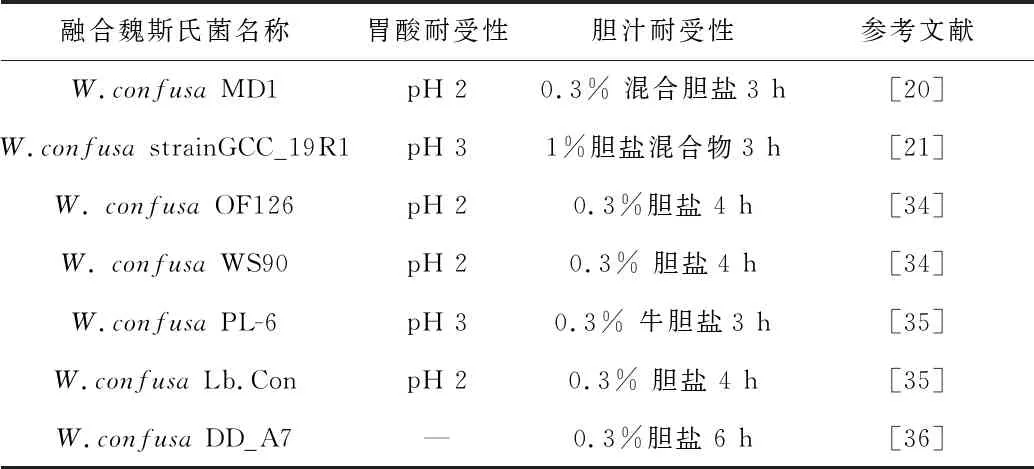
表1 具有良好肠道生存能力的融合魏斯氏菌
2.2 抗菌活性
目前文献报道的具有益生潜力的融合魏斯氏菌大都具有良好的抗菌活性(见表2),可用于食源性疾病的防治并改善肠道微生物环境。微生物的抑菌活性最主要的来源是抗菌化合物,如有机酸、过氧化氢、细菌素或其他抑菌物质的产生,从而抑制病原菌的生长[21]。此外,还可通过影响病原菌毒力相关基因的表达,或酶与抗菌肽段残基通过盐桥、氢键和金属相互作用而达到抑菌的效果[31]。融合魏斯氏菌具有的良好抗菌活性,主要是其产生抗菌化合物,如乳酸、抗菌物质、细菌素等。

表2 具有良好抗菌能力的融合魏斯氏菌
2.2.1产乳酸抗菌
目前文献报道融合魏斯氏菌具有的抗菌活性,大多是产生乳酸而具有抗菌活性。乳酸具有广谱的抑菌活性,对革兰氏阳性和阴性细菌都有抑制作用[37-38],乳酸能够通过增加细菌外膜通透性、改变细菌胞内渗透压以及抑制胞内大分子合成等方式来抑制有害微生物的生长。研究中报道的融合魏斯氏菌 MD1[20]、融合魏斯氏菌OF126、融合魏斯氏菌WS90[34]、融合魏斯氏菌PL-6[35]都是因产生乳酸而抑制病原微生物的活性。
2.2.2产抗菌物质抗菌
一些融合魏斯氏菌能够产生某些抗菌化合物,如融合魏斯氏菌strain GCC_19R1产生的抗菌物质,对蜡样芽孢杆菌SN_SA与铜绿假单胞菌GCC_19W1有明显的抑制作用,同时对一些革兰氏阴性菌也有抑制作用[21]。杜宏等人从东北传统酸菜中获得的融合魏斯氏菌 Z01,在光学显微镜与扫描电镜下发现其粗提物对单增李斯特菌生物膜形成的数量及生物膜形态也具有显著的影响。当粗提取物的抑菌浓度分别为8 mg/mL和16 mg/mL时,对单增李斯特菌生物膜的形成抑制率以及对生物膜黏附细菌的抑制率分别达到了59.33%、77.77%和14.49%、26.44%[38]。
2.2.3产细菌素抗菌
融合魏斯氏菌还可通过合成细菌素而具有抑菌活性。细菌素通过削弱目标细胞膜的完整性导致细胞死亡,达到杀菌效果。细菌素是乳酸菌代谢过程中产生具有抗菌活性的低分子量多肽或蛋白质类物质,在人体内可被蛋白酶降解,对肠道微生物群也不会产生大的影响,也可被用作防腐剂添加到食品中[39]。TENEA GN 等证明了融合魏斯氏菌 Cys2‐2产生的细菌素能够抑制大肠杆菌、沙门氏菌和志贺氏菌的活性[40]。目前有关融合魏斯氏菌产细菌素的研究报道还非常少,相关基因调控机制还不清楚,未来还需要更加深入的研究。
2.3 抗氧化活性
活性氧(过氧化氢、次氯酸等)和自由基(羟基自由基、超氧化物阴离子等)与人类疾病有着直接或间接的关联,人体中过量的自由基会破坏脂质、蛋白质和脱氧核糖核酸等大分子[30]。氧化应激反应时,自由基在生物系统中具有破坏作用,它能与活细胞中的所有生物大分子发生反应。因此,抗氧化活性测试化合物抑制自由基清除活性的能力是非常重要的。DPPH自由基是一种稳定的自由基,常被用于评价抗氧化剂清除自由基的活性(融合魏斯氏菌清除DPPH自由基能力见表3)。LAKRA等人发现融合魏斯氏菌 MD1表现出强大的抗氧化活性,具有强烈的DPPH清除活性和抑制脂质过氧化作用。MD1对完整细胞的DPPH清除活性和脂质过氧化的抑制分别为69.15%和64.14%,而之前文献中报道的融合魏斯氏菌KR780676和其它的几种融合魏斯氏菌对DPPH的清除活性均小于40%。另外,融合魏斯氏菌 MD1的完整细胞对脂质过氧化的抑制为64.14%,高于融合魏斯氏菌 KR780676 和食窦魏斯氏菌 JW15[20]。

表3 具有良好抗氧化能力的融合魏斯氏菌
融合魏斯氏菌所表现出的抗氧化性,也可能来源于其产生的代谢产物,如葡聚糖。研究人员在尼日利亚发酵谷物中发现的融合魏斯氏菌 OF126,能产生以α-(1→6)和α-(1→3)连接,平均分子量为1.1 × 106Da的葡聚糖,该葡聚糖在4 mg/mL的剂量下,对羟自由基的清除活性可达86.5 %,甚至优于抗坏血酸(83.1%);对DPPH自由基清除活性虽弱于抗坏血酸,然而其清除率仍可达67.4%[42]。
2.4 疏水性与自聚性
益生菌与肠黏膜的粘附增加了其在肠道内的持久性,从而为益生菌发挥作用提供了充足的时间。益生菌粘附在肠上皮细胞上不仅能有助于减少病原菌的定植,还能诱导免疫调节[41]。细胞表面疏水性被认为是肠上皮细胞和黏膜表面粘附的参数之一。分析细胞表面疏水性是微生物在宿主细胞上定植所需的重要理化变量。自聚性与疏水性有类似的作用,有助于益生菌在肠内的定植,并与肠上皮细胞显著粘附,从而防止病原菌粘附。乳酸菌的疏水性百分比常用正十六烷和二甲苯测定,疏水指数大于70%的被归类为疏水,目前文献所报道具有益生潜力的融合魏斯氏菌对正十六烷的疏水性大都在35%左右,对二甲苯的疏水性在30%左右(见表4)[20-21,34]。有人认为目前报道的融合魏斯氏菌因疏水性不足,难以验证这些菌株的潜在益生菌用途。而DEBASISH等人从泡菜中分离出的融合魏斯氏菌 DD_A7对二甲苯的疏水性达到了82.11 %,具有非常强的供电子特性,有更大的疏水表面,表明其更容易定植在肠道[36]。
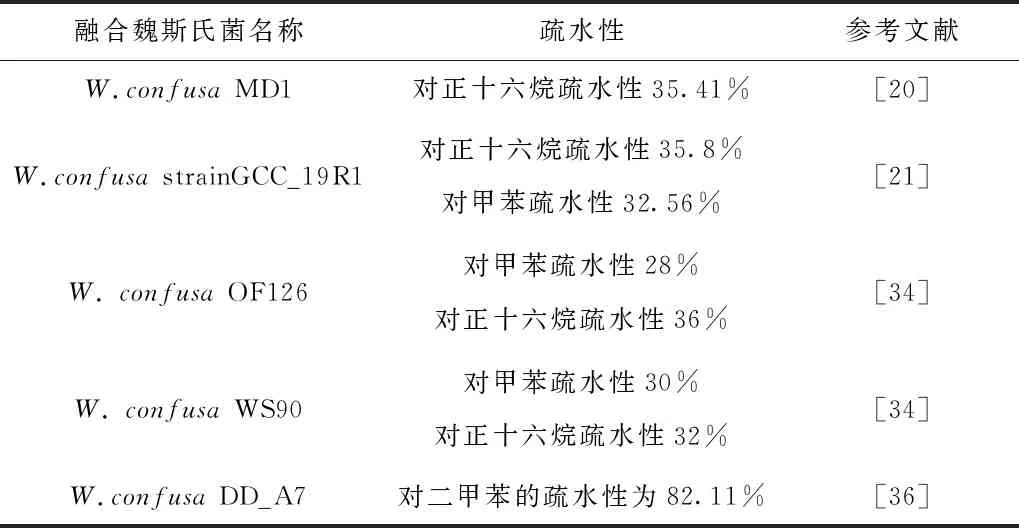
表4 具有良好疏水性的融合魏斯氏菌
除了疏水性与自聚性,有研究发现乳酸菌在肠道的粘附能力也与细胞表面生物膜的特性密切相关。生物膜形成的初步阶段是由于细胞表面存在疏水电位,因此推测生物膜的存在与肠道粘附能力有关,例如在融合魏斯氏菌 DD_A7细胞表面观察到生物膜的形成,在实验中发现表面生物膜的形成使其在HCT-116细胞表面具有潜在的粘附特性[36]。由于胞外多糖等物质的释放,在融合魏斯氏菌 MD1 观察到粗糙的表面和厚的生物膜的形成,这种特性具有降低某些致病菌生长的特性[20]。目前,对于融合魏斯氏菌细胞表面性质的研究较少,未来还需要有更多深入的研究以证明它在肠道环境中的粘附与定殖特性。
3 融合魏斯氏菌胞外多糖
胞外多糖是广泛存在于植物、动物、微生物和其他生物体中的细胞外聚合物,乳酸菌分泌的胞外多糖通常被认为是安全的(Generally recognized as safe, GRAS)[42],可以作为天然食品的成分或添加剂,也可用于营养药品和功能性食品的加工[43]。魏斯氏菌胞外多糖的平均产量远远高于其他实验室物种,融合魏斯氏菌和食窦魏斯氏菌在魏斯氏菌中的胞外多糖产量最高(具体见表5)。融合魏斯氏菌高产葡聚糖(Dextran),这可能与其体内的蔗糖酶基因表达有关,这种酶作用于糖苷键将蔗糖水解为葡萄糖,并用于多糖和果糖的生物合成,然后将其释放到细胞外环境[44-45]。SHUKLA等人从融合魏斯氏菌中合成了葡聚糖蔗糖酶WcCab3 DSR,并成功的将其用于葡聚糖和低聚葡萄糖的体外合成[46]。

表5 发酵食品中的融合魏斯氏菌产多糖概况
产右旋糖酐(一种葡聚糖)是魏斯氏菌的一个典型表型特征,高分子量右旋糖酐可改善发酵产物的流变性,具有免疫调节和抗病毒活性,是具有抗病毒和免疫调节活性的生物制剂 ,相对较低分子量的右旋糖酐在制药工业中被用作血浆替代品[47]。目前有关融合魏斯氏菌胞外多糖功能特性的研究大多集中在发酵食品中,在医药领域的研究应用还较少,未来还需进一步开发与应用。
3.1 益生特性与免疫调节
融合魏斯氏菌产生的葡聚糖大多数都是线性的,由连续α-(1→6)连接的D-葡聚糖基单元组成,几乎没有α-(1→3)连接的分支[58]。ZHAO等人研究发现,融合魏斯氏菌胞外多糖能够刺激益生菌的生长,如乳酸杆菌属(Lactobacillus)和双歧杆菌(Bifidobacterium)。融合魏斯氏菌XG-3产生的XG-3葡聚糖具有高益生元活性,可刺激益生菌的生长,这意味着XG-3葡聚糖可能是一种潜在的益生元[42]。
与葡萄糖和果糖单位相比,含有半乳糖单位的线性链的益生元更容易发生肠道微生物发酵。此外,肠道菌群通过发酵半乳糖产生大量的SCFAs,可提供多种健康益处,如抗糖尿病、抗肥胖作用,以及通过肠-肝代谢组学途径控制血胆固醇水平。DEVI等人从发酵食品中分离的融合魏斯氏菌KR780676,能够产半乳聚糖,其含有α-(1→6)连接单位,具有100%线性,对人类消化液性具有较高的抗性,可抵抗人类消化酶的水解,并能到达肠道进行结肠发酵。该聚半乳糖能促进植物乳杆菌和发酵乳杆菌的生长,分别达到8.01 log10CFU/mL和7.65 log10CFU/mL,并对上述两种益生菌的促进作用表现出相似的趋势[50, 58]。
KAVITAKE 等人的综述中报道了在小鼠模型中评估融合魏斯氏菌胞外多糖的免疫调节潜力。胞外多糖处理组小鼠的IgA和IgG水平高于对照组。与来自突变体的胞外多糖相比,来自野生型融合魏斯氏菌的胞外多糖显示出最高的免疫球蛋白产量[4]。
3.2 抗菌活性
目前有关乳酸菌胞外多糖具有抗菌活性的报道还较少,在魏斯氏菌中仅有一篇文献报道了胞外多糖的抗菌活性。LAKRA等人发现融合魏斯氏菌所产的甘露聚糖在不同浓度(0.25 mg/mL ~ 1.25 mg/mL)下均表现出良好的抗菌活性,在浓度为1.25 mg/mL时抗菌活性最高。该甘露聚糖可通过影响细胞表面修饰降低细胞与细胞表面的相互作用来抑制病原菌的早期粘附和自聚。对金黄色葡萄球菌的抗菌活性最高(74.62±2.31)%,其次是单核增生李斯特菌(65.73±3.20)%、肠道沙门氏菌(57.67±2.70) %和对伤寒沙门氏菌(56.81±2.37) %[52]。
3.3 对发酵食品质构的影响
融合魏斯氏菌对食品质构的影响大多源于融合魏斯氏菌胞外多糖,一般被用作天然的添加成分,常被用来改善发酵乳制品和谷物产品的结构特性。
3.3.1对水分迁移的影响
脱水收缩是酸奶制作过程中最常见的问题,处理不好会导致凝胶收紧后乳清从蛋白质基质中排出,乳清上升到凝胶表面。工业上一般使用不同类型的增稠剂和稳定剂,如明胶、海藻酸盐、淀粉或果胶[59]来规避这个问题。然而,这些添加剂不全是GRAS,也不能满足消费者需要较少人工添加剂产品的要求[60],融合魏斯氏菌胞外多糖的加入可以替代这些人工添加剂。
融合魏斯氏菌 QS813生产的高分子量线性葡聚糖被证明是小麦面筋冻融循环(Freeze-thaw cycles, FTC)期间改善面筋的有效冷冻保护剂[55]。FTC会导致水分损失增加,使面筋的粘弹性降低,并改变水分的流动性和分布。融合魏斯氏菌 QS813产生的高分子量线性葡聚糖,能增加鲜面筋的含水量,降低水分的流动性和弹性参数,有效地延缓面筋的脱水,延缓FTC引起的水分再分配。FTC过程冰再结晶也会引起的机械损伤破坏连续面筋结构,而融合魏斯氏菌 QS813葡聚糖在FTC过程中保持了面筋的结构完整性,表明其对冰晶重结晶有抑制作用。
3.3.2对黏度与流变性的影响
乳酸菌胞外多糖被认为是面包质地改良剂,融合魏斯氏菌胞外多糖对发酵面团的黏度和流变学有着显著改善。20 ℃时,融合魏斯氏菌QS813在中式馒头(Chinese steamed bread, CSB)发酵面团中产生高含量的胞外多糖,并降低面团pH。高含量的胞外多糖和适宜酸度能改善酸面团CSB面团的抗老化性能,并诱导谷蛋白大分子聚合物(Glutenin macropolymer, GMP)颗粒团聚,从而进一步增加了CSB的比体积,降低面包瓤的硬度[14]。在发芽小扁豆酸面团发酵阶段加入融合魏斯氏菌SLA4可增加面团中葡聚糖含量,添加葡聚糖的小麦面包比体积增加,面包屑硬度和老化率也有一定程度的降低[13]。
融合魏斯氏菌 (W4)产生的W4胞外多糖能提高葡萄糖内酯(Gluconsactone, GDL)酸牛奶表观黏度,并对乳清保留率有显著的正向影响,凝胶强度与对照酸奶相比显著增强,并表现出与工业葡聚糖相同的性能[53]。
3.4 负面影响
但并不是所有的胞外多糖在发酵食品中都会产生积极影响,如在饼干制作过程中,非融合魏斯氏菌葡聚糖能提高最终的黏度与返黏度,而融合魏斯氏菌产生的葡聚糖EPS因酸化诱导可能会增加全粒饼干的厚度[18]。
4 融合魏斯氏菌在发酵食品中的功能特性
融合魏斯氏菌对发酵食品的品质具有举足轻重的作用,在酱油和泡菜的酿造过程中融合魏斯氏菌是重要的发酵菌种,在混合发酵体系中能通过与其它微生物的相互协同作用,改善产品的最终品质。目前报道的许多融合魏斯氏菌都是从混合发酵体系中获得,表明其在混合发酵体系中作为共发酵剂与其它环境微生物存在着不同程度的相互作用,进而对发酵食品的品质产生影响。此外,融合魏斯氏菌在发酵食品中还能够提高某些营养物质的含量,产生一些功能性物质,减少食品添加剂的使用等。
4.1 对发酵食品风味与营养影响
在荞麦发酵面团发酵过程中,异常威克汉姆酵母菌的存在能促进融合魏斯氏菌的生长,融合魏斯氏菌也能够延缓酵母菌的衰亡,二者在荞麦面团体系中具有共生作用。在荞麦馒头中,两者共同发酵体系中的酯类物质相对含量明显高于单一菌株发酵组,呈现更浓郁的果香和酒香。并且荞麦馒头的风味强度明显高于单一乳酸发酵和单一酵母发酵,在感官评定中取得最高的整体接受度[17]。
4.2 提高发酵食品中纤维与氨基酸含量
融合魏斯氏菌可作为发酵食品的共发酵功能菌株显著改善食品的风味及营养价值。在面团发酵阶段加入融合魏斯氏菌SLA4,在增强营养方面显示出潜在的进步(高纤维含量)和最终产品的感官(合成面包关键香气化合物)质量的提升[13]。在饼干制作过程中,融合魏斯氏菌与其它乳酸菌相比,使游离氨基酸含量增加最多,达到了0.46 g/100 g~0.48g/100 g[16]。
4.3 产叶酸
叶酸(vitamin B9)是涉及单碳转移反应代谢酶的重要辅助因子,这些代谢酶参与DNA复制、修复和甲基化,以及核酸、某些氨基酸、泛酸盐和其他维生素的合成,叶酸还可作为抗氧化剂,抑制自由基对动物基因组的攻击[61]。叶酸水平不足会导致一些健康问题,如神经管缺、或心血管和结肠癌风险增加。研究人员从泰国发酵鱼中分离出了52株乳酸菌,其中包括6株融合魏斯氏菌。这些融合魏斯氏菌具有良好的抗氧化活性,在无叶酸培养基中生长时,具有产生叶酸的能力,叶酸含量为1.05 μg/mL~ 2.86 μg/mL[62]。尽管产叶酸的水平较低,但这是第一个发现魏斯氏菌有生产叶酸的能力的研究。利用该原理可用于增加发酵食品中的天然叶酸含量,改善发酵食品的营养,并且有潜力开发出一款新型功能性食品。
4.4 替代亚硝酸钠
亚硝酸盐能抑制病原微生物的生长和食物的腐败,保护肉制品的颜色,在食品工业中被广泛用作食品防腐剂和腌肉制品的保色剂。亚硝酸盐会与仲胺或叔胺相互作用形成亚硝胺,具有致癌性、致突变性和致畸性[63]。因此,改善肉制品的色泽与降低肉制品中的亚硝酸盐含量在食品加工中起着重要的作用。在香肠发酵过程中,添加8 log10CFU/g的融合魏斯氏菌 L2,能增加香肠的红色度、硬度、黏附性和咀嚼性,并降低加工过程中的pH、水分活度和亚硝酸盐含量。融合魏斯氏菌L2也能抑制肠沙门氏菌的生长,并水解香肠中的肌原纤维蛋白。与对照组相比(亚硝酸钠0.05 g),加入融合魏斯氏菌 L2之后,酯含量更丰富,具有更理想的特性[64]。此研究填补了低亚硝酸盐香肠应用方面的研究空白,利用该原理可以改善干发酵香肠的红色度,并能有效地部分替代干发酵香肠中的亚硝酸盐。
4.5 降低农药残留
农药能够在人体组织或食物中积累,使用乳酸菌对这些化合物进行解毒和去污是一种可行的、安全的和低成本的方法。融合魏斯氏菌Lb.Con能够耐受不同浓度的毒死蜱,并能在添加了该农药的无糖培养基上生长。该菌株能够利用毒死蜱作为碳源,对毒死蜱的去除能力约为25%。此外,该菌株具有耐受胃肠道条件的能力,这使它适合用于降解积累在有机体和发酵食品的毒死蜱[65]。利用该原理可进一步研究该菌株在食品净化中的应用,在体内降低农药毒性的可能性,以及在生物降解过程中的机理。
4.6 产氨基甲酸乙酯
氨基甲酸乙酯(Ethyl carbamate, EC)是广泛存在于发酵食品中的2A级致癌物,能够直接导致人类产生肝癌,在酒类和发酵豆制品中经常被检出。瓜氨酸是高盐稀态发酵酱油中EC产生的最主要前体物质,盐胁迫是使体系中的融合魏斯氏菌积累瓜氨酸的主要原因。在9% NaCl条件下,融合魏斯氏菌能使瓜氨酸的转化率达到最高、积累最多[19]。因此,消除融合魏斯氏菌在盐胁迫下积累瓜氨酸的能力将有助于高盐稀态发酵酱油中EC含量的控制。
5 总结与展望
目前没有发现有害的相关代谢活性基因和毒力基因证据来证明融合魏斯氏菌的有害性,国内外从临床病例中发现融合魏斯氏极为罕见,且患者大多患有严重的基础性疾病。宿主的潜在因素和万古霉素的使用才是在人类临床病例中罕见分离出融合魏斯氏菌最可能的解释。
融合魏斯氏菌胞外多糖因多样性和高产量而被大量报道,各种胞外多糖具有不同的结构特性和生物学活性,在食品与医药领域有极大的开发应用潜力。深入研究融合魏斯氏菌胞外多糖的相关功能基因、对功能基因过表达、培育优良的工程菌株对未来工业化大规模生产胞外多糖有重要的意义。在一些发酵食品中,融合魏斯氏菌的存在能产生更多的风味物质与营养成分,但有关代谢调控机制还不清楚,可能导致融合魏斯氏菌对发酵食品的品质产生不确定性,未来还需要更加深入的解析其调控代谢机制,以保证产品的最终品质。
融合魏斯氏菌具有优秀的胃肠道生存能力与肠道定殖特性、对许多病原微生物也有抑制作用、有的还具良好的抗氧化活性,加之已从健康人体的粪便中分离出来,被广泛的认为具有成为益生菌的良好潜力。有关益生菌的研究已成为当下的热点话题,目前已知的益生菌大部分为乳杆菌属和双歧杆菌属,对其的研究已有确定的方向和成熟的体系,众多的益生菌产品也已经生产商用。但有关融合魏斯氏菌的研究尚在起步阶段,未来还需要利用更多的体外实验与动物试验来验证与益生特性相关的健康功效。此外,还应结合人体临床实验以保证体外实验与动物实验的可靠性,同时也能验证其在人体的安全性。未来随着相关研究的不断深入,融合魏斯氏菌必将在食品工业领域有越来越多的应用。

