泉州地区女性基因多态性与乳腺癌相关性研究
陈紫萱 王青兰 蒋燕成 陈德波 张志珊
乳腺癌是女性最常见的恶性肿瘤之一,我国女性乳腺癌患者的发病率和病死率逐年上升,根据国家癌症中心发布的《2018年全国最新癌症报告》,仅在2014年,中国女性癌症每年新发病例为27.89 万例,在女性恶性肿瘤中占比为16.51%,死亡病例为6.6 万例,在女性恶性肿瘤死亡占比为7.82%[1]。临床上,乳腺癌的复发和转移是导致患者治疗失败和死亡的主要原因,而乳腺癌细胞主要在血管和淋巴管的微环境中,通过某些分子定向导航,黏附,进行转移。这类小分子主要由组织细胞、炎性细胞产生,通过与相应受体结合后产生跨膜信号,趋化肿瘤细胞定向移动,故称之为趋化因子。因此,有研究提出“趋化因子受体”模型,用来解释肿瘤细胞归巢于特定器官的情况。基于第一个半胱氨酸残基位置,趋化因子可分为4 个亚家族,分别为 CXC、CC、C 和 CX3C ,分别与嗜中性粒细胞和单核细胞以及淋巴细胞趋化性相关。CXC 成员中的CXC 趋化因子配体12(C-X-C motif chemokine ligand 12,CXCL12),亦称为基质细胞衍生因子1(stromal cell derived factor-1,SDF-1),位于人类染色体10q11.1 上,几乎在所有器官的免疫细胞、成纤维细胞和上皮细胞中广泛表达。目前研究发现,CXCL12(SDF-1)、调节活化正常T 细胞表达与分泌的趋化因子2(C-C Motif Chemokine Ligand 2,CCL2,monocyte chemoattractant protein-1,MCP-1)、CXC 趋化因子配体18(C-X-C motif chemokine ligand 8,CXCL8,interleukin 8,IL-8)等多种趋化因子与乳腺癌的病理生理机制相关[2-4]。临床病理分析、体内外实验都发现这些趋化因子对乳腺癌的发生、增殖、侵袭和转移具有促进作用[5-8]。随着诊断方式的发展和进步,乳腺癌患者的存活率有了明显提升,但是诊断为晚期的患者,存活率仅为27%左右。考虑到肿瘤治疗复发、转移的异质性,常用的诊疗指标并不适用于所有患者,需要有更为个性化的检测指标。近年来,相关研究发现趋化因子及其受体的基因多态性与乳腺癌的发生发展有关[9-12]。因此,本研究检测CXCL12(SDF-1)、CCL2(MCP-1)、CXCL8(IL-8)趋化因子的基因型分布,并进一步探讨其与乳腺癌的相关性及临床病理学意义。
1 资料与方法
1.1 一般资料
收集2019年1—12月在福建省泉州市第一医院就诊的乳腺癌患者150 例,均为女性,年龄26~70 岁,平均(55.3±8.9)岁,设为病例组。其组织病理学确诊为原发性乳腺癌,未行放、化疗及内分泌治疗。根据临床分期标准,将150 例乳腺癌患者分为4 期,其中Ⅰ期46 例、Ⅱ期36 例、Ⅲ期39 例、Ⅳ期29 例。同一时间收集在本院体检的健康女职工150 名,年龄29~60岁,平均(51.4±8.0)岁,设为对照组。两组患者一般资料对比,差异无统计学意义(P>0.05),可对比。本研究经医院医学伦理学委员会批准,所有研究对象均签署书面知情同意书。
1.2 试剂与仪器
全血基因组核酸提取试剂盒[西安天隆科技有限公司,Ex-DNA 全血基因组Ⅲ代,20 T/盒(预封装),5 T/板×4 板],引物和PCR 试剂均为生工生物工程(上海)股份有限公司产品,Big Dye 测序反应试剂盒(96 孔板、8 孔联管,美国,ABI 公司)。核酸提取仪(NP968-S,西安天隆科技有限公司)。BioTeke 浓度检测仪(北京百泰克生物技术有限公司)。PCR 扩增仪22331(德国,Eppendorf 公司)。ABI 3500Dx 基因测序仪(美国,ABI 公司)。
1.3 方法
根据说明书步骤提取患者外周血DNA ;使用BioTeke浓度检测仪检测DNA 浓度及纯度。引物由生工生物工程(上海)股份有限公司合成。见表1。反应条件:94 ℃5 min,94 ℃30 s,58℃30 s,72 ℃45 s 共35 个循环,72 ℃延伸5 min。测序PCR 产物经纯化后上样至ABI 3500Dx 基因测序仪进行核苷酸序列测定。测序结果用Chromas 软件进行分析。

表1 CXCL12、CCL2、CXCL8 引物序列
1.4 观察指标
(1)观察CXCL12、CCL2、CXCL8 基因频率的哈温平衡;(2)CXCL12、CCL2、CXCL8 基因型分布与乳腺癌发病风险的相关性;(3)CXCL12、CXCL8 基因多态性与临床病理特征的关系。文章中体现了中国乳腺癌筛查与早诊早治指南、中国乳腺癌筛查与早期诊断指南、乳腺癌诊疗指南的临床参考或执行标准。
1.5 统计学方法
采用SPSS 22.0 统计软件对数据进行分析。判断病例组和对照组基因型分布是否符合Hardy-Weinberg 平衡,采用拟合优度χ2检验。两组间等位基因频率进行非条件Logistic 回归分析各基因型与乳腺癌发病风险的相关性。采用χ2检验分析其与临床病理的关系。
2 结果
2.1 数据符合Hardy-Weinberg 平衡
用病例组和对照组各基因型表达的实际频率与期待频率做χ2检验,验证结果各组均符合Hardy-Weinberg 平衡(P>0.05),各数据均具有群体代表性,可用于病例-对照组研究。见表2。

表2 CXCL12、CCL2、CXCL8 基因频率的哈温平衡
2.2 CXCL12、CCL2、CXCL8 基因型分布与乳腺癌发病风险的相关性
结果显示,CXCL12 基因GA 型基因频率在两组间差异有统计学意义,进一步分析在超显性模型下,GA 型女性患乳腺癌的风险低于GG 和AA 型(OR=0.589,95%CI:0.369~0.938,P=0.026)。CXCL8 等位基因A 和T 的频率在两组间有统计学差异(P=0.000),A 基因患乳腺癌的危险度相对较低,在显性和隐性模型中同样均显示出T 基因的患癌风险增加。CCL2 基因在不同遗传模型下病例组和对照组间差异均无统计学意义(P>0.05)。见表3。
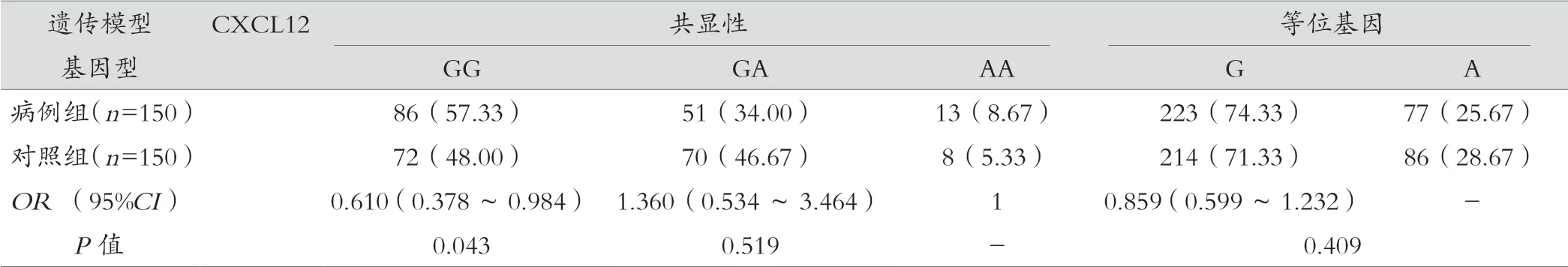
表3 CXCL12、CCL2、CXCL8 基因多态性与乳腺癌发病风险的相关性[例(%)]
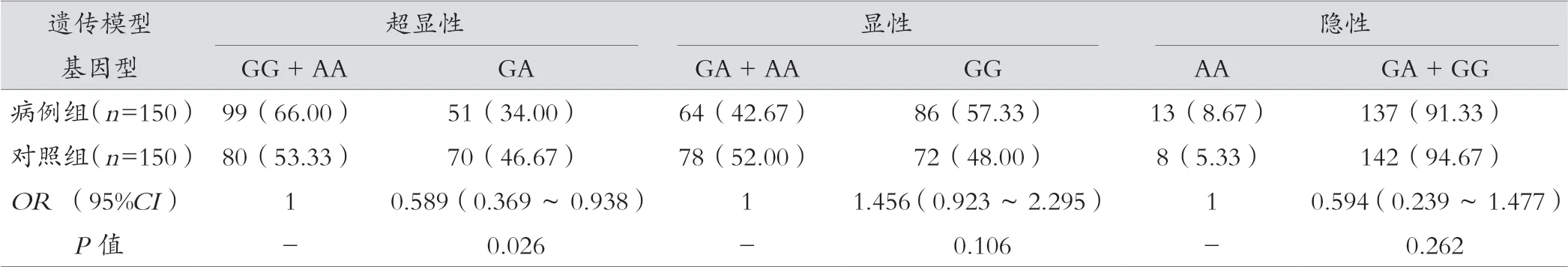
表3(续)
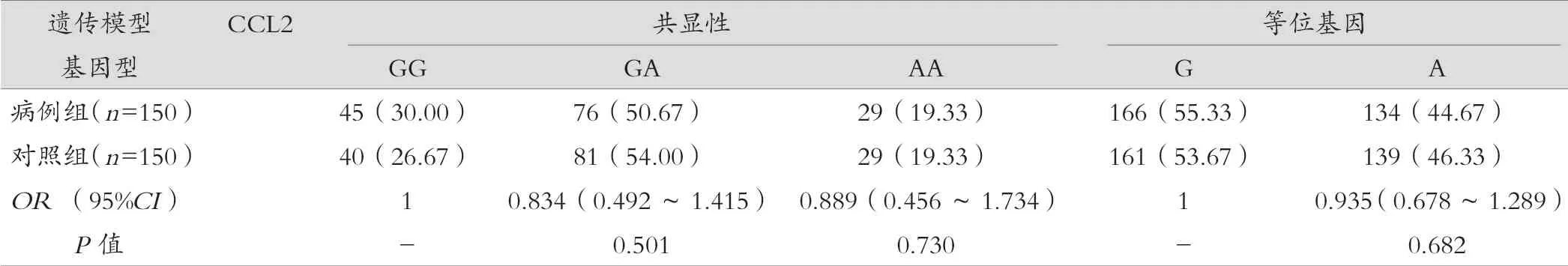
表3(续)
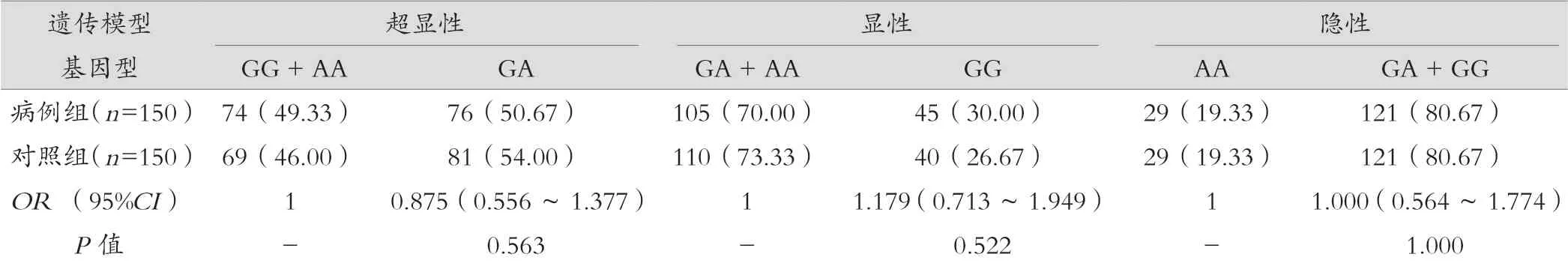
表3(续)
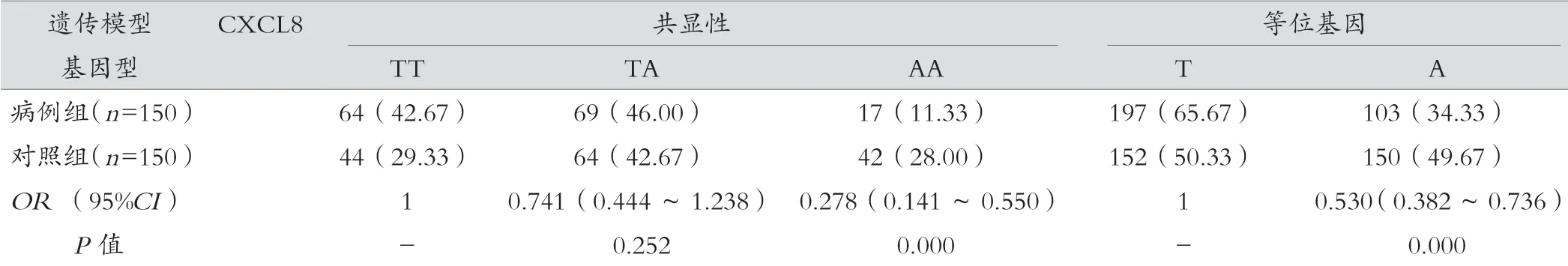
表3(续)
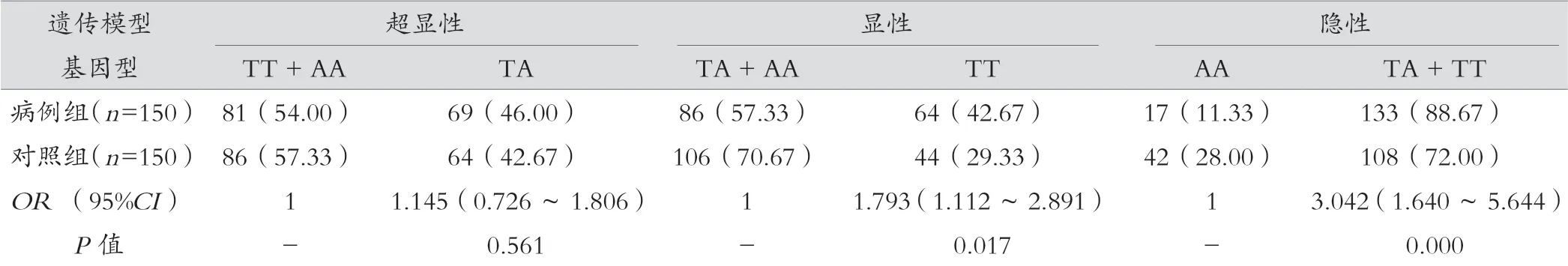
表3(续)
2.3 CXCL12、CXCL8 基因多态性与临床病理特征的关系
从表4、表5结果显示,CXCL12 超显性遗传模型中GA、GG+AA 与乳腺癌淋巴结转移、肿瘤大小相关(P=0.009、P=0.008)。CXCL8 在显性遗传模型中与临床病理特征无相关,在隐性模型中由于AA 基因型在乳腺癌中所占比例较低,存在差异性较大,故不做统计学分析。
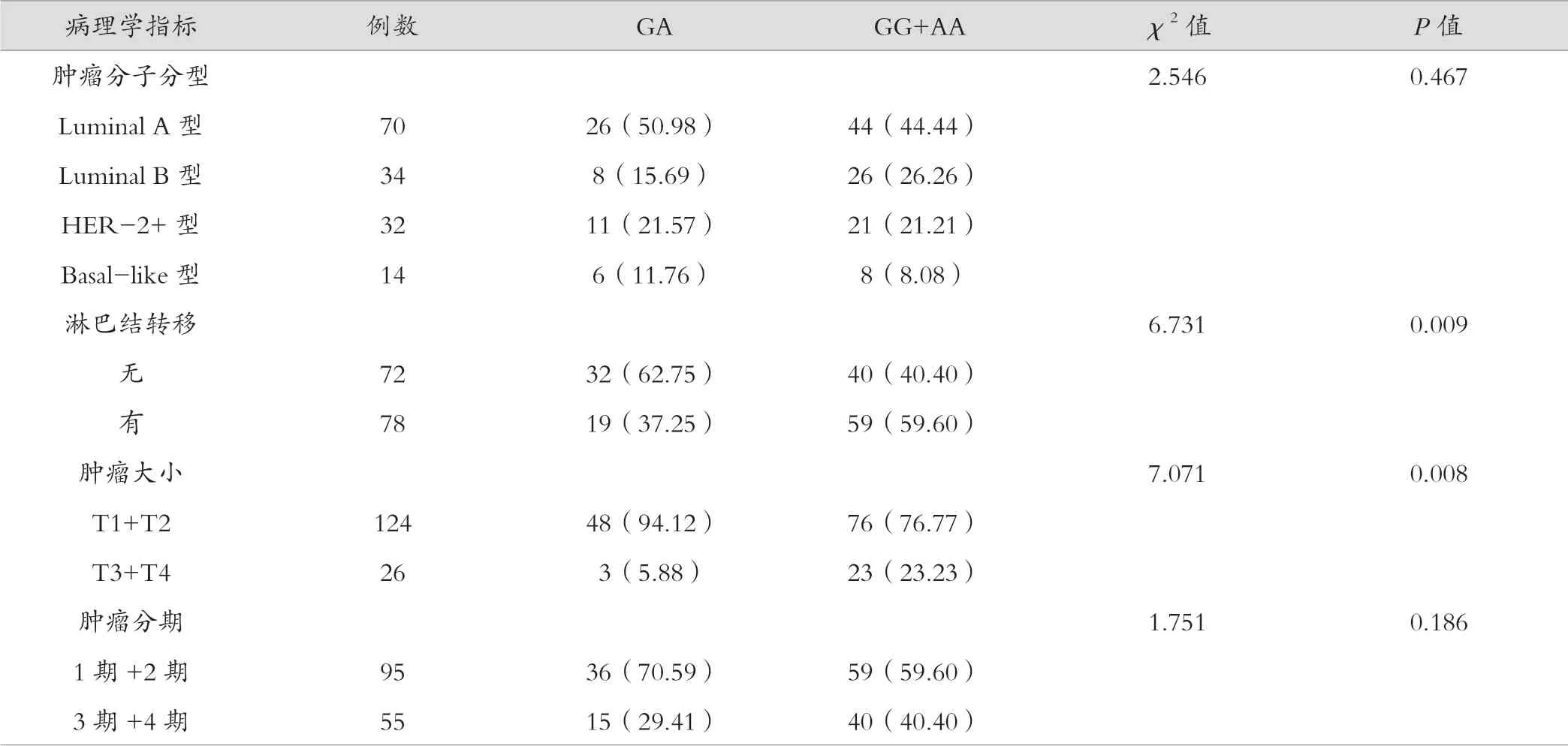
表4 CXCL12 基因多态性与乳腺癌临床病理特征的关系[例(%)]
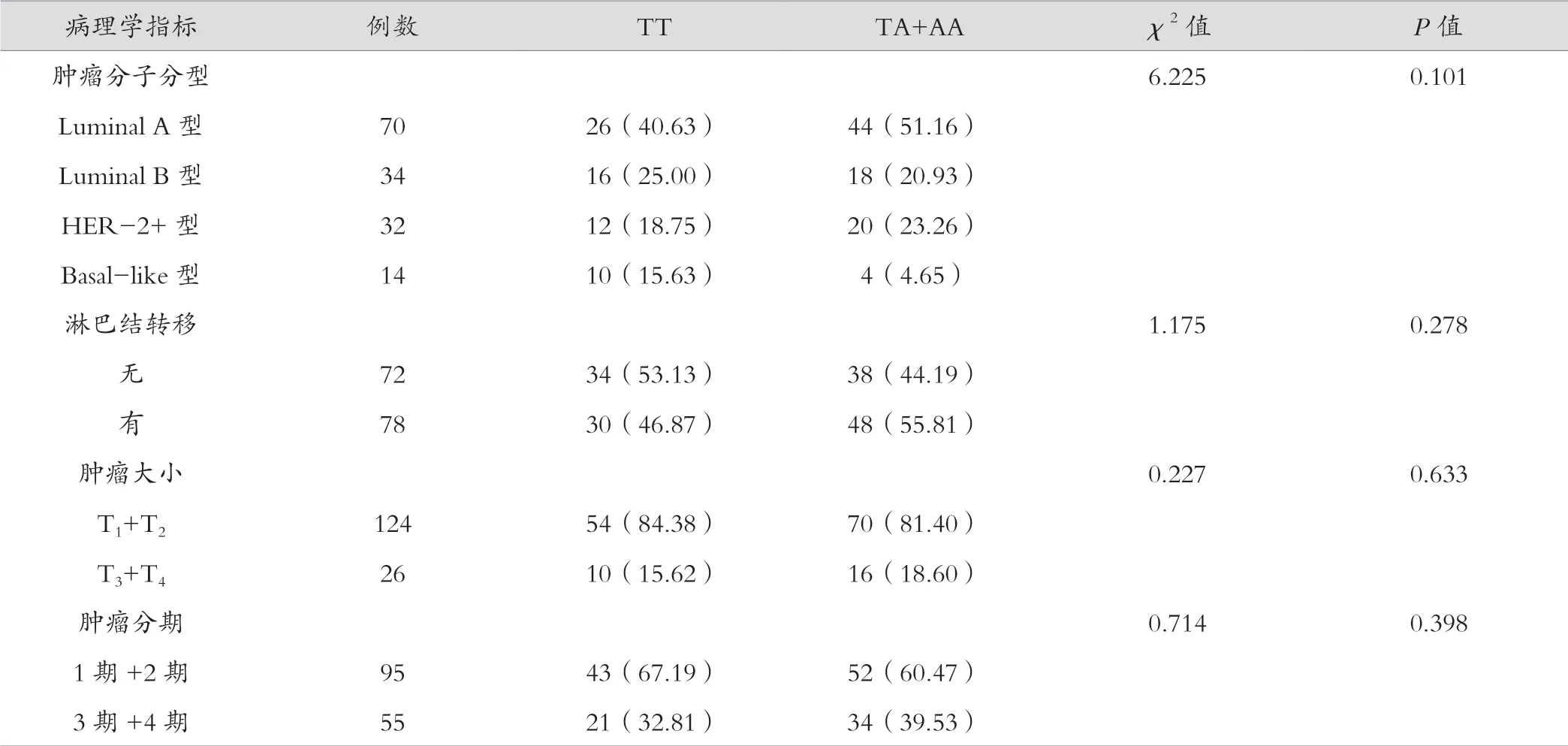
表5 CXCL8 基因多态性与乳腺癌临床病理特征的关系[例(%)]
3 讨论
近年来,全基因组关联性分析(genome-wide association study,GWAS)[14]通过对多种肿瘤进行相关的基因多态性研究,从而发现影响疾病发生、预后及治疗的遗传变异因素。趋化因子属于小型细胞因子样蛋白的超家族,通过与G 蛋白偶联受体相互作用而诱导细胞骨架重新排列和内皮细胞定向迁移,近年来CXCL12/CXCL8 被证实在肿瘤转移模型中显示出有效作用。乳腺癌患者容易发生腋窝淋巴结转移、骨转移、肝转移等,而在皮肤转移、肾转移则较为少见,这种相对特异性的转移方式背后的原因较多,其中“归巢理论”认为人体器官会产生趋化因子,若表达趋化因子受体的癌细胞,在经过富含趋化因子器官的血管壁被捕获并增殖,就会出现组织和器官的特异性转移。作为CC 类趋化因子的一种,CCL2 被认为与乳腺癌恶性程度和病程相关。
既往研究表明,CXCL12 遗传变异与多种恶性肿瘤密切相关,本研究中分析趋化因子CXCL12、CCL2、CXCL8 基因的3 个SNP 位点(rs1 801 157、rs1 024 611、rs4 073)与乳腺癌的关联性。其中CXCL12(rs1 801 157)多态性是研究最多的变异,位于3’非翻译区 801 位点G/A,结果显示,CXCL12 基因GA 型基因频率在两组间差异有统计学意义,进一步分析在超显性模型下,GA 型女性患乳腺癌的风险低于GG 和AA 型(OR=0.589,95%CI:0.369~0.938,P=0.026)。这与LIN 等[15]研究结果相一致。
传统肿瘤解剖病理分期(包括淋巴结转移数目、远处转移情况、肿瘤大小)是临床上较成熟的风险评估指标,在此基础上2011年St.Gallen 国际研讨会[13]将分子分型作为乳腺癌患者的主要治疗方式达成共识。本次在临床病理研究中发现该基因多态性与乳腺癌淋巴结转移、肿瘤大小相关。CXCL8 在人染色体4q13~q21 区域,由4 个外显子、3 个内含子和1 个启动子构成,在炎症和免疫调节方面有重要作用。CXCL8 由中性粒细胞产生,可诱导细胞运动和有丝分裂,促进癌症进展和转移,CXCL8(rs4 073)位于启动子-251 位点A/T,有研究发现[16],CXCL8-251A/T 和+781C/T 多态性与其转录活性有关,影响疾病进展。已有多项研究表明,CXCL8-251A/T 多态性与多种癌症风险相关,如脑胶质瘤、胃癌、前列腺癌等,这可能是因为CXCL8-251A/T 的高蛋白表达与炎性反应相关,长期炎性反应则促进了疾病的发展。CXCL8-251A/T 的A 等位基因与IL-8 的蛋白表达高于T 等位基因相关,本研究发现CXCL8 等位基因A 和T 的频率在两组间有统计学差异(P=0.000),T 基因患乳腺癌的危险度相对较高,但与临床病理特征无相关。
CCL2 由巨噬细胞、成纤维细胞和内皮细胞产生,可刺激单核细胞/ 巨噬细胞和其他炎性细胞趋化,已被证实与癌症风险之间存在相关性。CCL2(rs1 024 611)位于5’端调控区-2518 位点G/A,可以影响血浆CCL2 浓度,被认为是癌症相关危险因素。从过往研究来看,不同种群之间结果差异也较大,同时也受到不同癌种的影响。有研究认为CCL2-2581G/A 在亚洲人中相关性更高,在高加索人种中则不存在相关性。本次研究结果来看,CCL2 基因在不同遗传模型下病例组和对照组间基因型频率的差异均无统计学意义,考虑这种结果差异与人种有关,本研究人群为福建省泉州地区女性,种族之间存在差异性,但是否明确为本原因所致,还需要进一步的实验研究来证实。
综上所述,CXCL12、CXCL8 基因多态性与泉州地区乳腺癌女性患者之间存在一定的相关性,与CCL2 基因则不存在相关性。

