外周血标志物对晚期非小细胞肺癌免疫相关不良反应的预测作用及与生存结局的相关性分析
徐子涵 于国华 聂玉辉 孙蒙蒙 丰慧 刘淑真
肺癌是癌症相关死亡的主要原因[1],非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占80%,大多数在诊断时已发生远处转移。近年来,免疫检查点抑制剂(Immune-checkpoint inhibitors,ICIs)的应用在晚期NSCLC中取得了重大进展,显著改善了晚期NSCLC患者的预后[2-3]。然而,ICIs的治疗过程中可能会出现免疫相关不良反应(immune-related adverse events,irAEs),发生率约为54%~76%[4],大多数irAEs轻度且耐受性良好,但部分起病隐匿,且高致死性的irAEs可能会危及生命,所以早期诊断更具必要性和挑战性。目前尚无明确的生物标志物被证明可以充分预测irAEs的发生,因此,明确irAEs的预测性生物标志物是早期诊断和后续管理的迫切需要。
炎症与多种癌症的发展密切相关,研究显示,一些外周血标志物,如中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)以及乳酸脱氢酶(LDH),可以预测晚期NSCLC及其他肿瘤免疫治疗的临床获益[5-6]。这些外周血标志物通过改变肿瘤微环境使肿瘤细胞发生免疫逃逸,它们既是反应代谢及炎症的指标,又是监测多种实体瘤免疫治疗预后的生物标志物,并通过多种机制在恶性肿瘤进展中发挥重要作用[7-10]。
本研究探究接受ICIs治疗的晚期NSCLC患者中基线外周血标志物(NLR、PLR和LDH)对irAEs的预测价值,及其与生存结局的相关性。
1 资料与方法
1.1 一般资料
回顾性收集2017年1月1日—2021年1月1日期间在潍坊市人民医院接受PD-1/PD-L1抑制剂治疗的晚期NSCLC患者175例,所有患者均按照第8版TNM分期系统进行分期。纳入标准是初次接受PD-1/PD-L1抑制剂治疗、具有完整的随访信息和基线外周血样本检测数据的患者。由于在前12周内发生irAEs的可能性较高,因此纳入研究需要至少3个月的随访时间[11]。本研究已通过潍坊市人民医院伦理委员会批准(批号:2022伦理审批第014号)。
1.2 数据收集
收集患者基线数据,包括性别、年龄、吸烟史、ECOG评分、肿瘤病理类型及分期、基因突变情况、治疗线数以及可用的外周血数据(定义为ICIs治疗开始前1周内的最近一次外周血数据,包括LDH、中性粒细胞绝对值、淋巴细胞绝对值和血小板计数),并计算NLR(中性粒细胞绝对值/淋巴细胞绝对值)和PLR(血小板计数/淋巴细胞绝对值)。记录医师在ICIs治疗期间和治疗后报告的不良事件数据。
1.3 随访
对所有符合入组条件的受试者进行电话随访,随访时间为2017年2月—2022年2月,中位随访时间为16个月,随访时间范围1~35.2个月,随访完成169例,失访6例。参照实体肿瘤疗效评价标准(RECIST)1.1评定疗效[12]。无进展生存期(PFS)定义为从ICIs治疗开始到疾病进展或任何原因死亡的时间。总生存期(OS)定义为从ICIs治疗开始到死亡或最后一次随访的时间。
1.4 统计学分析
使用SPSS 26.0和GraphPad Prism 9.0软件进行统计学分析,患者的临床和人口统计学数据中分类变量的组间比较使用χ2检验和Fisher精确检验,连续变量的组间比较使用t检验。使用ROC曲线确定基线外周血参数的临界值。采用logistic回归分析探讨外周血标志物与irAEs发生的相关性。使用Kaplan-Meier方法绘制PFS和OS曲线,Log-rank检验比较组间差异。Cox回归模型分析与PFS和OS相关的独立指标。P<0.05为差异具有统计学意义。
2 结果
2.1 ICIs治疗的NSCLC患者临床特征
本研究对175例接受ICIs治疗的晚期NSCLC患者进行回顾性分析,排除了6例仅接受1~2个疗程治疗后因各种原因拒绝进一步治疗而未行irAEs评价的患者,最终169例接受免疫治疗的患者入组,其中61例发生irAEs。irAEs组患者的基线外周血NLR、PLR较非irAEs组低,LDH较非irAEs组高(P<0.05)。irAEs组与非irAEs组间其他临床特征无统计学差异(P>0.05)(表1)。
表1 irAEs组与非irAEs组患者基线特征比较
2.2 ICIs治疗的NSCLC患者irAEs的类型
169例晚期NSCLC患者中,irAEs的发生率为36.09%(61/169例),≥2级irAEs占17.75%(30/169例),≥3级irAEs占6.51%(11/169例),因irAEs停止用药的患者占5.33%(9/169例)。研究统计显示,患者首次发生irAEs的中位时间为1.3个月,73.77%(45/61)的患者在给药后2个月内首次发生irAEs。研究期间未发生irAEs相关性死亡事件(表2)。
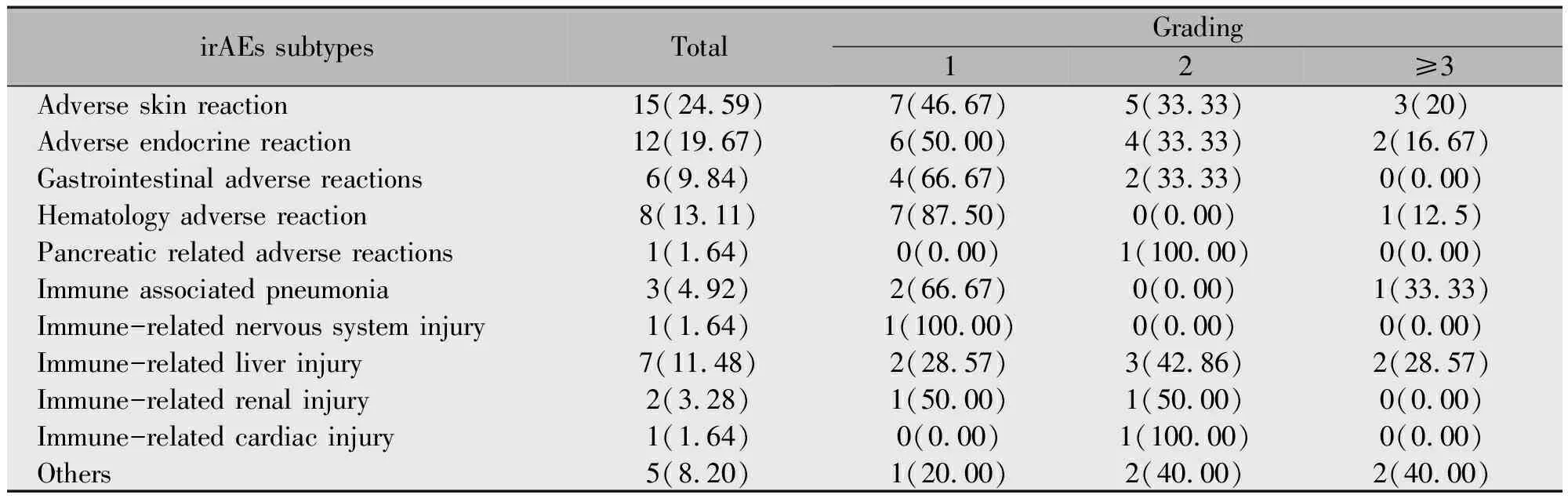
表2 研究人群发生irAEs的类型[n(%)]
2.3 外周血标志物的ROC曲线及临界值
本研究中治疗前NLR预测irAEs发生的临界值为3.18(AUC=0.80,95%CI:0.73~0.87,敏感性为0.79,特异性为0.73)。治疗前PLR预测irAEs发生的临界值为181.56(AUC=0.62,95%CI:0.53~0.71,敏感性:0.57,特异性:0.67)。治疗前LDH对irAEs发生的临界值为209.50(AUC=0.63,95%CI:0.55~0.72,敏感性:0.77,特异性:0.45)(图1)。

图1 NLR、PLR和LDH预测irAEs的ROC曲线
根据NLR<3.18与NLR≥3.18的临界值将患者分为低NLR组(n=77)和高NLR组(n=92),PLR<181.56与PLR≥181.56的临界值将患者分为低PLR组(n=71)和高PLR组(n=98),LDH<209.5与LDH≥209.5的临界值将患者分为低LDH组(n=63)和高LDH组(n=106)。
2.4 irAEs影响因素分析
单因素logistic回归分析表明低NLR(P<0.001)、低PLR(P=0.003)和高LDH(P=0.002)与irAEs发生存在关联。多因素logistic回归分析则表明,低NLR(P<0.001)和高LDH(P=0.007)是irAEs发生的独立危险因素(表3)。
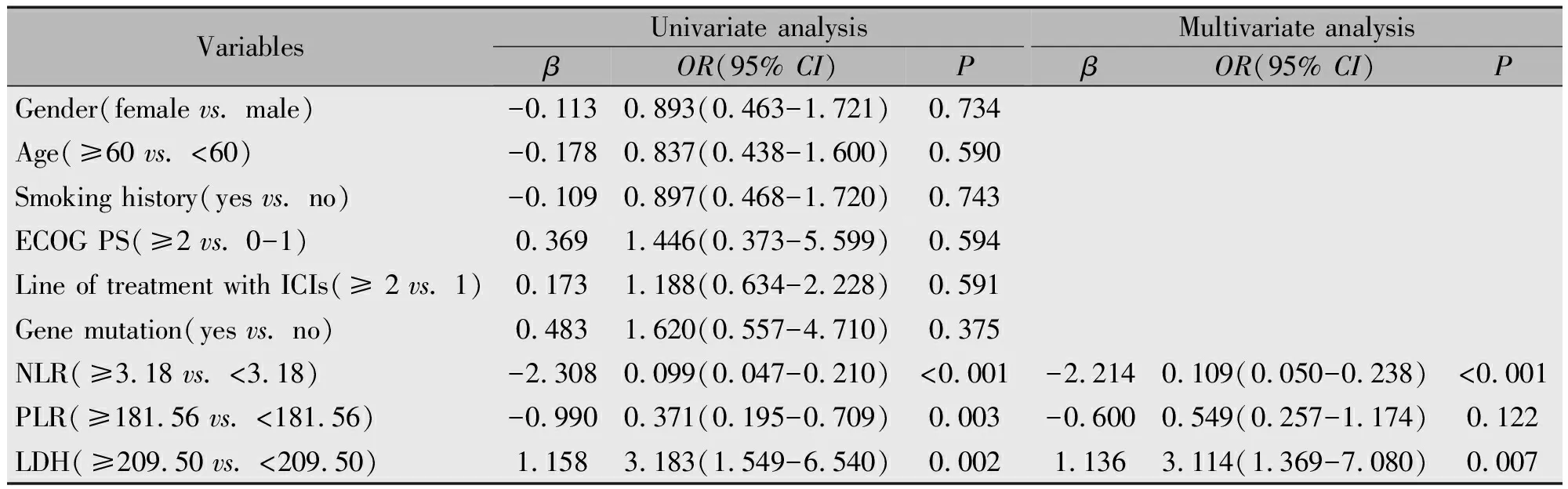
表3 irAEs的影响因素分析
2.5 外周血标志物与晚期NSCLC患者预后的关系
多因素Cox回归分析结果显示,高NLR、高PLR、高LDH是晚期NSCLC患者PFS和OS的独立危险因素(P<0.05)(表4)。

表4 晚期NSCLC患者PFS影响因素的Cox回归分析
Kaplan-Meier生存曲线分析结果显示,低NLR组患者的中位PFS为12.0个月(95%CI:10.59~13.41),中位OS为19.3个月(95%CI:17.45~21.15);高NLR组患者的中位PFS为8.0个月(95%CI:7.03~8.97),中位OS为15.0个月(95%CI:13.46~16.54);低PLR组患者的中位PFS为12.0个月(95%CI:9.20~14.80),中位OS为21.0个月(95%CI:17.99~24.01);高PLR组患者的中位PFS为8.0个月(95%CI:6.79~9.21),中位OS为15.2个月(95%CI:13.65~16.75);低LDH组患者的中位PFS为11.0个月(95%CI:9.02~12.98),中位OS为21.0个月(95%CI:16.92~25.08);高LDH组患者的中位PFS为8.2个月(95%CI:7.13~9.27),中位OS为16.0个月(95%CI:14.43~17.57)。Kaplan-Meier生存分析表明,低NLR组、低PLR组和低LDH组的PFS及OS均显著优于高NLR组、高PLR组和高LDH组(图2)。

表5 晚期NSCLC患者OS影响因素的Cox回归分析

图2 Kaplan-Meier生存曲线分析NLR、PLR、LDH与PFS及OS的关系
3 讨论
近年来,以ICIs为代表的免疫治疗在晚期NSCLC中取得了重大进展,然而,ICIs的治疗过程中可能会出现irAEs,部分起病隐匿且高致死性的irAEs可能会危及生命,这使得早期诊断更具必要性和挑战性。因此,明确irAEs发生的预测性指标至关重要,从而筛选高危人群,以进一步优化患者的获益并最大程度降低毒性风险。
据报道,irAEs的类型及其发生率因种族和癌症类型而异[13-14],通常难以准确预测irAEs的发生,难以达到早筛查早发现的目的。本研究发现irAEs组的NLR、PLR显著低于非irAEs组,而LDH高于非irAEs组,临界值分别为3.18、181.56及209.5。进一步经多因素logistic回归分析表明,低NLR和高LDH是irAEs发生的独立危险因素。这与Pavan等[15-16]的结果一致,他们的研究表明NLR<3是发生irAEs的独立危险因素,在这些研究中,研究者根据既往已发表的关于NLR与实体瘤预后和ICIs治疗结果之间关联的研究设置了NLR的临界值,然而并未具体计算上述指标与irAEs发生发展之间的临界值。研究表明,炎症与多种癌症的发展密切相关,中性粒细胞及血小板通过作用于肿瘤细胞和肿瘤微环境来促进肿瘤发展[7-8],而淋巴细胞参与抗肿瘤免疫反应并抑制肿瘤细胞的生长[9],LDH是参与肿瘤代谢的关键酶,通过改变肿瘤微环境来协助肿瘤细胞抑制和逃避免疫系统[10]。基于这些结果,我们推测NLR、LDH通过改变肿瘤微环境从而影响肿瘤患者对ICIs的反应,是预测irAEs的重要因素。
本研究中,低NLR组、低PLR组和低LDH组的PFS及OS均显著优于高NLR组、高PLR组和高LDH组,并且证实了高NLR、高PLR和高LDH是与PFS及OS相关的独立危险因素。Capone等[17]证实了NLR可以预测接受ICIs治疗的晚期黑色素瘤患者的OS,另外,Guida等[18]证实了较高的基线LDH、NLR、PLR值与经ICIs治疗的BRAF野生型晚期黑色素瘤患者较差的预后相关。同样,本研究显示较高的NLR、PLR和LDH与较差的OS和PFS相关。
本研究中评估的外周血标志物(NLR、PLR、LDH)很好地反映了炎症状况,同时,常规外周血液学检查具有成本低、易获得的特点,基线血液学检查可用作及时识别irAEs发生的便捷工具,这对于降低免疫治疗患者的治疗成本以及不良事件发生风险至关重要。另外,本研究是一项在单中心进行的小型回顾性研究,存在一定的局限性,并且可能受到回顾性研究本身的内在选择偏倚的影响,因此需要更大规模的多中心前瞻性研究进一步证实。但本研究为晚期NSCLC患者ICIs治疗的临床实践提供了一些参考,为irAEs分子机制和潜在生物标志物的揭示和识别过程提供思路,并为ICIs治疗的抗肿瘤反应和irAEs的临床管理提供宝贵意见。

