胃癌相关癌睾抗原筛选与免疫浸润分析
杨菊 刘芹 刘宝瑞 魏嘉
我国胃癌的发病率和死亡率均居于恶性肿瘤的前三位[1]。目前免疫治疗主要包括免疫检查点抑制剂及免疫细胞治疗两大类。随着免疫治疗的发展,2021年CheckMate-649结果的发布,确立了晚期胃癌一线治疗的新标准,PD-1抗体联合化疗实现了胃癌全人群的全面获益,但患者的中位生存期仍只有14个月左右[2],晚期胃癌仍面临预期生存短、一线治疗失败后缺乏有效治疗手段的挑战。2021年ESMO发布了CLDN18.2靶向嵌合抗原受体T(Chimeric antigen receptor T-cell,CAR-T)细胞后线(既往≥2线)治疗胃癌的数据,客观缓解率高达61.1%[3]。寻找肿瘤高度特异的靶点设计CAR-T细胞、TCR-T细胞或肿瘤疫苗是改善胃癌患者预后的策略之一。癌睾抗原是在生理情况下选择性地表达在免疫豁免器官的一系列蛋白,通常表达在生殖细胞及胎盘的滋养层细胞,病理情况下在多种肿瘤中高表达[4-5]。在功能上,癌睾抗原能够促进肿瘤的增殖与侵袭,还具有免疫原性与表达的选择性,是肿瘤免疫治疗的潜在靶点。同时癌睾抗原与肿瘤突变负荷及CD4+/CD8+T细胞免疫反应密切相关,还能作为免疫治疗疗效的预测靶点[6]。以癌睾抗原为基础设计的免疫治疗手段包括肿瘤疫苗、TCR-T细胞及CAR-T细胞治疗,相关临床试验正在开展。
目前关于胃癌癌睾抗原的研究多是针对特定或部分基因的[7],尚无研究系统性地分析癌睾抗原在胃癌中的表达及对预后和免疫微环境的影响。本研究拟利用TCGA数据库筛选胃癌正常组织与肿瘤组织的差异表达基因,结合数据库CTdatabase,选取差异表达的癌睾抗原,分析其对胃癌预后和免疫微环境的影响,为胃癌的免疫治疗与靶点的寻找提供依据。
1 材料与方法
1.1 数据收集
利用R软件(版本4.0.2),通过TCGAbiolinks包中的TCGAanalyze_DEA函,从TCGA(https://portal.gdc.cancer.gov)数据库下载32例胃癌癌旁组织和375例胃癌肿瘤组织样本的mRNA表达数据,下载与之对应的患者临床信息以做预后分析。利用DESeq2数据包进行差异表达分析,当P<0.05且|LogFC|>1时则被定义为差异表达基因。
1.2 差异表达且诱导免疫反应的癌睾抗原的筛选
在数据库CTdatabase中选取已有文献证实的能够诱导免疫反应(体液免疫或细胞免疫)的癌睾抗原,并与TCGA数据库中胃癌中的差异表达基因进行比对,选取差异表达的能够诱导免疫反应的癌睾抗原。
1.3 差异表达的癌睾抗原在胃癌中的生存分析
因低表达基因难以作为治疗靶点,故将上述在肿瘤组织中显著高表达且具有功能的癌睾抗原结合患者临床生存信息,通过Kaplan-Meier分析,筛选与胃癌患者预后相关的癌睾抗原。并利用Cox回归模型进行相关基因表达与患者生存的多因素及单因素分析。
1.4 免疫浸润分析
将上述筛选得到的基因表达矩阵输入CIBERSORT分析系统,分析相关基因与肿瘤中的不同免疫细胞浸润之间的关系。
1.5 统计分析
本研究的数据统计分析均使用R软件(版本4.0.2),使用Kaplan-Meier法绘制生存曲线,Log-rank检验比较组间生存曲线差异。P值多重检验校正采用Benjamini&Hochberg(BH)方法,P<0.05为差异具有统计学意义。
2 结果
2.1 诱导免疫反应的差异表达癌睾抗原筛选
通过TCGA数据库,共筛选出5 514个差异表达基因(图1)。CTdatabase中目前已纳入癌睾抗原218个,其中能诱导体液免疫或者细胞免疫的癌睾抗原有94个,将其与胃癌差异表达基因进行比对,共获得33个具有诱导免疫反应功能的差异表达癌睾抗原。
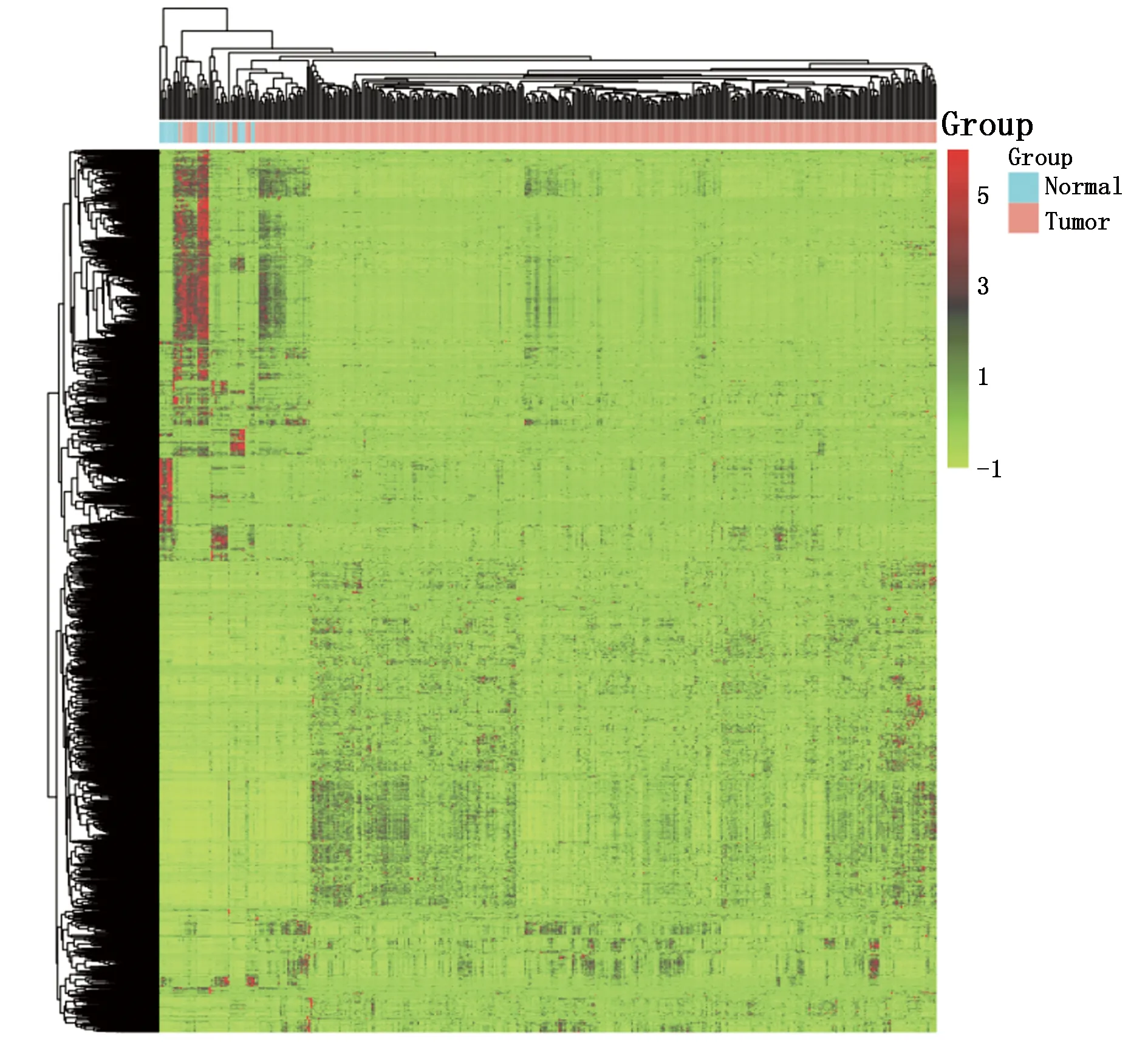
图1 胃癌正常组织与肿瘤组织中的表达差异基因
ARMC3、CDCA1、CEP55、CSAG2、CT45A1、CTAG2、CTCFL、CXorf61(KK-LC-1)、DDX53、IGF2BP3、MAGEA1、MAGEA10、MAGEA12、MAGEA3、MAGEA4、MAGEA6、MAGEC1、MAGEC2、KIF2C、MPHOSPH1、PLAC1、PRAME、SAGE1、SEMG1、SPAG17、SSX1、TTK在胃癌肿瘤组织中较正常组织高表达,且在文献中被证实具有诱导免疫反应的能力。与正常组织相比,BAGE2、CCDC110、SPAG4、SPAG8、IGSF11、MAGEB2在胃癌肿瘤组织中表达较低(图2)。
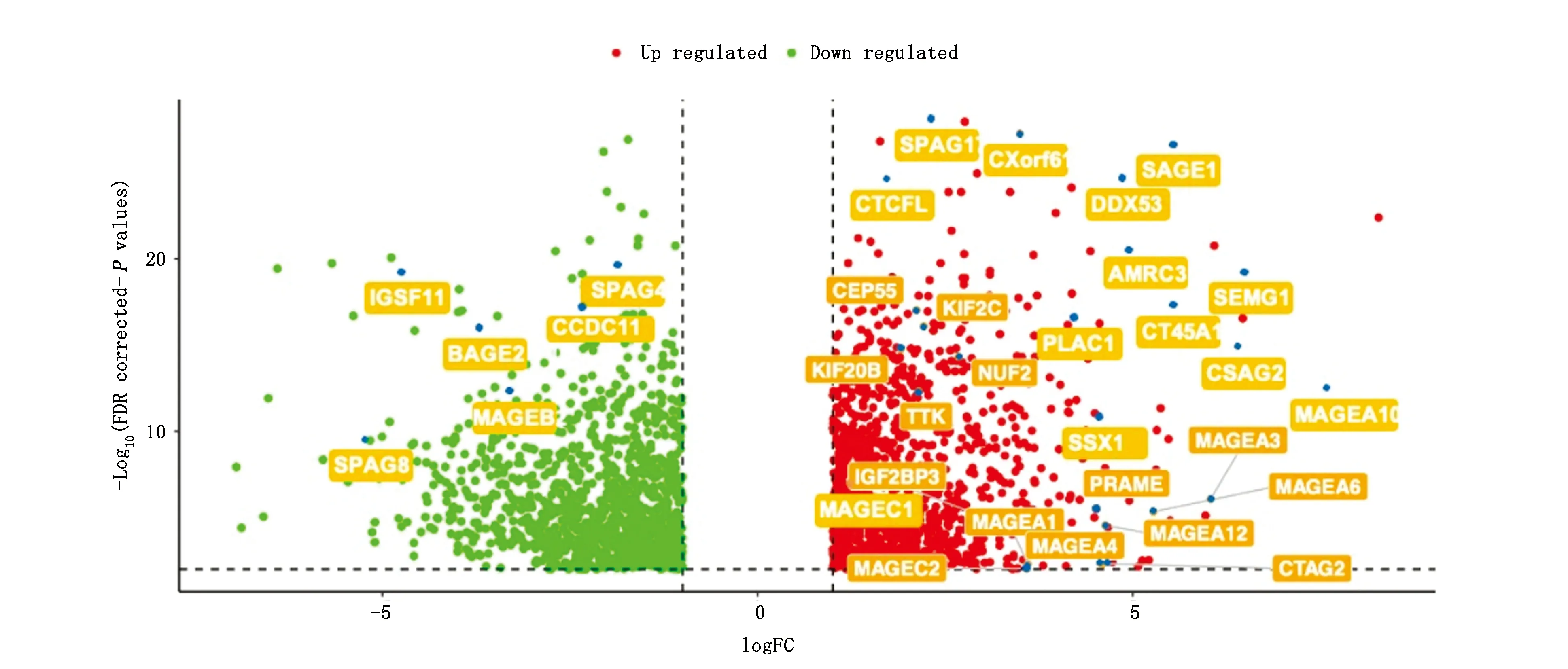
图2 有诱导免疫反应功能且表达差异的癌睾抗原
2.2 高表达癌睾抗原与胃癌患者生存分析
将在肿瘤组织中高表达的癌睾抗原与胃癌患者的生存信息进行分析,发现CEP55、MAGEA10、MAGEA12、MAGEA3、MAGEC1、PLAC1高表达与胃癌患者较短生存时间显著相关(P<0.05)。MAGEA4、MAGEA6、SAGE1高表达胃癌患者有较短生存趋势,但无统计学意义(P>0.05)。CXorf61(KK-LC-1)、KIF2C、MPHOSPH1的高表达与胃癌患者的较长生存期显著相关(P<0.05)(图3)。利用Cox回归模型对相关基因与患者生存进行多因素分析,结果提示CEP55与患者较短生存显著相关(HR=1.463,95%CI:1.007~2.126,P=0.046)(表1)。
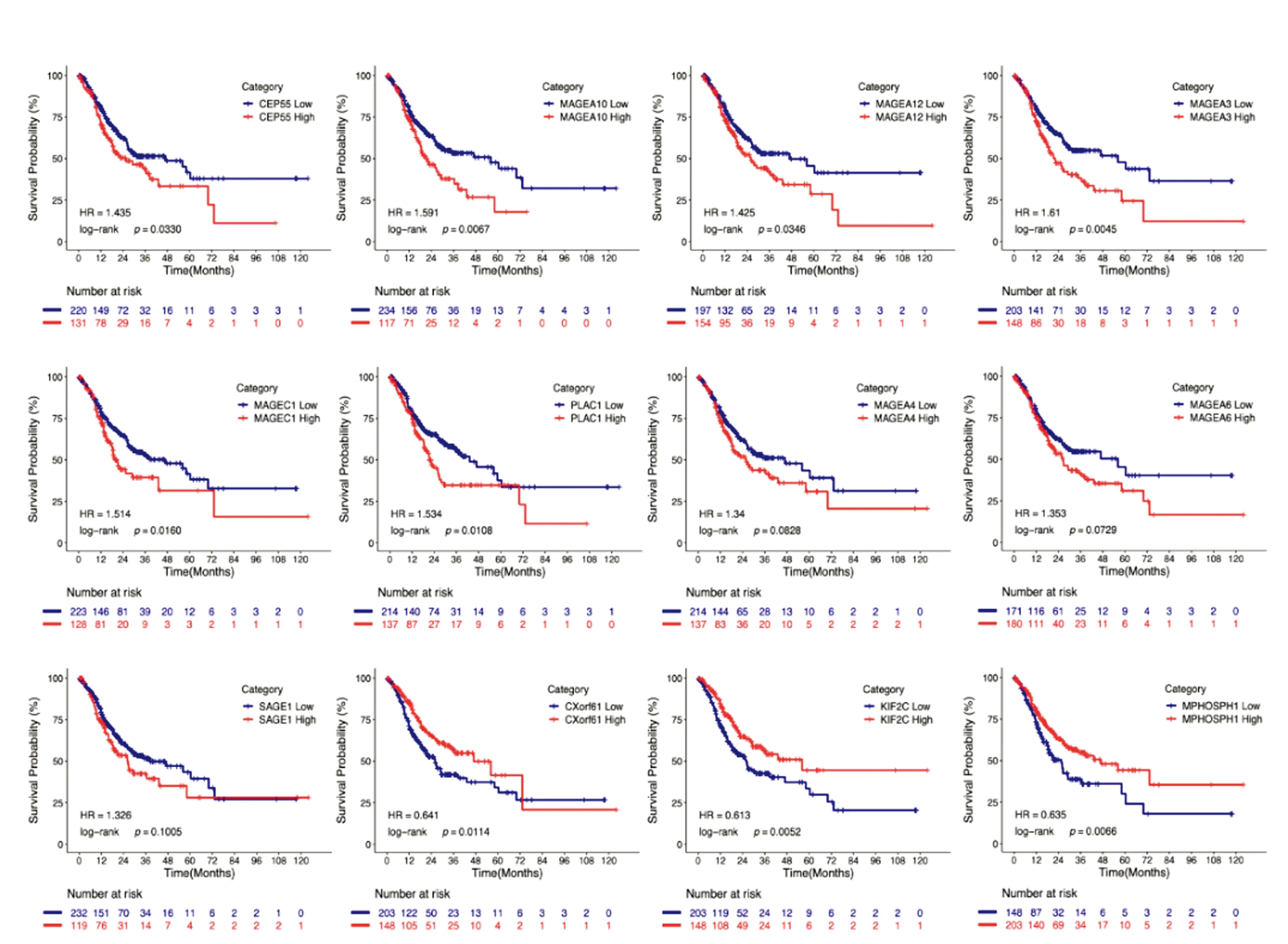
图3 高表达癌睾抗原与胃癌患者生存曲线

表1 相关基因与患者生存的Cox回归分析
2.3 高表达癌睾抗原与胃癌肿瘤组织免疫细胞浸润
以肿瘤组织的表达水平中位数为分界,高于等于此则定义为高表达,低于此则定义为低表达。肿瘤组织中高表达的癌睾抗原与胃癌组织免疫细胞浸润的潜在关联分析发现CEP55、MAGEA10、MAGEA12、MAGEA3、MAGEC1、PLAC1高表达与胃癌组织中较多的具有抗肿瘤功能的M1型巨噬细胞浸润相关(P<0.05)(图4)。
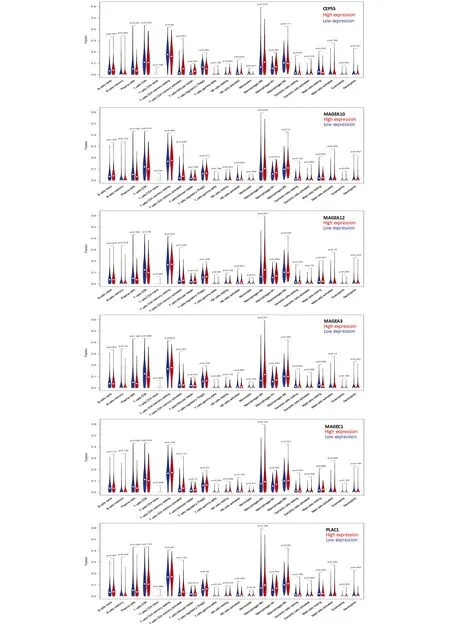
图4 胃癌组织中高表达癌睾抗原与肿瘤免疫细胞浸润关系
3 讨论
目前仅有部分癌睾抗原的功能得到了研究,本研究从胃癌与癌旁正常组织表达差异的基因中筛选出33种具有诱导免疫反应功能的癌睾抗原,其中有27种癌睾抗原在肿瘤组织中高表达,而剩余6种在正常组织中高表达。本研究为免疫治疗靶点的筛选提供了基础。
以癌睾抗原为基础的免疫治疗模式包括肿瘤疫苗和过继性T细胞回输技术。肿瘤疫苗通过表达特异性的、具有免疫原性的肿瘤抗原,在细胞因子或者趋化因子等佐剂的辅助下,激活机体抗肿瘤免疫,从而杀伤肿瘤细胞[8]。癌睾抗原在恶性肿瘤中表达率高,基于癌睾抗原设计的肿瘤疫苗具有适用范围广、无需测序的特点,节省了时间及经济成本,比如MAGEA1、MAGEA3、NY-ESO-1等都有相关肿瘤疫苗的设计和临床试验开展。本研究发现MAGEA3在胃癌肿瘤组织中高表达且与较短的生存时间显著相关。现有研究在动物实验中证实MAGEA3疫苗能够在胃癌中诱导抗肿瘤免疫反应,但目前尚无临床试验开展[9]。在黑色素瘤中开展的关于MAGEA3疫苗的Ⅰ/Ⅱ期临床试验(NCT00086866),入组的患者中能检测到MAGEA3抗体及CD4+和CD8+T细胞反应[10]。但后续随机对照的Ⅱ/Ⅲ期临床试验结果均不理想[11-12]。与MAGEA3疫苗研究的结果相似,NY-ESO-1单抗原疫苗虽然也被证实能够诱导抗肿瘤免疫反应,但相关的Ⅱ期临床试验(NCT00199901)结果却是阴性的。上述结果提示单一抗原的肿瘤疫苗往往难以转化为临床获益,多种抗原覆盖的疫苗设计有望成为解决该难题的策略之一。本研究发现多种癌睾抗原在胃癌中高表达且与免疫细胞浸润相关,以此为基础设计多种抗原涵盖的疫苗是否有望改善患者生存值得进一步研究。
经基因工程编辑的T细胞治疗技术主要包括TCR-T细胞及CAR-T细胞治疗。以MAGE-A家族抗原为靶点,已有多种相关临床试验数据发布。一项Ⅰ期临床试验设计了靶向MAGEA3的TCR-T细胞,17例晚期恶性肿瘤患者接受治疗后1例完全缓解,3例部分缓解[13]。以MAGEA4为靶点的TCR-T细胞在Ⅰ期临床试验中取得了显著的效果。本研究发现MAGEA4在胃癌组织中高表达,且与不良预后有相关趋势。与肿瘤疫苗的设计思路类似,TCR-T细胞设计也通过涵盖多靶点进行优化,这些靶点包括NY-ESO-1、MAGEA1、MAGEA4、PRAME、Survivin和SSX2等[6]。本研究也发现PRAME在胃癌组织中呈高表达状态,提示PRAME也可能成为胃癌免疫治疗的潜在靶点。在急性髓系白血病中现已有靶向PRAME的CAR-T细胞设计。
本研究发现CEP55、MAGEA10、MAGEA12、MAGEA3、MAGEC1、PLAC1高表达与胃癌患者的较短生存显著相关。多个数据库已证实CEP55在多个癌种中呈高表达且和患者预后较差相关。CEP55过表达与PI3K通路的活化、肿瘤的发生发展密切相关,是肿瘤治疗的潜在靶点[14]。靶向MAGEA4的TCR-T细胞治疗已初见成效,MAGEA10与MAGEA4的序列有较多的重叠之处,因此部分靶向MAGEA10的特异性免疫细胞临床试验项目已暂停[15]。与本研究的发现相似,MAGEC1在结肠癌中也呈现高表达,并且与结肠癌患者的较短生存相关[16]。外周血中MAGEC1/PRAME蛋白的表达还能起到多发骨髓瘤疾病监测的作用[17]。PLAC1的高表达与结肠癌、宫颈癌患者的较差预后相关,并且可以通过上皮间质转化促进肿瘤细胞的侵袭[18-19]。
本研究进一步发现CEP55、MAGEA10、MAGEA12、MAGEA3、MAGEC1、PLAC1高表达还与肿瘤免疫微环境中具有抗肿瘤能力的M1型巨噬细胞浸润比例呈正相关。抗肿瘤免疫反应包括抗原释放和递呈、活化免疫细胞、免疫细胞归巢杀伤肿瘤细胞等环节。巨噬细胞在肿瘤微环境中可以极化为两种状态:M1型能呈递肿瘤抗原、募集和活化免疫细胞,表达iNOS、ROS及IL-12,发挥抗肿瘤作用;M2型能够清除坏死组织、修复组织损伤、促进血管生成和组织重构,发挥肿瘤抑制作用[20]。上述6种癌睾抗原与肿瘤组织中的M1型巨噬细胞浸润呈正相关,提示其免疫原性是后续免疫治疗设计的潜在靶点。
本研究仍存在不足之处,未在我中心的胃癌肿瘤组织中进一步验证上述基因的表达,尚无免疫反应功能的验证,在后续的研究中将不断完善,进一步深化。综上,本研究筛选出具有诱导免疫反应的在胃癌组织中高表达的癌睾抗原,并进一步分析这些基因和胃癌患者生存的相关性。本研究为胃癌中免疫治疗的靶点寻找提供了依据。

