3种医院制剂的微生物限度方法验证
王一帆,夏 伟,贺 娟,李 春,陈 婷**
(1.昆明医科大学 药学院,云南 昆明 650000;2.中国人民解放军联勤保障部队第九二〇医院 药剂科,云南 昆明 650000;3.贵州医科大学神奇民族医药学院 药学系,贵州 贵阳 550000)
10%鱼肝油软膏、复方薄荷脑滴鼻剂和10%氯化钾溶液均收载于《解放军医疗机构制剂规范》(2015年版)。10%鱼肝油软膏主要功效是营养、润滑、保护和有助于肉芽组织生长,能促进烫伤、溃疡的伤口愈合,临床上用于改善慢性皮肤结核、外伤、烧烫伤、皲裂、鱼鳞病、溃疡及皮肤干燥等。复方薄荷脑滴鼻剂具有润湿和保护鼻腔黏膜、促进黏膜血液循环、刺激鼻腔黏膜细胞的再生功能的作用,临床上用于治疗干燥性鼻炎、萎缩性鼻炎、慢性鼻窦炎及过敏性鼻炎诱发的鼻腔黏膜糜烂。10%氯化钾溶液主要治疗低钾血症及洋地黄中毒引起的心率失常。
医院制剂是根据医院临床需要,由本单位配置的固定处方制剂,具有配置量少、使用周期短、能满足临床治疗需要、提高医院效益、推进合理化用药等优势。医院制剂要确保其质量稳定,其中的微生物限度检查就是制剂安全性检查的重要指标[1-2]。
为了确保建立的微生物方法适用于这3种医院制剂,现按照 2020 年版《中华人民共和国药典》第四部的要求,建立了10%鱼肝油软膏,复方薄荷脑滴鼻剂和10%氯化钾溶液的微生物计数法和控制菌检查法,并进行了方法适用性验证[3-5]。
1 微生物限度方法建立
1.1 仪器
洁净工作台(苏净集团安泰公司);HPX-9082MBE电热恒温培养箱(上海博讯实业有限公司医疗设备厂);MSL.N蒸汽灭菌器(威海威高海盛医用设备有限公司);ME55/02型分析天平(梅特勒托利多仪器(上海)有限公司,精度为十万分之一)
1.2 试药
10%鱼肝油软膏(批号为201105、201230、210201,规格均为 20 g/盒),复方薄荷脑滴鼻剂(批号210706、210915、211116),10%氯化钾溶液(批号210518、210804、211018),均由解放军联勤保障部队第920医院所提供。
1.3 培养基
pH7.0氯化钠-蛋白胨缓冲液(Lot:317N031)、胰酪大豆胨液体培养基(Lot:108675)、胰酪大豆胨琼脂培养基(Lot:1090411)、甘露醇氯化钠琼脂培养基(Lot:1082136)、溴化十六烷基三甲基铵琼脂培养基(Lot:1081174)、沙氏葡萄糖琼脂培养基(Lot:1090021)、麦康凯琼脂培养基(Lot:108T031)、麦康凯液体培养基(Lot:317E031),生产厂家均为广东环凯微生物科技有限公司。
1.4 菌种
①白色念珠菌[CMCC(F)98001];②枯草芽孢杆菌[CMCC(B)63501];③黑曲霉[CMCC(F)98003];④铜绿假单胞菌[CMCC(B)10104];⑤金黄色葡萄球菌[CMCC(B)26003];⑥大肠埃希菌[CMCC(B)44102]。均由广东环凯微生物科技有限公司提供。
1.5 方法
1.5.1 溶液制备
1)菌液制备
按2020版《中华人民共和国药典(四部)》通则1105项下方法制备菌液[6]。
2)供试液制备
10%氯化钾溶液供试品的制备:取10%氯化钾溶液 10 mL,加入pH7.0无菌氯化钠-蛋白胨缓冲液中(不超过 40 ℃)100 mL,混匀,制成 1∶10(体积比)的供试液;
10%鱼肝油软膏供试品的制备:取10%鱼肝油软膏 10 g,加入 20 mL 无菌十四烷基异丙酯和无菌玻璃珠的三角瓶中,振摇,混匀。再加入pH7.0无菌氯化钠-蛋白胨缓冲液(45 ℃)100 mL,振摇,混匀,然后倒入分液漏斗中,静置一段时间,待油水分层后,取水层作为1∶10的供试液[7]。
复方薄荷脑滴鼻液供试品的制备:取复方薄荷脑滴鼻液 10 mL,加入 10 mL 无菌十四烷基异丙酯溶液和无菌玻璃珠到三角瓶中,振摇,混匀。再加入pH7.0无菌氯化钠-蛋白胨缓冲液(45 ℃)100 mL,振摇,混匀,然后倒入分液漏斗中,静置一段时间,待油水分层后,取水层作为1∶10的供试液。
1.5.2 细菌、霉菌和酵母菌总数计数方法适用性试验
试验组:取1.5.1中2)项下的供试液 9.9 mL,每批5份,每份加入铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念球菌及黑曲霉菌的菌液 0.1 mL,使供试液每 1 mL 含菌量不大于 100 CFU。混匀,吸取各染菌供试液 1 mL,分别注入平皿中,倾注胰酪大豆胨琼脂培养基,每份平行制备2个平板,待凝固后,35 ℃ 培养 3 d,测定需氧菌总数;取1.5.1中2)项下的供试液 9.9 mL,每批2份,每份加入白色念珠菌、黑曲霉菌菌液 0.1 mL,使供试液每 1 mL 含菌量不大于 100 CFU。混匀,吸取各染菌供试液 1 mL 注入平皿中,倾注沙氏葡萄糖琼脂培养基,每份平行制备2个平板,待凝固后,25 ℃ 培养 5 d,测定霉菌及酵母菌总数[8-15]。
阳性对照组:用pH7.0氯化钠-蛋白胨缓冲液代替供试液,同试验组操作。
供试品组:用pH7.0氯化钠-蛋白胨缓冲液代替菌液,同试验组操作。
稀释剂组:用pH7.0氯化钠-蛋白胨缓冲液代替供试液、菌液,同试验组操作。
验证试验分3次独立完成,各试验组分别采用上述方法平行做3次。
计算: 细菌、霉菌和酵母菌总数的回收率
计算公式:回收比值=(试验组平均菌落数-供试品组平均菌落数)/阳性对照组的平均菌落数。
1.5.3 控制菌检查方法适用性
根据2020版药典四部通则1107规定,皮肤给药制剂的控制菌为金黄色葡萄球菌、铜绿假单胞菌,鼻用制剂的控制菌为金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌,口服制剂控制菌为大肠埃希菌[6-15]。
1)金黄色葡萄糖球菌
试验菌组:取1.5.1中2)项下的1∶10的供试液 10 mL 两份,分别加入含菌量不大于 100 CFU 的金黄色葡萄球菌菌液及含菌量不大于 100 CFU 大肠埃希菌菌液,混匀。加入胰酪大豆胨液体培养基 100 mL 中,35 ℃ 培养 24 h。
阳性对照组:用pH7.0氯化钠-蛋白胨缓冲液代替供试液,同试验组操作。
供试品组:用pH7.0氯化钠-蛋白胨缓冲液代替菌液,同试验组操作。
阴性对照组:用pH7.0氯化钠-蛋白胨缓冲液代替供试液、菌液,同试验组操作。
选择与分离培养:取上述试验中的液体培养基,接种到甘露醇氯化钠琼脂培养基平板上,再在 35 ℃ 的恒温培养箱里培养 24 h。
结果判断:在平板上,如果没有金黄色葡萄糖球菌菌落的特征,则判定为未检出,且大肠埃希菌在甘露醇氯化钠琼脂培养基平板上不生长。
2)铜绿假单胞菌
用铜绿假单胞菌替代1.5.3中1)项中的金黄色葡萄球菌,分组和操作同1.5.3中1)项金黄色葡萄糖球菌的操作。
选择与分离培养:取上述试验中的液体培养基,划线到溴化十六烷基三甲铵琼脂培养基平板上,再在 35 ℃ 的恒温培养箱里培养 24 h。
氧化酶试验:将无菌的滤纸片放在平皿上,用玻璃棒在上述平板蘸取生长的菌落涂于滤纸片上,随后滴加2滴的新配制的1%二盐酸N,N-二甲基对苯二胺试液,若在 30 s 内培养物变成粉红色并且逐渐变紫红色,则可以判定为氧化酶试验阳性,反之则为阴性[16]。
结果判断:如果未出现铜绿假单胞菌的特征,则判定为未检出,且大肠埃希菌在溴化十六烷基三甲铵琼脂培养基平板上不生长。
3)大肠埃希菌
试验菌株组:取1.5.1中2)项下的1∶10的供试液 10 mL 两份,分别加入含菌量不大于 100 CFU 的大肠埃希菌的菌液及含菌量不大于 100 CFU 金黄色葡萄球菌的菌液,混匀。加入胰酪大豆胨液体培养基 100 mL 中,35 ℃ 培养 24 h。
选择与分离培养:取上述培养物 1 mL 接种至 100 mL 麦康凯液体培养基中,42~44 ℃ 培养 24~48 h。金黄色葡萄球菌接种到麦康凯液体培养基上,不生长。取麦康凯液体培养基培养物划线接种于麦康凯琼脂培养基平板上,35 ℃ 培养18~72 h。
结果判断:如果未出现大肠埃希菌的特征,则判定为未检出,且金黄色葡萄球菌在麦康凯琼脂培养基平板上不生长。
1.5.4 细菌、霉菌和酵母菌总数计数方法适用性试验结果
细菌、霉菌和酵母菌的回收率均在0.5~2.0之间,同时稀释剂组无菌生长,说明方法可行(见表1、表2)。
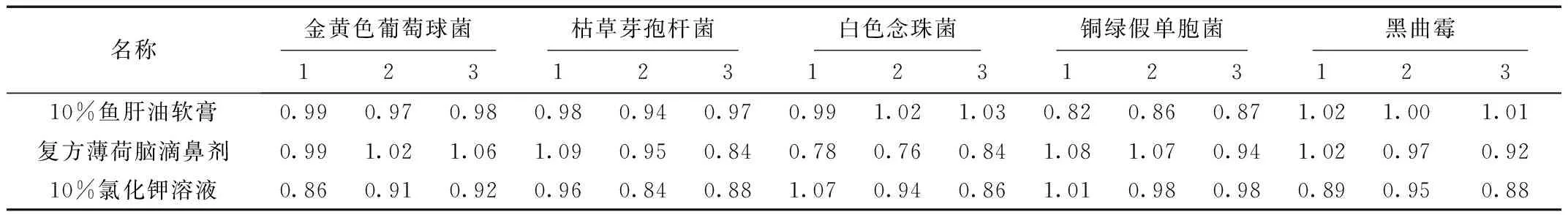
表1 需氧菌总验证回收比值
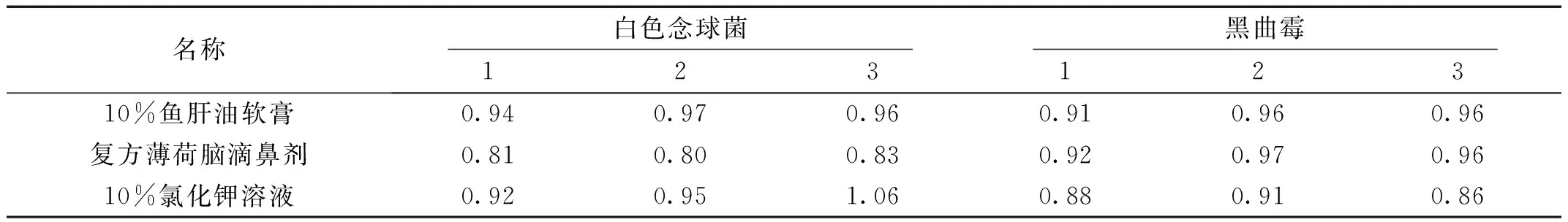
表2 霉菌和酵母菌验证回收比值
1.5.5 控制菌检查方法适用性结果
在控制菌检查方法适用性试验中,试验组能够检出所加试验菌相应反应特征,同时阴性对照均无菌生长,说明方法可行(见表3)。

表3 控制菌检查结果
2 讨论
药品检验是保障药品质量和安全性的重要关卡,微生物检验又是其中一项重要措施。本研究建立了10%鱼肝油软膏、复方薄荷脑滴鼻剂和10%氯化钾溶液的微生物限度检查方法。针对不同制剂类型采用不同的试验方法,能精准消除一些干扰因素,使操作简捷,结果精确,提高了医院制剂的检测质量,也为相似制剂的微生物限度检查方法适用性试验提供了参考。
微生物污染,会造成制剂的变质、失效,甚至会产生毒性。而污染原因可能有以下几种情况:①原料药:一般购入的原料药都是符合规定的,但不能排除在运输、储存时污染;②操作环境及操作人员的卫生情况;③容器及包材。通过微生物限度检查,严格控制院内制剂的质量安全,加强医院制剂生产各个环节的管控,从根源上避免污染的情况,确保医院制剂的疗效和用药安全。
3 结语
本试验中测需氧菌、霉菌及酵母菌总数的验证时采用1∶10的供试液加菌回收比值均落在0.5~2.0的范围内,测控制菌的检测方法验证时,试验组和菌液组对应菌株生长良好,阴性对照组、供试品组和试验菌株组无菌生长,故这3种医院制剂都采用常规法进行检验。2020版《中华人民共和国药典》对的油脂类供试品的处理方法是取供试品,添加灭菌的十四烷酸异丙酯。十四烷基异丙酯满足药典要求,能溶解分散疏水性的制剂,且本身没有抑菌活性,还能消除制剂中的一些抑菌成分。这种化学助溶方法,较水浴加热助溶法更易操作,步骤简单。所以在本试验中,10%鱼肝油软膏和复方薄荷脑滴鼻剂的供试品处理中,都加入了十四烷酸异丙酯。前处理中,还用到了无菌玻璃珠让溶液混合得更加均匀,加上分液漏斗的萃取,使供试品提取得更加完全。这些创新的处理方法为供试品处理方法提供了新思路,找寻高效简便及符合药典规定的试验方法是很有必要的。

