三白草多糖微波提取工艺优化及降糖活性研究*
苏才美,文 瑶
(广东药科大学 药学院,广东 广州 510006)
三白草(Saururuschinesis(Lour.)Baill)是三白草科多年生草本植物,味甘、辛,性寒,有着清热解毒、利尿消肿等功效[1]。三白草药理作用包括抗炎、抗氧化、降血糖及抗肿瘤活性等[2,3],化学成分为多糖、挥发油、木脂素、生物碱和黄酮类化合物等[4]。文献报道,三白草提取物均具有一定的α-葡萄糖苷酶抑制活性[5]。三白草作为中药材之一,但对其的研究与其他药材相比较少,其药理作用的研究还有待发展。因此,为了提高三白草多糖的提取率,本文采用微波辅助水提法提取三白草多糖,响应面法优化其提取条件。多糖粗品经DEAE和G-75柱纯化获得三白草多糖。通过α-葡萄糖苷酶的抑制实验评估三白草多糖的降血糖能力。
1 实验部分
1.1 材料与试剂
三白草:购于安徽省毫州市,4 ℃保藏备用。
G-75、DEAE,汇研生物科技有限公司;阿卡波糖,阿拉丁;α-葡萄糖苷酶,源叶生物科技有限公司;α-淀粉酶,上海麦克林生化科技有限公司。
1.2 方法
1.2.1 标准曲线的制备
参考李珊等[6]的方法,配制质量浓度为 0.4 mg/mL 的葡萄糖标准溶液。精密移取 10 μL,20 μL,30 μL,40 μL,50 μL 标准溶液于ep管中,用蒸馏水分别补足成 100 μL,加5%的苯酚溶液 0.1 mL,加浓硫酸溶液 0.5 mL,测定吸光度,平行3次。以葡萄糖溶液质量浓度为横坐标,吸光度为纵坐标制作葡萄糖标准曲线,所得标准曲线方程为Y=4.6815X-0.014(R2=0.9979)。
1.2.2 三白草多糖提取及含量测定
称取 2 g 三白草,进行超声提取,离心,取滤液,浓缩至 3 mL。调节乙醇质量分数至80%,冷藏 12 h,离心,弃上清液,加入Sevag试剂除蛋白,离心,取上层溶液得到粗多糖溶液,苯酚-硫酸法显色。在最合适波长处测定吸光度,平行3次。利用下式计算三白草多糖的提取率。
W=C×V×N/M×100%
(1)
式中:W为三白草多糖的提取率,%;N为稀释倍数;C为多糖的质量浓度,mg/mL;V为滤液体积,mL;M为三白草质量,mg。
1.2.3 单因素试验
1)最佳液料比的选择
选择液料比为5∶1,10∶1,15∶1,20∶1,25∶1,30∶1 mL/g,调节微波功率至 260 W,微波提取 60 s;
2)最佳微波时间的选择
选择微波时间为 30 s,60 s,90 s,120 s,150 s,180 s,液料比为上述实验选出的最佳值,微波功率为 260 W;
3)最佳微波功率的选择
选择微波功率为 220 W,340 W,460 W,580 W,700 W,液料比和微波时间为上述实验选出的最佳值。
1.2.4 响应面分析法优化提取工艺
综合单因素实验所得到的结果,以Box-Benhnken的中心组合实验原理为依据,采用响应面法在三因子三水平上对三白草多糖的提取条件进行优化。
1.2.5 普通水提法
称取 2 g 三白草粉末,以25∶1 mL/g的液料比加入一定量的热水,提取 90 s,采用苯酚—硫酸法显色,测定提取率。
1.2.6 验证实验
称取 2 g 三白草药材粉末,按照响应面优化得出的最优条件进行提取,离心,收集上清液,经过醇沉,除蛋白后,浓缩,取 0.1 mL 于ep管中,苯酚-硫酸法显色,测定吸光度,平行3次。
1.2.7 粗多糖的分离纯化
参考葛智超等[7]方法,取 15 mL 样品溶液上样于DEAE纤维柱。先后用蒸馏水和梯度氯化钠进行洗脱。采用苯酚—硫酸法示踪,绘制洗脱曲线,不同的峰分开收集。
将上述溶液收集,浓缩干燥得到样品。取 50 mL 样品上柱于G-75柱,调节流速为 0.5 mL/min,用蒸馏水进行水洗。采用苯酚—硫酸法示踪,绘制洗脱曲线,不同的峰分开收集。
1.2.8 降血糖活性试验
根据文献方法[8],将所有样品或阿卡波糖(40 μL,0~3200 μg/mL)与α—葡萄糖苷酶(40 μL,0.2 U/mL)于细胞板中混合并在 37 ℃ 下烘箱孵化 5 min,将PNPG(20 μL,10 mM)加入到混合溶液中继续在 37 ℃ 下反应 30 min,加入碳酸钠(100 μL,0.1 mol/L)终止反应,在 405 nm 下测定吸光度,抑制率计算公式如下:

式中:As为样品溶液、α-Glucosidase和PNPG混合溶液的吸光度;Ab为样品溶液和PNPG混合溶液的吸光度;A0为α-Glucosidase和PNPG混合溶液的吸光度。
2 结果与分析
2.1 单因素实验
2.1.1 液料比的影响
由图1可得知,多糖提取率的变化趋势。三白草多糖提取率在比值为25∶1 mL/g前,随着液料比的增大而呈现上升的趋势。液料比为25∶1 mL/g时,多糖提取率达到峰值0.72%,与其他组差异显著(P<0.05),随后再增加液料比多糖提取率反而有下降趋势。因此,选用液料比25∶1 mL/g进行后续实验。
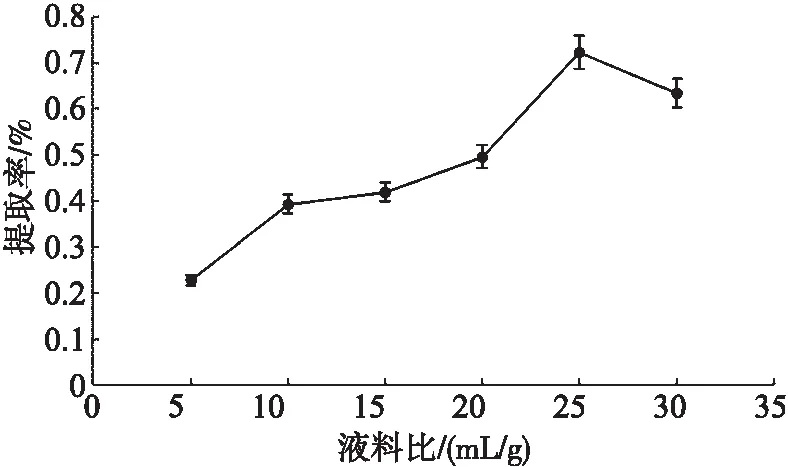
图1 液料比对三白草多糖提取率的影响
2.1.2 微波时间的影响
由图2可知,多糖提取率的变化趋势。当微波时间在30~90 s 的范围内,三白草多糖提取率与微波时间呈正相关性,随其增加而增加,峰值出现在 90 s 时,提取率为1.02%,与其他组差异显著(P<0.05)。在峰值后提取率出现下降趋势。因此,选用微波时间 90 s 为最佳条件进行后续实验。
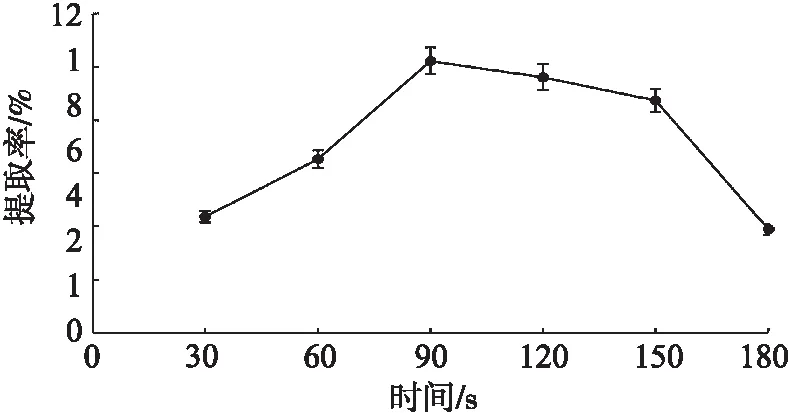
图2 微波时间对三白草多糖提取率的影响
2.1.3 微波功率的影响
由图3可知,多糖提取率的变化趋势。当微波功率在220~460 W 内,微波功率的上升,三白草多糖的提取率也逐渐升高,并在 460 W 处有峰值,此时的多糖提取率为1.98%,与其他组差异显著(P<0.05),随后微波功率的上升不会导致提取率继续增高,反而有所降低。因此,选用微波功率 460 W 为最佳条件进行后续实验。
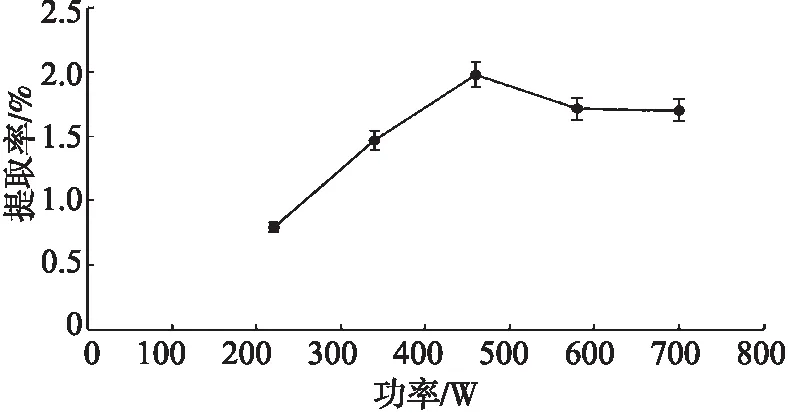
图3 微波功率对三白草多糖提取率的影响
2.2 响应面优化结果与分析
根据表1的结果,采用Design Expert 8.06软件对表1中的数据进行二次多项式拟合,从而得到三白草多糖提取率(Y)对液料比(A),微波时间(B)和微波功率(C)的回归方程为:Y=2.38+0.13A+0.038B+0.051C-0.12AB-0.089AC+0.084BC-0.62A2-0.25B3-0.11C2。得到的方差分析结果如表2所示。
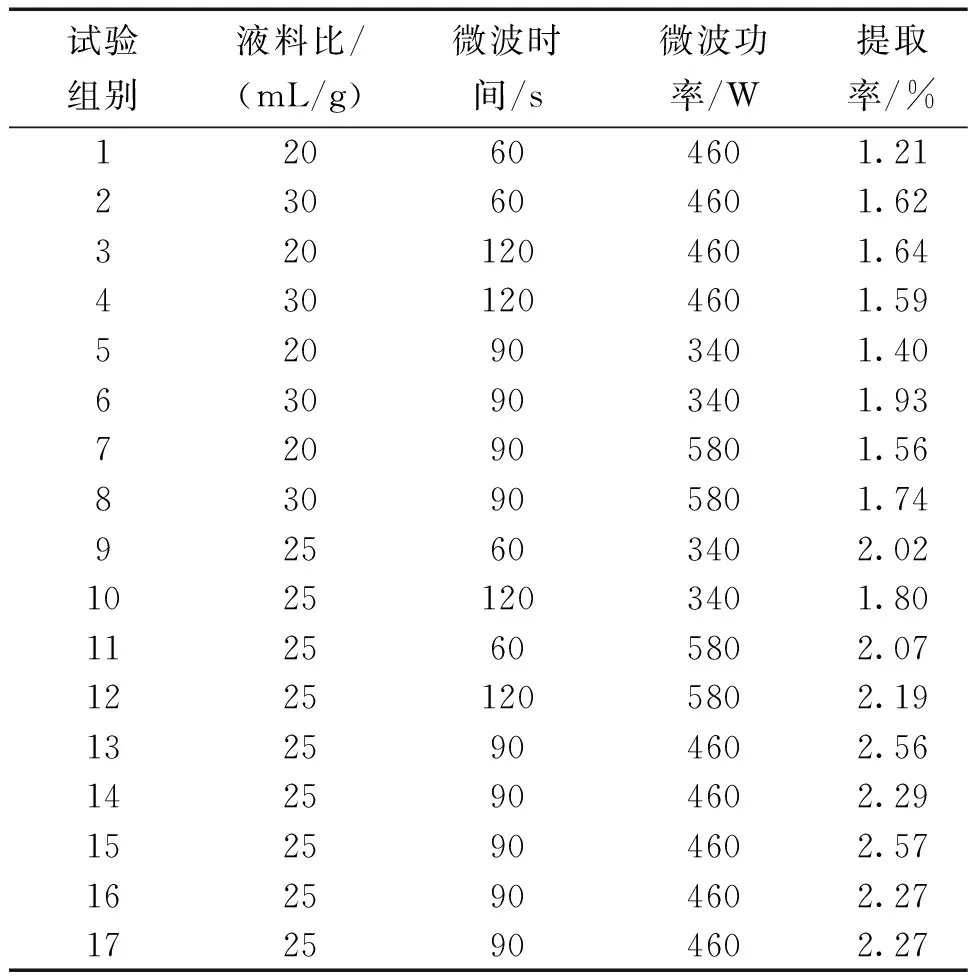
表2 方差分析
由表2看出,该回归模型的P值为0.0035,因为P值<0.05时,所以认为该模型显著,模型失拟项为0.5328,当该项>0.05时,可认为失拟项不显著。由表2中看出,对三白草多糖的提取率的影响具有一定的显著性的是液料比,而时间与功率则没有。根据表2中A、B、C对应的F值可得,液料比>时间>功率是影响三白草多糖提取率的三个单因素的影响顺序。
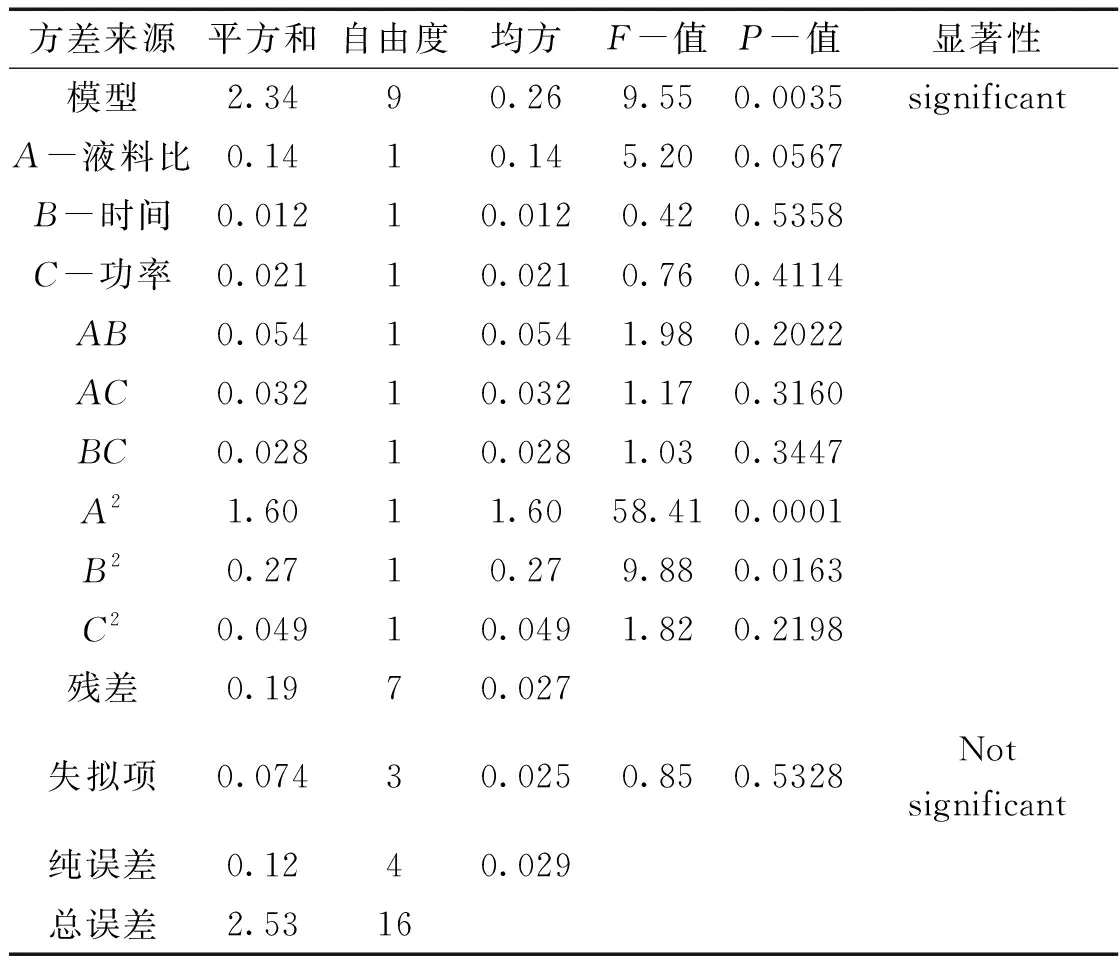
表2 方差分析
图4、图5、图6分别为液料比、微波时间及微波功率中的任意一个变量为0时,其它两个变量对三白草多糖提取率的交互作用影响。
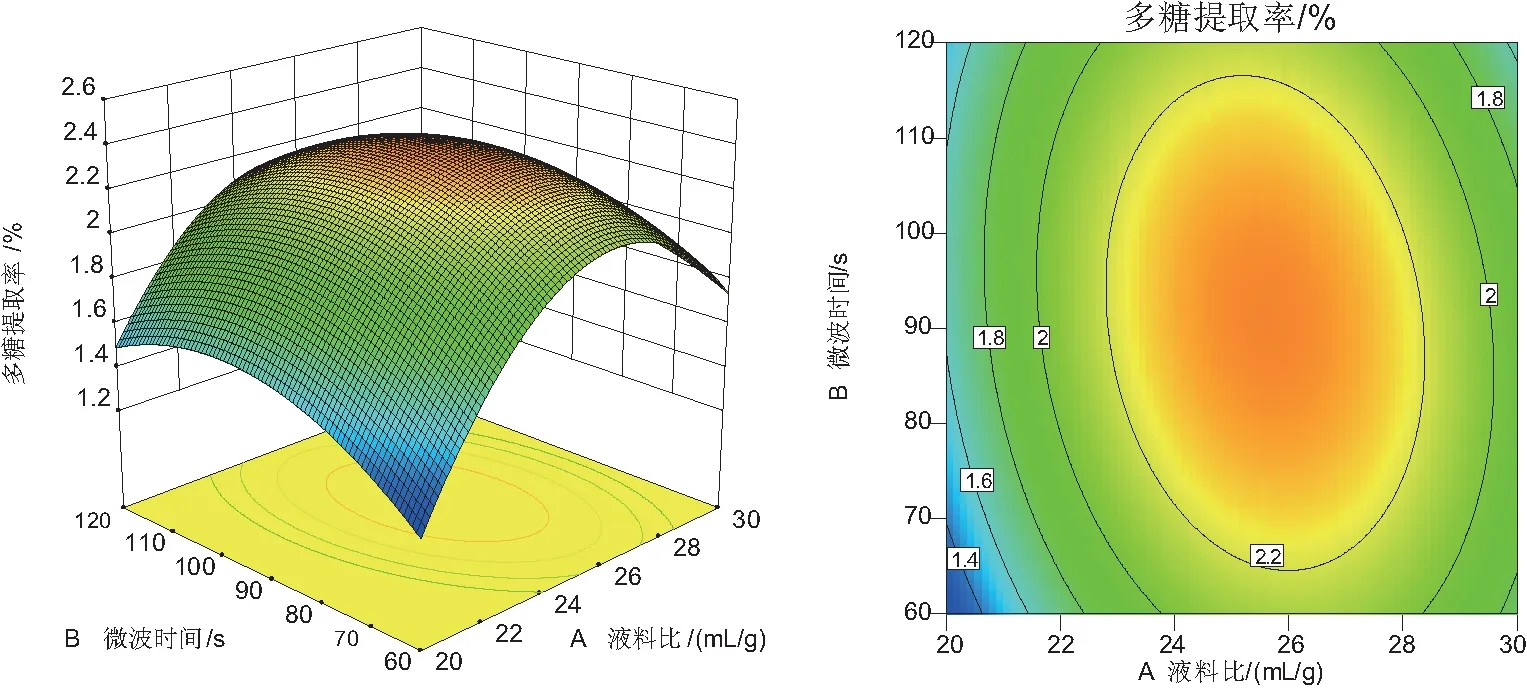
图4 液料比和微波时间对三白草多糖提取率的影响

图5 液料比和微波功率对三白草多糖提取率的影响

图6 微波时间和微波功率对三白草多糖提取率的影响
由图4~图6看出,液料比和微波时间的响应面的曲面最陡,说明相对于其他两个因素的交互作用而言,AB交互作用对三白草多糖提取率的影响较大。这与方差分析结果表的数据一致。由图4~图6可以看出,液料比的等高线最为密集,所以液料比对三白草多糖提取率的影响最为明显,其次是微波时间,微波功率是对三白草微波提取多糖影响最小的因素。此结果也与方差分析结果一致。
2.3 验证实验
通过响应面软件对数据的分析优化,确定液料比25∶1 mL/g,微波时间 90 s,微波功率 460 W 为本实验的最佳优化条件参数,三白草多糖理论提取率可达到2.57%。在此最佳条件下做验证实验,实际得到的平均提取率为2.51%,此结果与响应面的回归方程所得的理论值一致性较高,表明此条件可行性高。与普通水提法的0.9%提取率相比,优化效果良好。
2.4 三白草粗多糖的分离纯化
由图7可看出,水洗部分,得到两个峰,表明分离得到两个组分,记为:SP-1和SP-2。盐洗部分得到三个峰,表明分离得到三个组分,记为:SP-3,SP-4和SP-5。水洗所得到的组分的量较少。对于盐洗的组分,选择量最高的SP-3进行下一步的纯化。
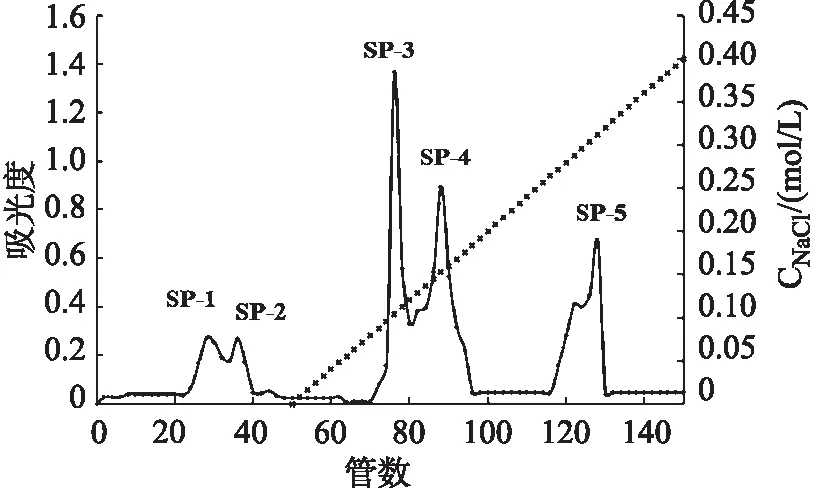
图7 三白草多糖DEAE-纤维柱的洗脱曲线
将上述获得的SP-3经过Sephadex G-75层析柱的分离纯化,得到如图8所示的洗脱曲线,可以得出洗脱出来的组分较为单一,证明了SP-3经过纯化后,得到的是较纯多糖。
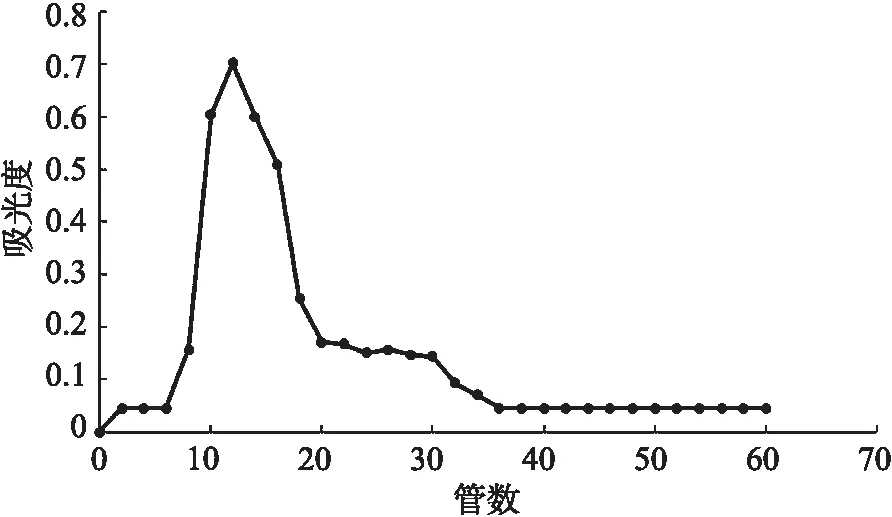
图8 三白草多糖Sephadex G-75的洗脱曲线
2.5 三白草多糖降血糖活性
由图9可看出,当SP-3最高抑制率为91.61%,此时SP-3的质量浓度为 3.2 mg/mL,说明该多糖具有明显抑制α—葡萄糖苷酶的活性。SP-3的IC50值为 0.002 mg/mL,小于阿卡波糖(0.003 mg/mL),说明三白草多糖的降血糖作用高于阳性药阿卡波糖。
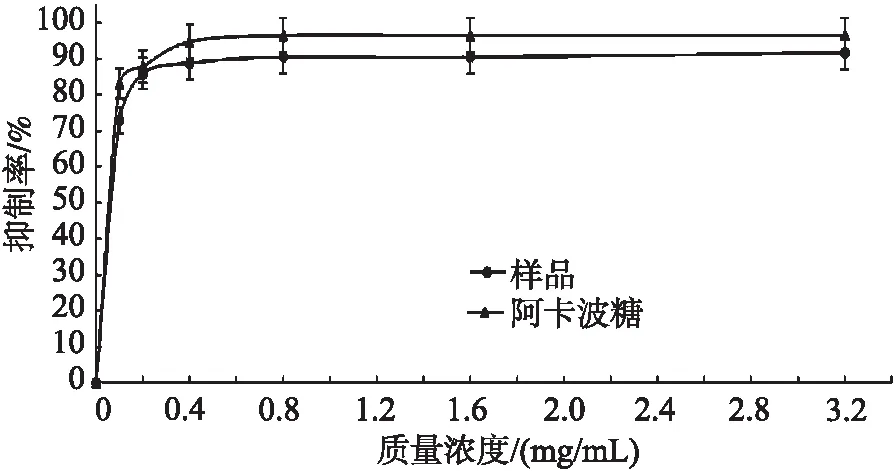
图9 三白草多糖体外对α-葡萄糖苷酶活性的抑制曲线
3 结论
本研究探讨了三白草多糖的最佳微波辅助提取工艺参数及其降血糖活性。结果表明,三白草多糖的最佳提取条件为液料比 25 mL/g、微波时间 90 s、微波功率 460 W。在该条件下得到的三白草多糖提取率为2.57%,与普通水提法相比,提取率有所提高。采用DEAE与G-75柱纯化得到三白草精多糖。此外,降血糖实验结果显示,三白草IC50值小于阿卡波糖,即三白草多糖对α—葡萄糖苷酶的抑制作用比阿卡波糖强。实验结果可为三白草多糖的提取以及日后的实际生产应用提供一定的理论依据。

