茯苓基因组中MYB转录因子基因家族鉴定及表达分析
陈泓宇,董树廷,郭妙弦,罗红梅
茯苓基因组中MYB转录因子基因家族鉴定及表达分析
陈泓宇,董树廷,郭妙弦,罗红梅*
中国医学科学院北京协和医学院 药用植物研究所,中草药物质基础与资源利用教育部重点实验室,北京 100193
从全基因组水平挖掘茯苓MYB转录因子基因家族成员,并分析其在菌丝、菌核等部位及茉莉酸甲酯(methyl jasmonate,MeJA)诱导后菌丝中的表达模式,以期发现与茯苓发育及次生代谢物生物合成调控相关的MYB转录因子。基于茯苓基因组数据,通过序列比对及保守结构域分析挖掘MYB转录因子基因,利用ExPASy在线工具预测分析MYB蛋白质理化性质,利用MEGA 7.0软件构建茯苓MYB蛋白进化树,利用MEME在线工具分析保守基序,利用Plant CARE进行启动子区顺式作用元件分析,通过MeJA诱导菌丝并采用qRT-PCR方法检测基因相对表达量。在茯苓基因组中共鉴定到10个含有特征性保守结构域的MYB转录因子,其中4个属于1R类型,4个属于2R类型,2个属于4R类型。进化树及保守基序显示,相同进化枝的MYB蛋白所含基序类型相似。启动子区预测分析发现了多类激素及逆境响应顺式作用元件。基因表达谱分析显示有2个基因(和)在菌丝中的表达量高于菌核中的表达量,而则是在菌核中表达量相对较高。MeJA诱导后,有3个基因(和)在诱导3 h时表达量明显上调。从茯苓全基因组中系统鉴定MYB转录因子基因家族,为进一步研究基因在调控茯苓发育及次生代谢物合成方面的生物学功能奠定基础。
茯苓;MYB转录因子;全基因组鉴定;生物信息学分析;基因表达分析
茯苓为多孔菌科真菌茯苓(Schw.) Wolf的干燥菌核,其干燥菌核作为药食两用的传统大宗药材,在中国有上百年的商业化种植历史。在《中国药典》2020年版记载具有利水渗湿、健脾宁心的功效[1],国内市场年需求量约2万t,被广泛应用于中医药、保健食品、洗化用品等领域[2]。现代研究发现,茯苓菌核中富含多糖类、氨基酸类、甾醇类、萜类等多种化学成分[3],具有抗肿瘤、抗炎、免疫调节等作用[4]。
目前,对茯苓的研究多集中于化学成分、药理作用、炮制加工、中药复方等领域[5]。作为一种应用广泛的药用真菌,近年来茯苓的次生代谢产物生物合成、能量来源、生长发育以及转录调控机制的研究引起广泛关注,例如,茯苓三萜合成途径中的磷酸甲羟戊酸激酶基因()[6]、鲨烯合酶基因()[7]、羊毛甾醇合酶基因()[8]先后被鉴定。Yang等[9]报道山梨醇脱氢酶(SORD)、α-半乳糖苷酶(galA)等是茯苓多糖合成途径中的关键酶。Zhang等[10]对茯苓进行转录组分析发现基因在松木降解和菌核形成过程中发挥了重要作用。此外,也有研究表明,真菌的形态发育与次生代谢物的生物合成通常具有密切关联[11]。例如,Velvet复合体和CBC复合体在灵芝发育与次生代谢转录调控中发挥着重要作用[12];真菌特异性Zn2Cys6转录因子参与调控菌丝分枝生长以及色素合成[13]。目前,茯苓全基因组已测序完成[14],共鉴定到包括GATA zinc finger、bZIP、MYB等在内的307个转录因子,为茯苓发育及次生代谢调控机制的研究提供了候选基因。
MYB转录因子是普遍存在于真核生物中的转录因子基因家族之一[15],具有广泛的生物学功能,在生物体生长发育、次生代谢、抗病抗逆等过程中发挥重要作用[16-21]。MYB具有高度保守的DNA结合结构域,该结构域由50~55个碱基组成,含有1~3个不完全重复的R结构,并形成螺旋-转角-螺旋(helix-turn-helix,HTH)结构,参与转录因子与DNA的结合过程[15,22]。根据MYB结构域的数量,MYB转录因子分为4种类型,即1R-MYB、2R-MYB、3R-MYB和4R-MYB[23]。在植物中,MYB转录因子参与黄酮、三萜等物质的合成与调控[24-25]。真菌中的MYB转录因子同样广泛参与发育及次生代谢调控等多种生理过程。例如,在构巢曲霉中MYB转录因子通过促进分生孢子和无性孢子的产生来调控有性孢子和无性孢子的发育过程[26];在禾谷镰刀菌中系统鉴定了MYB转录因子基因家族,并发现其参与调控次生代谢物合成、环境胁迫响应以及致病性过程[27];此外,牛樟芝[28]、金针菇[29]、灵芝[30]、侧耳[31]、冬虫夏草[32]等重要大型真菌MYB转录因子基因家族均在全基因组水平得到鉴定,并发现其在真菌发育及代谢调控方面发挥重要作用。但目前,茯苓MYB转录因子基因家族鉴定及生物学功能尚未见报道。
本研究在茯苓基因组中系统鉴定了茯苓MYB(PcMYB)转录因子基因家族,并对其蛋白理化性质、进化关系、保守基序、启动子中的顺式作用元件等进行预测分析;基于茯苓菌丝和菌核的转录组数据,分析PcMYB在不同发育阶段中的表达谱;同时检测了在外源激发子茉莉酸甲酯(methyl jasmonate,MeJA)诱导下的PcMYB差异表达情况,以期为PcMYB转录因子的功能研究奠定基础。
1 材料与仪器
1.1 材料
茯苓菌株(F. A. Wolf) Ryvarden & Gilb.(菌株编号CGMCC5.78)购自中国普通微生物菌种保藏管理中心(北京),超低温保存于本实验室菌种库,经ITS2序列鉴定为茯苓[14]。营养菌丝体于马铃薯葡萄糖固体培养基上28 ℃黑暗培养。茯苓全基因组序列、cDNA序列和氨基酸序列均来源于已发表的茯苓基因组。
1.2 仪器
RNAprep Pure多糖多酚植物总RNA提取试剂盒购自北京天根生化科技有限公司;PrimeScriptTM II 1st strand cDNA Synthesis Kit,TB Green®Premix Ex Taq™购自TaKaRa公司;MeJA购自Sigma公司;其他常规试剂均为国产分析纯。本实验所用引物由苏州安升达生物科技有限公司合成。
2 方法
2.1 PcMYB家族基因鉴定
基于茯苓全基因组和转录组数据(GSA:CRA003688),利用Pfam(http://pfam.xfam.org/ search)工具,以MYB结构域(PF00249)为搜索模型,利用HMM 3.0软件筛选茯苓中含有该结构域的MYB转录因子。进一步利用NCBI数据库的CDD、SMART等在线软件筛选并确认PcMYB蛋白序列中是否含有SANT结构域。
2.2 PcMYB蛋白特征、保守基序及启动子顺式作用元件分析
利用在线工具ExPASy protparam tool (https:// web.expasy.org/protparam/)分析PcMYB蛋白的理化性质,利用SOPMA软件(http://npsa- pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白质的脂肪系数及二级结构,利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/ Cell- PLoc-2/)预测亚细胞定位情况。利用在线工具MEME(http://meme-suite.org/index.html)对PcMYB蛋白的保守基序(Motif)进行预测,Motif的查找数量设置为15,其他参数均设置为默认值。使用TBtools[33]提取ATG上游2000 bp的MYB基因启动子序列,利用Plant CARE在线网站(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子区域顺式作用元件。
2.3 PcMYB进化树构建
使用MEGA 7.0软件将10条WcMYB蛋白序列与赤芝(Leyss. Ex Fr.)、侧耳(Jacq. ex Fr.) P. Kumm.、牛樟芝(M. Zang & C.H. Su) Sheng H. Wu, Ryvarden & T.T. Chang、稻瘟菌Couch.的MYB序列采用邻接法(neighbor-joining,NJ)构建进化树,Bootstrap method设置为1000,其余参数均设置为默认值。
2.4 PcMYB基因在不同部位表达量分析
以茯苓的菌丝、菌核的转录组测序(RNA-Seq)数据(GSA:CRA003688)为基础,获取PcMYB转录因子基因表达谱,利用TBtools软件以FPKM值绘制基因表达量交互热图。
2.5 MeJA处理后基因表达量分析
MeJA作为一种信号分子,可以模拟外界环境刺激,诱导植物的应激化学防御反应以及多种次生代谢物的生物合成。选择在固体培养基上生长15天的茯苓菌丝体,喷洒浓度为200 μmol/L的MeJA溶液,处理0(对照)、3、6、12 h取样,检测基因是否响应MeJA处理。利用RNA提取试剂盒进行总RNA提取,利用反转录试剂盒进行cDNA合成。使用CFX96荧光定量PCR仪和实时荧光定量PCR试剂盒进行qRT-PCR实验。利用DNAMAN软件设计引物,通过序列比对选择特异性较高的序列,由苏州金唯智生物科技有限公司合成,所用引物见表1。根据此前实验选择茯苓中的基因为内参[34],每个样品设置3个重复。qRT-PCR的体系为:2×SYBR 7.5 μL,上下游引物1 μL,模板1 μL,ddH2O 4.5 μL;PCR反应程序:95 ℃、30 s,95 ℃、10 s,60 ℃、30 s,40个循环反应,结果采用2–ΔΔCt法进行分析,基因相对表达量利用Graphpad Prism 9.0进行方差分析。

表1 qRT-PCR引物序列
3 结果与分析
3.1 PcMYB转录因子鉴定和蛋白理化性质分析
基于茯苓基因组[14]数据,通过Pfam注释筛选到10个包含MYB_DNA_binding的MYB转录因子基因家族成员,将其命名为~。这些基因编码的氨基酸序列长度范围为371 aa(PcMYB5)~1963 aa(PcMYB8),相对分子质量范围为40.76(PcMYB5)~217.430(PcMYB8)。PcMYB蛋白的理论等电点值范围为4.83(PcMYB6)~6.91(PcMYB7)。蛋白质二级结构表示,α-螺旋和无规卷曲在所有PcMYB蛋白中占主导,其次是延伸链和β-转角。所有蛋白的GRAVY值均为负,说明PcMYB均为亲水性蛋白。此外,PcMYB蛋白的脂肪系数范围为57.84(PcMYB3)~73.94(PcMYB5),而不稳定系数显示,所有的PcMYB蛋白具有较高的不稳定性(不稳定系数>40)。亚细胞定位预测结果显示,有9个PcMYB转录因子在细胞核中定位,符合转录因子的亚细胞定位特点,仅PcMYB9预测定位在细胞核和细胞质中(表2)。
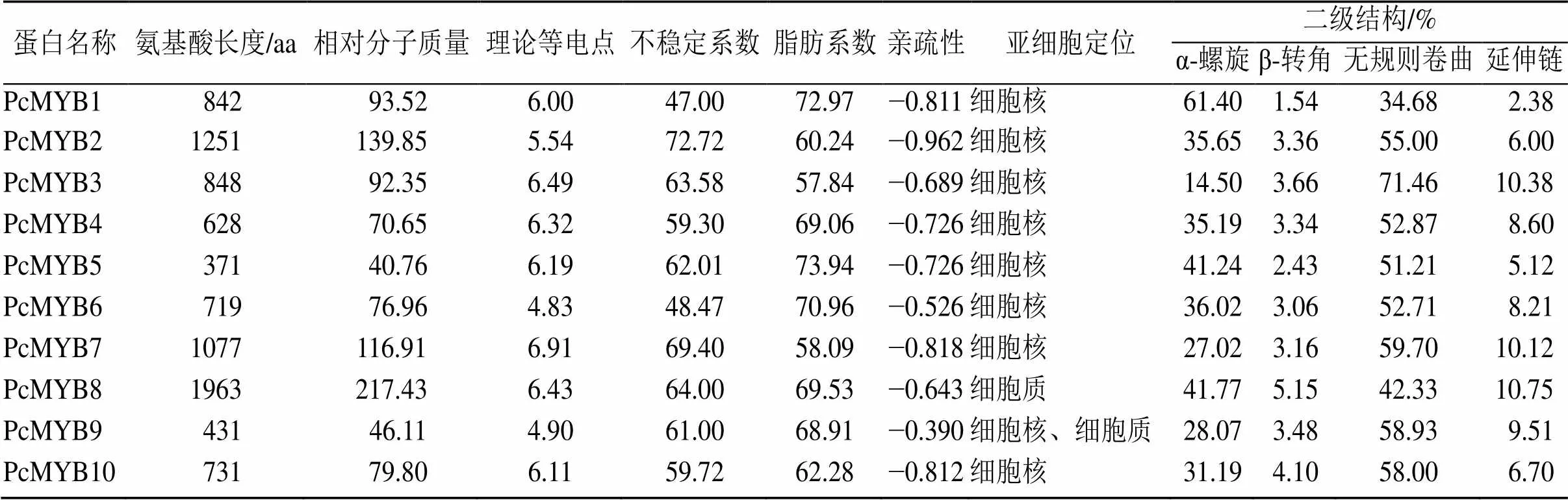
表2 PcMYB蛋白理化性质预测分析
3.2 PcMYB转录因子基因家族的保守结构分析
使用在线工具SMART对PcMYB转录因子结构域进行分析,结果显示在PcMYB基因家族中全部MYB蛋白具有共同的SANT保守结构域,且保守域不只存在于蛋白质序列的N端,而且在蛋白质的中间序列或者C端区域均有分布(图1-A)。PcMYB2、PcMYB4、PcMYB5、PcMYB6含有1个SANT结构域,属于1R类MYB转录因子,其中PcMYB2和PcMYB6除SANT结构域外还分别含有HAS和ZnFZZ结构域。PcMYB1、PcMYB3、PcMYB7、PcMYB9含有2个结构域,属于2R类的MYB转录因子。而PcMYB8和PcMYB10含有4个结构域,属于4R类型。使用WebLogo3对茯苓的1R-MYB和2R-MYB转录因子的DNA结合结构域序列进行分析,结果显示PcMYB转录因子的R1、R2结构域中有多个保守的氨基酸残基(图1-B),其中色氨酸残基(W)最为保守。此外,在1R结构域中的甘氨酸(G)、谷氨酸(E)、亮氨酸(L)也相对保守;在2R结构域中异亮氨酸(I)、苏氨酸(T)等较为保守(图1-B)。
3.3 PcMYB转录因子基序分析及系统进化分析
为了进一步研究PcMYB基因家族各个成员间的进化关系及其进化保守性,本课题组选择了担子菌门以及子囊菌门部分已经鉴定的真菌MYB基因家族成员与茯苓MYB基因家族的成员进行了进化树分析。利用MEGA 7.0将茯苓10个MYB转录因子与灵芝中的11个MYB蛋白、牛樟芝中的8个MYB蛋白、侧耳中的15个MYB蛋白、稻瘟菌中的8个MYB蛋白构建进化树(图2)。分析进化树,发现茯苓的10个MYB转录因子基因家族成员被聚类到不同的进化枝上,表明茯苓的MYB基因家族成员可能具有不同的功能。PcMYB5、PcMYB6、PcMYB7进化关系相对较近。PcMYB1与侧耳的PoMYB5、稻瘟菌的MoMYB4聚类到1个进化枝。此外,PcMYB10与PoMYB7、MoMYB1聚类到1个进化枝。
进一步使用MEME Suite进行Motif分析,发现PcMYB基因家族中PcMYB8、PcMYB10所含的Motif数目最多为7个,其余包含的Motif数目为4或5,Motif1、Motif2、Motif3出现的频率最高。此外,不同真菌中所含基序表现出进化分枝间的特异性,相同进化枝的MYB蛋白序列所含的Motif的类型也较为相似,例如在GlMYB09、AcMYB04、PcMYB7、PoMYB12、PcMYB6这一进化枝中含有相同的Motif2、Motif3和Motif8。PoMYB07、PcMYB10、AcMYB1和GlMYB07这一进化枝中所含的Motif类型与位置也较为一致。

图1 PcMYB转录因子保守结构域(A)及其保守氨基酸残基(B)

图2 PcMYB转录因子系统进化关系和保守基序
3.4 PcMYB基因启动子区顺式作用元件分析
为了分析基因潜在的生物学功能,使用Plant CARE工具鉴定了基因起始密码子(ATG)上游2000 bp区域中的顺式作用元件。基因启动子区中,主要包含生长发育、植物激素响应和胁迫响应相关的3类顺式作用元件。其中CAAT-box在10个基因启动子中所含数量最多。除此之外,还含有多种激素响应的顺式作用元件:例如MeJA响应的顺式作用元件(TGACG-motif/ CGTCA-motif)、脱落酸响应的顺式作用元件(ABRE)、水杨酸响应的顺式作用元件(as-1)。在、、、基因启动子中,MeJA响应的顺式作用元件数目较多。在启动子区中,脱落酸响应的顺式作用元件(ABRE)最多。在胁迫响应的顺式作用元件中,发现10个基因中大多都含有应激响应的顺式作用元件(STRE)、参与环境适应性的MYB元件和MYC元件(图3)。这些结果表明基因可能在茯苓的非生物胁迫响应和逆境环境应答中发挥重要功能。
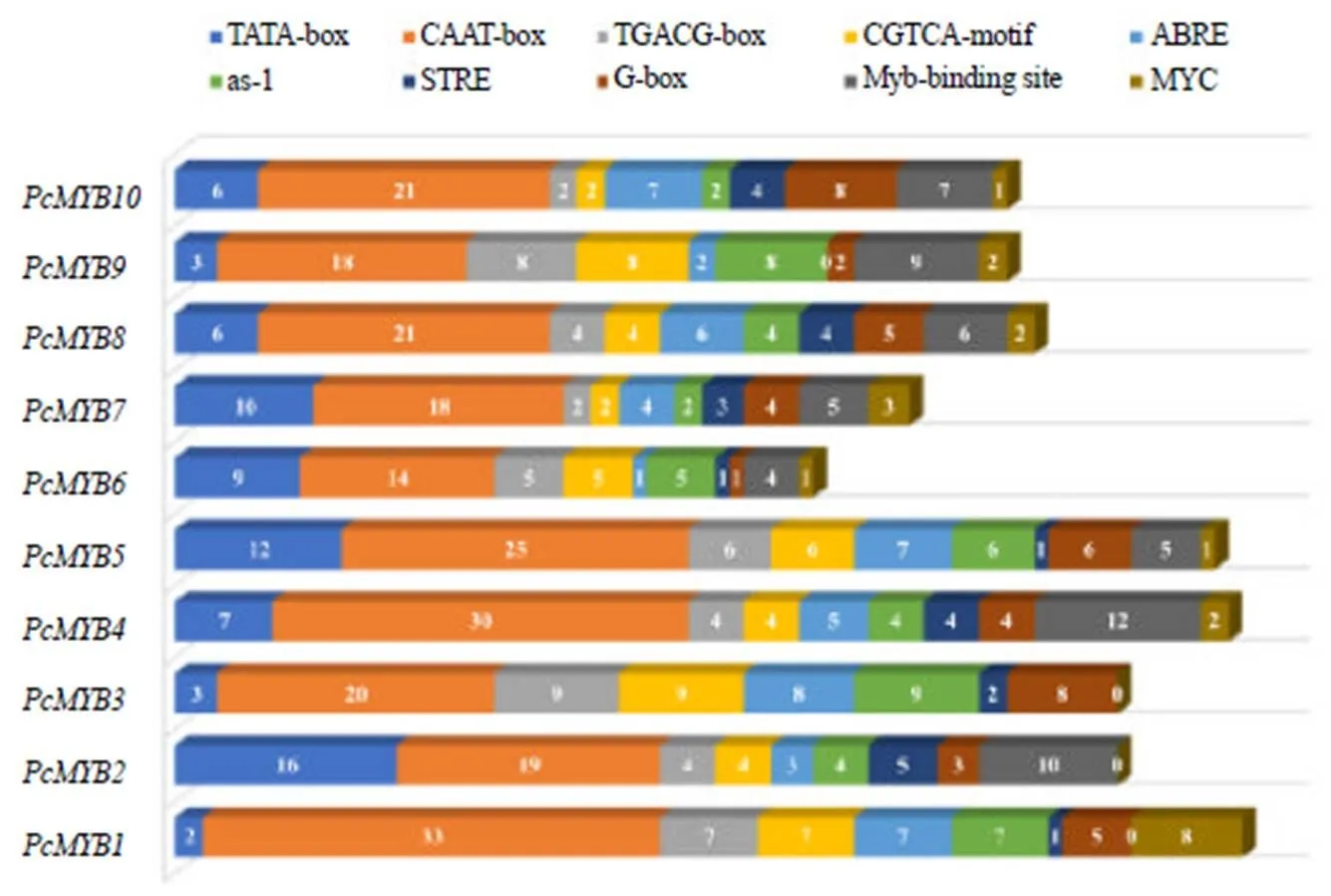
图3 PcMYB基因启动子中多种顺式作用元件
3.5 PcMYB基因表达模式分析
基于茯苓基因组及转录组数据(GSA:CRA003688),根据10条基因的FPKM值,利用TBtools绘制不同部位的基因表达量热图(图4),结果表明,茯苓中10个MYB转录因子基因均在菌丝和菌核中有不同程度的表达,其中、在菌丝和菌核中的表达量显著高于其他基因的表达量。、在菌核中表达量相对较高;其中,在菌核中表达量明显高于在菌丝中的表达量;而、在菌丝中表达量显著高于菌核;另外,其他基因、在菌丝和菌核中的表达量差异不明显。
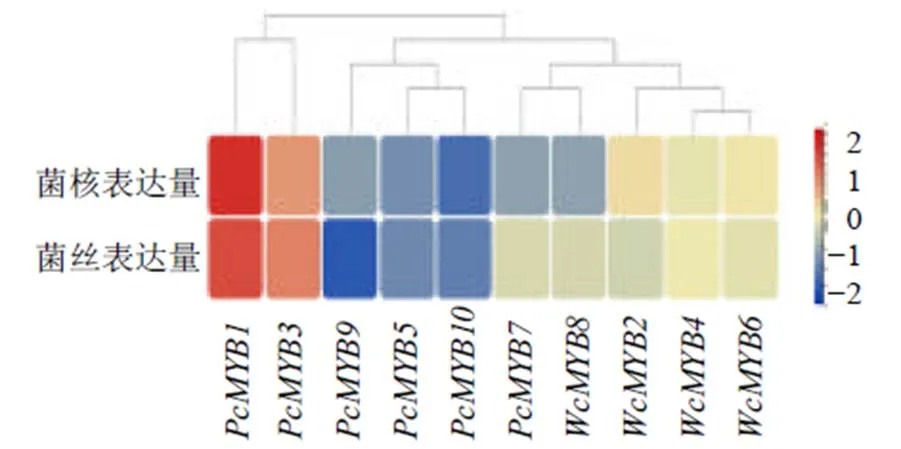
图4 PcMYB基因在菌丝和菌核中的表达量
MeJA作为一种重要的信号分子,参与生物体中多糖、萜类等多种化合物的合成与调控[35]。为研究茯苓中MYB基因是否响应MeJA诱导,本研究利用MeJA处理生长旺盛的茯苓菌丝,结果发现大多数基因在处理后的不同时间点响应程度不同(图5)。其中、、3个基因表达量变化较为明显。在MeJA处理3 h后表达量升至对照组的1.47倍;在MeJA处理3 h后表达量升至对照组的2.2倍,在MeJA处理12 h后表达量升高至对照组的2.08倍;受MeJA诱导表达量变化最为明显,在MeJA处理3 h后表达量升高至对照组的2.8倍,在MeJA处理12 h后表达量升高至对照组的3.04倍;而且,这3个基因在系统发育进化树中位于同一进化支(图2),推测它们可能具有相似的功能。此外还发现,在MeJA处理6 h后,相较于3 h处理,除外的其他基因表达量均下降,但在处理12 h后,它们的表达量又有所上升,显示出基因对MeJA诱导具有不同的响应模式。

不同小写字母(a, b, c, d)表示组间差异显著;相同小写字母表示组间无显著差异(P<0.05)
4 讨论
茯苓广泛分布于世界各地,在中国几个世纪以来一直用作美食和药材,其菌核常在针叶树和硬木树等宿主的根部附近形成,富含多种化学成分,包括三萜类、二萜类、甾醇类、多糖类,以及氨基酸、脂肪酸、微量元素和挥发油等[4]。其中,三萜和多糖类化合物为主要的活性成分。研究表明,转录因子在真菌菌核发育与代谢产物调控过程中发挥主要作用[11]。多种转录因子在茯苓基因组中被发现,但其功能都尚未被鉴定,MYB转录因子基因家族是其中重要的一类[14]。
在真菌中仅有少数物种的基因家族被鉴定,例如,牛樟芝中有9个基因[28],金针菇中有13个基因[29],在赤芝中有12个MYB基因[30]。本研究从茯苓全基因组中筛选得到10个PcMYB转录因子家族成员,PcMYB数量与赤芝、牛樟芝等真菌中所鉴定到的基因数量相近。此前,有研究表明,植物基因家族的大量扩张是由于基因的串联复制而导致的[36],而在赤芝、茯苓等基因组中筛选到较少的基因家族成员,这可能与真菌基因组在进化过程中发生较少量的串联复制有关。除此之外,在植物中,2R(R2R3)-MYB是主要的MYB转录因子类型,而在茯苓MYB基因家族中的主要类型为1R-MYB和2R-MYB,这表明可能在真菌中主要发挥功能的是1R-MYB和2R-MYB 2种类型的MYB转录因子。
在进化树中,10个PcMYB转录因子和赤芝、侧耳等其他真菌中41个MYB转录因子被聚类为13个进化枝。其中,PcMYB4与牛樟芝AcMYB6、侧耳PoMYB16聚类到一起且具有相同的保守基序,而AcMYB6可能调控牛樟芝菌丝的生长[28],从茯苓的基因表达谱中发现在菌丝和菌核中均表达,在菌丝中的表达量略高于菌核,根据结构和序列上的高度保守以及类似的表达模式,推测PcMYB4可能也具有类似AcMYB6调控菌丝发育的功能。另外,在侧耳中,、基因在子实体中表达量最高,且受热胁迫表达量显著升高[31],可能与子实体生长和热胁迫响应相关。而在稻瘟菌细胞壁完整性和抑制几丁质生物合成方面发挥重要的作用[37],进而提升真菌对环境压力的应对能力。本研究中的PcMYB1与PoMYB2、PoMYB17、MoMYB8的进化关系较近,且在菌丝和菌核中均有较高水平的表达量,推测PcMYB1在茯苓菌丝、菌核生长发育与环境胁迫响应中具有重要作用。另外,和在菌丝中的表达量高于菌核中的表达量,而则是在菌核中的表达量相对较高,这可能暗示这些基因在茯苓菌丝和菌核中发挥不同功能。在基因启动子顺式作用元件分析中,也同样发现基因的启动子区富含多种激素和逆境胁迫响应的顺式作用元件。这些顺式作用元件的类型和数量可能影响基因的表达水平和生物学功能。在真菌中,有研究表明MeJA可以调控大型真菌灵芝中的三萜类合成途径,提高灵芝酸含量[38-39];此外,还有报道称MeJA可以调节灵芝菌丝分枝,增加细胞内活性氧含量[40]。在本研究中,10条基因启动子中均存在数目较多的MeJA响应的顺式作用元件。因此,本课题组选用了MeJA对茯苓菌丝进行处理。结果表明,这些基因在MeJA处理下显示出不同的响应模式,尤其是和在诱导3 h时表达量显著上调,推测这2个基因可能参与茯苓对外界环境的化学防御,也可能参与次生代谢途径的调控。在茯苓转录组数据中,在菌丝和菌核中的表达量相对较高,但是对于MeJA处理其表达量并未发现明显变化,这可能是因为基因不直接响应MeJA信号途径。
综上所述,本研究基于茯苓基因组鉴定到10个PcMYB转录因子。利用生物信息学分析方法对PcMYB转录因子基因家族成员进行预测分析,并通过菌丝、菌核不同部位表达量分析及MeJA诱导表达分析,筛选到可能参与茯苓菌丝或菌核发育(、和)及MeJA信号响应途径的候选基因(和),后者还可能参与茯苓次生代谢途径的调控过程,后续将进一步对这些基因进行功能验证,以期为探究茯苓生长发育与次生代谢物合成调控的分子机制提供研究基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 251.
[2] 金剑, 钟灿, 谢景, 等. 我国茯苓炮制加工和产品研发现状与展望 [J]. 中国现代中药, 2020, 22(9): 1441-1446.
[3] Esteban C I. Interés medicinal de(=) [J]., 2009, 26(2): 103-107.
[4] Wang Y Z, Zhang J, Zhao Y L,. Mycology, cultivation, traditional uses, phytochemistry and pharmacology of(Schwein.) Ryvarden et Gilb.: A review [J]., 2013, 147(2): 265-276.
[5] 颜冬兰, 谢安, 袁莉, 等. 茯苓加工炮制、成分分析及体内代谢研究进展 [J]. 亚太传统医药, 2019, 15(9): 176-179.
[6] 何海. 茯苓磷酸甲羟戊酸激酶基因克隆及功能分析 [D]. 武汉: 华中农业大学, 2016.
[7] Wang J R, Lin J F, Guo L Q,. Cloning and characterization of squalene synthase gene fromand its up-regulation by methyl jasmonate [J]., 2014, 30(2): 613-620.
[8] 周振. 茯苓羊毛甾醇合酶基因PcLSS克隆及其功能验证 [D]. 武汉: 华中农业大学, 2017.
[9] Yang L, Tang J, Chen J J,. Transcriptome analysis of three cultivars ofreveals genes related to the biosynthesis of polysaccharides [J]., 2019, 21(5): 462-475.
[10] Zhang S P, Hu B X, Wei W,. De novo analysis oftranscriptome to reveal the differentially expressed carbohydrate-active enzymes (CAZymes) genes during the early stage of sclerotial growth [J]., 2016, 7: 83.
[11] Calvo A M, Wilson R A, Bok J W,. Relationship between secondary metabolism and fungal development [J]., 2002, 66(3): 447-459.
[12] Bayram O, Braus G H. Coordination of secondary metabolism and development in fungi: The velvet family of regulatory proteins [J]., 2012, 36(1): 1-24.
[13] Song T Q, Zhang X, Zhang Y,. Genome-wide identification of Zn2Cys6 class fungal-specific transcription factors (ZnFTFs) and functional analysis of UvZnFTF1in[J]., 2021, 28(6): 567-578.
[14] Luo H M, Qian J, Xu Z C,. Thegenome and transcriptome shed light on the formation of its edible and medicinal sclerotium [J]., 2020, 18(4): 455-467.
[15] Dubos C, Stracke R, Grotewold E,. MYB transcription factors in[J]., 2010, 15(10): 573-581.
[16] Ito M, Araki S, Matsunaga S,. G2/M-phase-specific transcription during the plant cell cycle is mediated by c-Myb-like transcription factors [J]., 2001, 13(8): 1891-1905.
[17] Kim S, Park S Y, Kim K S,. Homeobox transcription factors are required for conidiation and appressorium development in the rice blast fungus[J]., 2009, 5(12): e1000757.
[18] Valsecchi I, Sarikaya-Bayram Ö, Wong Sak Hoi J,. MybA, a transcription factor involved in conidiation and conidial viability of the human pathogen[J]., 2017, 105(6): 880-900.
[19] Zhu X L, Liang W Q, Cui X,. Brassinosteroids promote development of rice pollen grains and seeds by triggering expression of Carbon Starved Anther, a MYB domain protein [J]., 2015, 82(4): 570-581.
[20] Chen T Z, Li W J, Hu X H,. A cotton MYB transcription factor, GbMYB5, is positively involved in plant adaptive response to drought stress [J]., 2015, 56(5): 917-929.
[21] Yang X Y, Guo T, Li J,. Genome-wide analysis of the MYB-related transcription factor family and associated responses to abiotic stressors in[J]., 2021, 191: 359-376.
[22] Wang B H, Luo Q, Li Y P,. Structural insights into target DNA recognition by R2R3-MYB transcription factors [J]., 2020, 48(1): 460-471.
[23] Du H, Liang Z, Zhao S,. The evolutionary history of R2R3-MYB proteins across 50 eukaryotes: New insights into subfamily classification and expansion [J]., 2015, 5: 11037.
[24] 吴瑞, 林定, 罗栋, 等. 番红花R2R3-MYB转录因子的鉴定与时空表达分析 [J]. 农业生物技术学报, 2022, 30(3): 457-472.
[25] 朱畇昊, 张梦佳, 李璐, 等. 夏枯草三萜和酚酸类合成相关的MYB转录因子的挖掘及分析 [J]. 中草药, 2019, 50(9): 2165-2171.
[26] Arratia-Quijada J, Sánchez O, Scazzocchio C,. FlbD, a Myb transcription factor of, is uniquely involved in both asexual and sexual differentiation [J]., 2012, 11(9): 1132-1142.
[27] 张胜男, 兰建武, 李亚. 禾谷镰刀菌MYB转录因子生物信息学分析 [J]. 分子植物育种, 2020, 18(17): 5700-5707.
[28] 张璋, 王毅, 罗玛妮娅, 等. 牛樟芝MYB转录因子的全基因组鉴定与分析 [J]. 分子植物育种, 2022, 20(14): 4634-4641.
[29] 邓冰, 刘宗奇, 袁学文, 等. 金针菇MYB转录因子家族成员鉴定及其在子实体形成中的表达模式分析 [J]. 食用菌学报, 2021, 28(5): 1-11.
[30] Wang L N, Huang Q H, Zhang L L,. Genome-wide characterization and comparative analysis of MYB transcription factors inspecies [J].(), 2020, 10(8): 2653-2660.
[31] Wang L N, Gao W, Wu X L,. Genome-wide characterization and expression analyses ofMYB transcription factors during developmental stages and under heat stress based on de novo sequenced genome [J]., 2018, 19(7): 2052.
[32] 李肖, 李文佳, 王芬, 等. 冬虫夏草MYB家族基因鉴定及其在生长发育中的表达分析 [J]. 菌物学报, 2019, 38(12): 2174-2182.
[33] Chen C J, Chen H, Zhang Y,. TBtools: an integrative toolkit developed for interactive analyses of big biological data [J]., 2020, 13(8): 1194-1202.
[34] Zhang X, Xu Z C, Xu J,. Selection and validation of reference genes for normalization of quantitative real-time reverse transcription PCR analysis in(Schw.) Wolf (Fuling) [J]., 2016, 11: 8.
[35] 陈林, 崔培梧, 鲁耀邦, 等. 茉莉酸甲酯对茯苓三萜生物合成的调控研究 [J]. 湖南中医药大学学报, 2017, 37(6): 606-610.
[36] Feller A, Machemer K, Braun E L,. Evolutionary and comparative analysis of MYB and bHLH plant transcription factors [J]., 2011, 66(1): 94-116.
[37] Lee S, Völz R, Song H,. Characterization of the MYB genes reveals insights into their evolutionary conservation, structural diversity, and functional roles in[J]., 2021, 12: 721530.
[38] Jiang A L, Liu Y N, Liu R,. Integrated proteomics and metabolomics analysis provides insights into ganoderic acid biosynthesis in response to methyl jasmonate in[J]., 2019, 20(24): 6116.
[39] Ren A, Qin L, Shi L,. Methyl jasmonate induces ganoderic acid biosynthesis in the basidiomycetous fungus[J]., 2010, 101(17): 6785-6790.
[40] Shi L, Gong L, Zhang X Y,. The regulation of methyl jasmonate on hyphal branching and GA biosynthesis inpartly via ROS generated by NADPH oxidase [J]., 2015, 81: 201-211.
Genome-wide characterization and expression analysis of MYB transcription factor gene family in
CHEN Hong-yu, DONG Shu-ting, GUO Miao-xian, LUO Hong-mei
Engineering Research Center of Chinese Medicine Resource, Ministry of Education, Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China
To discover the MYB transcription factors which related to the regulation on fungal development and secondary metabolsome in, the MYB transcription factor gene family have been mined and identified in the genome of.. In this study, the expression patterns of these genes in different tissues (sclerotium and mycelium) and the relative expression level in the mycelium after treatment by methyl jasmonate (MeJA) were analyzed.Based on the.genome, the MYB gene were identified by Blast and the identification of the conserved domains. The ExPASy protparam tool was used to predict the physicochemical properties of these MYB proteins. The phylogenetictree was constructed by MEGA7.0 software, and the conserved motifs were identified by MEME method. Plant CARE was used to analyze the-acting elements in the promoter regions of these genes. The relative expression levels of these genes were detected by RT-qPCR method.A total of 10 MYB transcription factors with conserved domains were identified in the.genome, among which, four genes belonged to 1R type and 2R type, respectively, and the remaining two genes belonged to 4R type. The phylogenetic analysis and the conserved motif identification showed that the similar conserved motifs were existed in the MYB proteins belonging to the same evolutionary branch. A large number of-elements related to hormones and stress response have been discovered in the promoter regions of these MYB genes. The gene expressional profiles showed that two genes (and) were more highly expressed in mycelium than that in sclerotium, based on the transcriptome data generated from these two tissues. On the contrary,was expressed more abundantly insclerotium. Furthermore, the expression of、和was up-regulated by MeJA induction for 3 h.The MYB transcription factor gene family of.was systematically identified in.genome in this study. This study provides foundation for further identification of the biological functions ofgenes in regulating the development and secondary metabolite biosynthesis in.
(Schw.) Wolf; MYB transcription factor; gene family; bioinformatics analysis; gene expression profiles
R286.12
A
0253 - 2670(2023)01 - 0245 - 09
10.7501/j.issn.0253-2670.2023.01.026
2022-07-07
国家自然科学基金资助项目(81973422);中国医学科学院医学与健康科技创新工程(2021-I2M-1-071)
陈泓宇,硕士研究生,主要从事药用植物和药用真菌次生代谢研究。Tel: 18600286727 E-mail: chenhongyu@implad.ac.cn
通信作者:罗红梅,研究员,研究方向为药用植物次生代谢途径解析。Tel: (010)57833116 E-mail: hmluo@implad.ac.cn
[责任编辑 时圣明]