一株高产纤维素酶菌株的分离及鉴定
刘登辉,胡 闽,赵小斌,危 威,张佑红
武汉工程大学环境生态与生物工程学院,湖北 武汉 430205
我国农作物秸秆资源丰富,是一种可再生的纤维素资源,但由于纤维素结构的难以破坏性,造成纤维素资源的利用率不高。开发利用纤维素资源,有助于解决我们当前面临的环境污染和资源短缺问题[1]。微生物是纤维素酶的主要来源,通过微生物产生的纤维素酶高效催化降解纤维素,使得纤维素类物质糖化,然后进一步发酵生产成生物质能源酒精、有机酸等急需的食品及化工原料[2-4],且由于其生产过程经济环保,能耗低,反应温和等特点是当前提高纤维素利用的重要手段。
纤维素酶分为三类,即内切纤维素酶、外切纤维素酶和β-葡萄糖苷酶。酶复合体作用于纤维素的不同部分,水解机制是通过它们的协同作用将纤维素转化为葡萄糖。目前已被研究的纤维素酶普遍存在着催化效率低,无法达到生产标准的问题。里氏木霉是研究得较为清楚的产纤维素酶菌株,但是其生长量相对较小,产酶量不能满足工业中转化纤维素的需求。因此,开发具有更高效纤维素酶的新菌株,具有重要的工业应用价值,对纤维素类资源的利用具有重要的实际意义[5-6]。本研究旨在从蝗虫肠道内筛选获得一株高产纤维素酶的菌株,用于生物乙醇工业。
1 实验部分
1.1 化学试剂与材料
1.1.1 样本采集蝗虫样本为云南省普洱市江城哈尼族彝族自治县曼滩村采集到的蝗虫[7-9]。
1.1.2 主要试剂羧甲基纤维素钠(CMC-Na)、七叶苷、4-硝基苯基-D-吡喃葡糖苷等化学试剂(分析纯,上海麦克林生化科技有限公司)。
1.1.3 培养基初筛培养基:CMC-Na,20 g/L;Na2HPO4·12H2O,2.5 g/L;KH2PO4,1.5 g/L;蛋 白胨,2.5 g/L;酵母浸粉,0.5 g/L;自然pH值。
刚果红培养基:CMC-Na,1.88 g/L;Na2HPO4·12H2O,2.5 g/L;KH2PO4,0.5 g/L;MgSO4,0.3 g/L;蛋白胨,2.5 g/L;酵母浸粉,0.5 g/L;琼脂20 g/L;刚果红溶液,1 g/L;自然pH值。
PDA培养基:马铃薯浸粉,5 g/L;琼脂粉,14 g/L;葡萄糖,20 g/L。
七叶苷培养基:蛋白胨,10 g/L;酵母浸粉,3 g/L;氯化钠,5 g/L;七叶苷,0.1 g/L;柠檬酸铁铵,0.2 g/L;琼脂粉,15 g/L;自然pH值。
种子培养基:尿素,0.3 g/L;蛋白胨,0.75 g/L;酵母浸粉,0.25 g/L;(NH4)2SO4,1.4 g/L;KH2PO4,2 g/L;CaCl2,0.3 g/L;MgSO4,0.3 g/L;葡萄糖,10 g/L;吐温80,1 mL/L和1mL/L的微量元素,自然pH值,其中,所述微量元素由如下组分组成:5 g/L的FeSO4·7H2O;1.6 g/L的MnSO4·4H2O;1.4 g/L的ZnSO4·7H2O和20 g/L的CoCl2·6H2O。
发酵培养基:CMC-Na,10 g/L;酵母浸粉,5 g/L;蛋 白 胨,10 g/L;MgSO4,0.5 g/L;NaCl,5 g/L;KH2PO4,1 g/L;吐温80,1 mL/L和1 mL/L的微量元素,自然pH值,所述微量元素由如下组分组成:5 g/L的FeSO4·7H2O;1.6 g/L的MnSO4·4H2O,1.4 g/L的ZnSO4·7H2O和20 g/L的CoCl2·6H2O。
1.2 实验方法
1.2.1 产纤维素酶菌株的分离在超净工作台中,用灭菌的接种针挑取活体蝗虫的肠道,放入到添加有适量生理盐水和10个玻璃珠的无菌三角锥形瓶中,充分振荡混匀。取上述菌液以10倍梯度进行稀释。每个梯度各取100 μL菌液加入到CMC-Na初筛平板中,用玻璃涂抹棒将其涂布均匀,待平板上长出大小合适的菌落。
1.2.2 产纤维素酶菌株的筛选将不同菌落分别在CMC-Na复筛培养基上划线,待平板上长出大小合适的单个菌落时,将不同的菌落按10倍梯度进行稀释,每个梯度各取100 μL菌液,分别加入到刚果红鉴别培养基中,28℃培养3 d,把菌体进行刮离,加入质量浓度为1 g/L的刚果红染液染色10~15 min,无菌生理盐水冲洗2~3次,选出能明显产生透明圈的菌株。在平板上用游标卡尺分别测量菌株产生的透明圈直径(D)和菌株的菌落直径(d),并计算出每株菌株的菌径比值H,挑取菌径比值较大的5株菌落反复在固体培养基上进行划线,直至得到纯种单菌落。
透明圈的大小不能确切反映菌株的实际产酶能力,β-葡萄糖苷酶在纤维素降解过程中起至关重要的作用,在筛选出透明圈直径与菌落直径的比值H(D/d)较大的基础上,进一步筛选出β-葡萄糖苷酶酶活较高的菌株[10],其总酶活(滤纸酶活)相对较高,于是将筛选出的上述5株菌株在七叶苷培养基上培养[11],进一步筛选,选择在七叶苷平板上生长颜色相对较深的菌株进行保存。
1.2.3 孢子悬液的制备取一个在PDA平板上生长5 d的菌株F21平板,在超净工作台中向培养皿中倒入适量的无菌水,用三角玻璃涂布棒反复刮式,将孢子刮下,震荡,三角漏斗8层纱布进行过滤,血球计数板显微镜下统计孢子个数,无菌水稀释,调整到所需浓度106/mL,4℃冰箱保存备用[12]。
1.2.4 菌株生长曲线的绘制取1 mL菌株F21的孢子悬液,接种于含有50 mL种子液的250 mL三角锥形瓶中,置于温度为28℃,转速为200 r/min的摇床中振荡培养,共接种33瓶,每天取出3瓶,在真空干燥箱烘干至恒重,称量后取平均值,连续称取11 d,以培养时间天数(d)为横坐标,菌体的干重(mg)为纵坐标,绘制菌株F21的生长曲线图。
1.2.5 粗酶液的制备取1 mL菌株F21新鲜孢子悬液,接种于含有50 mL种子液的250 mL三角锥形瓶中,置于温度为28℃,转速为200 r/min摇床中培养3 d,作为发酵种子液,将发酵种子液按5%体积比的接种量,接种于含有50 mL发酵液的250 mL三角瓶锥形中,28℃、200 r/min摇瓶发酵12 d,每天吸取1.0 mL发酵液,13 000 r/min离心时间2 min,去除沉淀,留取上清液,上清液即为粗酶液。取上清液用于酶活测定。
1.2.6 酶活力测定滤纸酶活力测定参照国家轻工行业标准QB 2583—2003的方法,以Whatman 1号滤纸为反应底物[13]。羧甲基纤维素酶活力测定参照国家轻工行业标准QB 2583—2003的方法[14],以质量浓度2 g/L CMC-Na溶液为反应底物。β-葡萄糖苷酶酶活力测定参照参考文献的方法[11],略有改动,以1 mmol/L pNPG(4-硝基苯基-D-吡喃葡糖苷)溶液为反应底物。滤纸酶活力和羧甲基纤维素酶活力的酶活计算:以1 min催化底物生成1 μmol葡萄糖所需的酶量定义为一个酶活力单位(IU/mL)。β-葡萄糖苷酶活力的酶活计算:单位体积酶反应液每分钟转化相应底物释放1 μmol产物所需的酶量为一个酶活力单位(IU/mL)。
葡萄糖标准曲线的绘制:采用紫外光谱法,配制10 mg/mL葡萄糖标准液,按一定比例稀释后,反应体系中包含1.5 mL柠檬酸缓冲(0.5 mol/L,pH值4.8)、0.5 mL按一定比例稀释后的葡萄糖标准液,加入3 mL DNS试剂沸水浴10 min后取出,快速冷却至室温后,蒸馏水定容至25 mL,吹打混匀。用10 mm比色皿,分光光度计在540 nm波长处测量吸光值。以葡萄糖量为横坐标,以吸光值为纵坐标,绘葡萄糖制标准曲线,获得线性回归方程,y=0.228 23x-0.137 18,R2=0.997
β-葡萄糖苷酶酶活标准曲线的绘制:称取139.1 mg 4-硝基苯酚,先加入适量的蒸馏水至完全溶解,然后定容至100 mL,配制成10 mmol/L的贮备液;用柠檬酸缓冲液(0.5 mol/L,pH值4.8)稀释上述贮备液至1 mmol/L的标准贮备液;按不同浓度,将标准贮备液配制成浓度不同的标准使用液;按β-葡萄糖苷酶酶活测定的方法,测定不同浓度标准使用液对应的吸光值;以标准使用液的浓度为横坐标,对应的吸光值为纵坐标,绘制标准曲线y=1.169 67x-0.007 95,R2=0.999
1.2.7 菌株分子生物学鉴定刮取新活化菌株F21的菌丝,利用酚氯仿法提取菌株的基因组,以菌株的DNA作为模板,采用真菌的通用引物进行PCR扩 增[15-16]。上 游 通 用 引 物ITS1(5′-tccgtaggtgaacctgcgg-3′),下 游 通 用 引 物ITS4(5′-tcctccgcttattgatatgc-3′)购于武汉天一华煜基因科技术有限公司。PCR反应体系(25 μL):2×Es Taq Master Mix(北京天根科技)12.5 μL、菌株F21的DNA模 板1 μL、上游引 物ITS1 1 μL、下游引物ITS4 1 μL、dd H2O 9.5 μL,对照组以加入ddH2O代替DNA模板。PCR扩增条件设定为:94℃,预变性5 min;94℃,变性30 s;56℃,退火30 s;72℃,延伸1 min,35个循环;72℃,延伸10 min,8℃,无穷。PCR扩增出的产物经质量分数为1.2%的琼脂糖凝胶电泳进行检测,其中,Marker DL 15000购自Takara公司。将PCR扩增产物胶回收后送至武汉天一华煜基因科技术有限公司进行测序,得到一条长631 bp的序列,在NCBI上进行BLAST相似性搜索,获取近似典型菌株基因序列,进行序列比对,同时使用MEGA 7.0软件绘制系统发育进化树[17-19]。
2 结果与讨论
2.1 高产纤维素酶活性菌株
采用刚果红染色法从采样的蝗虫体内中共分离获得5株在CMC-Na平板培养基上生长良好的菌株,透明圈直径与菌落圈直径之比H(D/d)及在七叶苷培养基上各菌株平板颜色深度见表1。刚果红平板上菌径比值越大,在一定程度上,反映出菌株内切葡聚糖酶活越高;七叶苷平板上产酶圈颜色越深,在一定程度上,反映出菌株β-葡萄糖苷酶酶活越高。菌株F21的菌径比H值为2.83,相较于其他4株菌株比值略大,同时在七叶苷培养基上其培养基颜色呈红棕色,相较于其他四株菌株颜色较深,最终选择菌径比值较大,培养基颜色较深的菌株F21进行保存,同时进行了菌种保藏。之后把菌株F21选择为研究对象,进行后续实验。
2.2 菌株的形态学特征及生长特性
(1)菌株F21在固体培养基平板上的菌落形态(图1):菌株F21在培养到第4 d时菌落菌丝扩展较快,第5 d菌株就铺满培养皿。菌落特征为圆形,菌落边缘轮纹状,中央为乳白色的棉絮状。
图1 菌株F21的菌落形态Fig.1 Colony morphology of strain F21
(2)菌株F21长有菌丝,菌丝发达,呈放射状生长,有孢子,在40×显微镜下观察孢子短棒形(图2)。
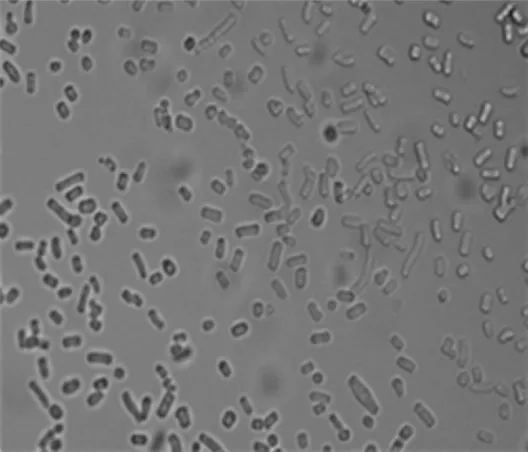
图2 显微镜下菌株F21的孢子形态Fig.2 Spore morphology of strain F21 under microscope
(3)菌株F21在液体发酵培养基中培养数天发酵液变得澄清,摇床培养过程中,菌丝抱团形成菌丝球。
(4)菌株F21生长适温25~28℃,pH值为6.0~7.0,好氧。
2.3 菌株的生长曲线
通过菌株F21的生长曲线(图3)发现菌株F21在种子培养基中培养到第3 d到第4 d时,其干重增加明显,说明其进入快速生长期,这与在平板上观察到的现象较一致,但比平板上较早1 d进入快速生长期,可能与种子培养基的成分更适合菌株生长有关。所以在后续的实验中取培养3 d的种子液按比例接种于发酵培养基中。
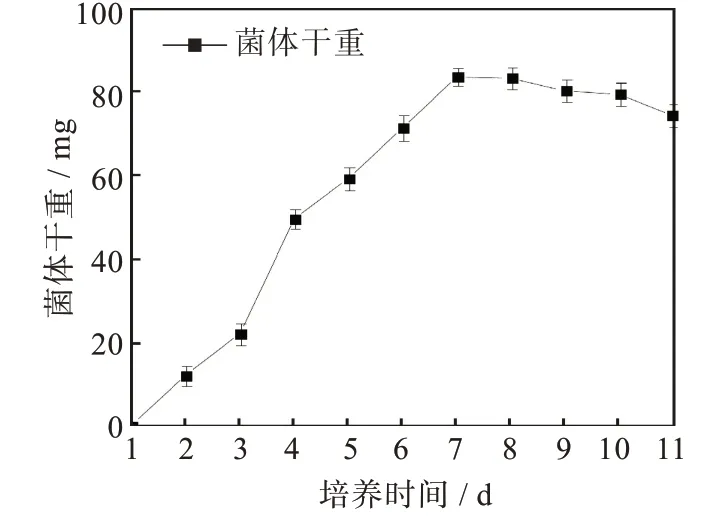
图3 菌株F21的生长曲线Fig.3 Growth curve of strain F21
2.4 菌株产纤维素酶活力
滤纸酶活性可代表纤维素酶对纤维素的整体水解能力,进而结合羧甲基纤维素酶活性和β-葡萄糖苷酶活性大小对菌株F21进行酶活力评价。共摇瓶发酵培养12 d,间隔24 h取样,制备粗酶液,测定菌株F21的酶活力。
菌株F21产生的滤纸酶活性(图4)在发酵培养第3 d出现活力高峰达0.212 IU/mL,羧甲基纤维素酶活性在发酵培养第4 d时达峰值1.593 IU/mL,β-葡萄糖苷酶酶活性(图5)从第2 d开始升高,在第6 d时达到峰值39.069 IU/mL,随之又逐渐下降。
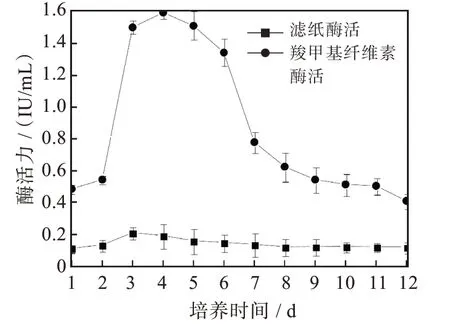
图4 菌株F21的滤纸酶活性和羧甲基纤维素酶活性曲线Fig.4 Filter paper enzyme activity and carboxymethyl cellulase activity of strain F21
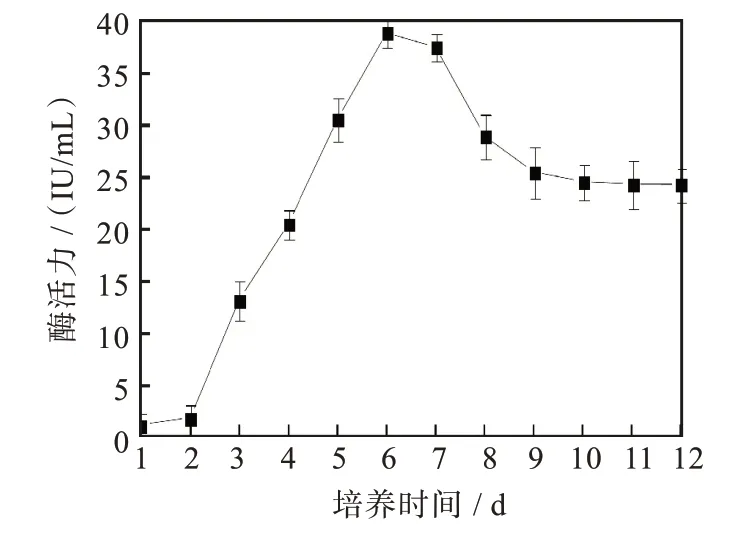
图5 菌株F21的β-葡萄糖苷酶活性曲线Fig.5 β-glucosidase activity of strain F21
2.5 菌株F21的18S rDNA序列分析
以菌株F21的基因组DNA为模板,采用真菌通 用 引 物ITS1/ITS4进 行PCR扩 增,PCR产 物(图6)经测序得到一条长度为631 bp的片段。将片段测序结果在NCBI数据库进行BLAST比对,结果显示与GenBank登录号为MT644869.1的烟管菌(Bjerkandera adusta)相似比例为99.83%。因此,菌株F21在系统发育分类学上属于烟管菌。综合菌株F21的菌落形态和分子生物学鉴定测序结果,确定菌株F21为烟管菌属真菌菌株,命名为Bjerkandera adustaF21。同时将该序列与BlastN比对结果中来源不同的Bjerkandera adusta序列以及同属不同种的ITS序列进行多序列比对分析,利用MEGA7.0软件制作菌株F21系统发育树(图7)。

图6 菌株F21的PCR产物图Fig.6 PCR product graph of strain F21

图7 菌株F21的系统发育树Fig.7 Phylogenetic tree of strain F21
3 结论
本试验从野外采集到的蝗虫肠道内分离筛选出一株产纤维素酶酶活较高的真菌菌株F21,通过形态学和分子生物学鉴定,确定菌株F21属于真菌中的烟管菌(Bjerkandera adusta)。对菌株F21在液体发酵培养基中不同阶段纤维素酶活力测定,结果表明其滤纸酶活最高为0.212 IU/mL,羧甲基纤维素酶活最高为1.593 IU/mL,β-葡萄糖苷酶活最高为39.069 IU/mL。为实现对纤维素资源的高效利用[20],该菌株后续还需要驯化、诱变和基因工程改造等手段提高其纤维素酶活性。

