不同价态钒氧化物的细胞毒性评估
唐 露,路学光 ,毛振娅,施奇武,余修贤,万城渝,彭 穗,刘 波,黄婉霞
(1.四川大学 a.材料科学与工程学院,b.华西医院中药药理研究室,四川 成都 610065;2.成都先进金属材料产业技术研究院股份有限公司,四川 成都 610300)
单斜晶型M相二氧化钒(VO2(M))在摄氏温度约为68 ℃时可发生可逆的绝缘-金属转变(SMT),其电学和光学性质会发生显著变化[1-2],这种特性使其在电光开关器件[3-4]、智能窗口[5-6]、传感器[7]等领域具有巨大的应用潜力。此外,VO2(M)的相变特性还可以通过掺杂离子,如钨离子(W6+)、钼离子(Mo6+)和铌离子(Nb5+)进行改性[8-11],以更适应实际应用。随着应用领域的扩大,VO2(M) 暴露在周围环境中,与人接触的机会也逐渐增加,由此带来的生物安全问题也日益引起关注,其生物毒性研究势在必行。
雨水冲刷下的VO2(M)智能窗口、VO2(M)材料生产过程中排放的污水等途径都会增加环境中的VO2(M)纳米粒子及其与人体接触的机会。在实际应用中,材料自身的生物相容性和细胞毒性是必须考虑的因素。目前,学者们对氧化钒材料的生物毒性进行了实验分析,但大多数研究主要集中在五氧化二钒(V2O5)粉体的细胞毒性和VO2(M)的抗菌性,对离子掺杂改性的VO2(M)和中间价态钒氧化物细胞毒性的研究较少[12-13]。通过对纳米三氧化二钒(V2O3)、VO2(M)粉体的毒性研究[14-16]表明,纳米粒子的理化特性,特别是形貌和粒径与生物毒性有显著关系。Xi等[17]为了确定纳米VO2(M)粉体的体外肺毒性,对比微米级、纳米级VO2(M) 粉体的短期(1 d)和长期(20 d)肺细胞A549毒性,发现在相同条件下暴露在纳米级VO2(M)粉体的细胞活力更低。这些研究表明,钒氧化物的粒度、形状、溶解度、表面特性都影响其细胞毒性[18-19]。此外,钒氧化物的价态也是一个重要的因素[20]。因为在长时间的存放或使用过程中,VO2(M)与空气接触,不可避免地发生氧化现象,所以对多价态钒氧化物的生物安全性进行评估也具有重要的现实意义。
为了对VO2(M)粉体氧化过程中可能形成的多种价态钒氧化物的细胞毒性进行系统性评估,本文中制备VO2(M)、十三氧化六钒(V6O13)、一水合七氧化三钒(V3O7·H2O) 和V2O54种不同价态的钒氧化物纳米粉体,模拟VO2(M)及其氧化过程中可能形成的钒氧化物,研究不同浓度的钒氧化物对小鼠成纤维细胞L929的影响,为评估接触纳米VO2的毒性风险提供参考。
1 材料与方法
1.1 样品制备
以V2O5作为钒源,草酸(C4H6O6)作为还原剂,钨酸(H2WO4)作为W元素掺杂剂,通过原位搅拌辅助水热法制备W掺杂VO2(M)粉体。同时,在搅拌辅助水热法的基础上,通过调整还原剂含量和反应时间制备中间价态钒氧化物V6O13和V3O7·H2O 粉体。通过对上述VO2(M)粉体进行一定条件的热处理获得含有W掺杂的V2O5粉体。多价态钒氧化物纳米粉体的合成示意图如图1所示。

图1 多价态钒氧化物纳米粉体的合成示意图
具体步骤如下:首先,将1.092 g(0.006 mol)V2O5粉末、0.270 g(0.001 8 mol)C4H6O6和一定量的H2WO4加入到70 mL去离子水中,将混合溶液在室温下使用恒定磁力搅拌器搅拌1 h。然后,将所得混合液转移至100 mL石英内衬的多功能水热反应釜中,将反应釜的升温程序设置为以升温速率2 ℃/min加热至240 ℃,保温开始时启动原位搅拌装置,搅拌速率设置为500 r/min。保温结束并待水热釜自然冷却后,将所得黑色沉淀物用大量去离子水和乙醇清洗数次。最后,在温度为 70 ℃的恒温干燥箱中干燥制得产物,样品编号为VO-1。通过调整还原剂含量和反应时间制备VO2(M)粉体及中间价态钒氧化物V6O13、V3O7·H2O粉体,并通过对上述VO2(M)粉体进行一定条件的热处理获得含有W掺杂V2O5粉体,样品编号依次为VO-2、VO-3、VO-4。具体制备条件见表1。

表1 实验用样品的制备条件
1.2 材料表征测试
利用美国FEI公司生产的Inspect F50型扫描电子显微镜(SEM)对样品的微观形貌进行表征;利用德国布鲁克公司生产的D/MAX2500型X射线衍射仪(XRD)对样品的物相组成进行表征,并使用JADE软件对数据进行处理并确定相应的物相;利用英国Kratos公司生产的Xsam800型X射线光电子能谱(XPS)对样品的化学价态进行分析。
1.3 小鼠成纤维细胞L929的毒性实验
以L929细胞为研究对象,评估VO-1、VO-2、VO-3和VO-4这4种钒氧化物样品的细胞毒性。将粉体材料经超声分散后,加入完全培养基配置成质量浓度分别为1、2、5、10、20、50、100、200、500 mg/L共9个浓度梯度的浸提液,与生长状态良好的L929细胞共培养24 h,随后对样品的细胞毒性进行检测。
选择细胞活性指标CCK-8试剂盒,检测孵化后的活细胞数量,可以间接反映多价态钒氧化物的细胞毒性。按照细胞形态观察的步骤对L929细胞进行不同浓度药物处理,每个浓度取3个平行组,标记后置于细胞培养箱中24 h。取出CCK-8试剂置于水浴箱中预热,并在避光条件下与完全培养基混合得到质量分数为5%的CCK-8培养液。将培养板取出,吸出含样品的培养基,加入配置的CCK-8培养液,在培养箱中孵育2 h;采用多功能酶标仪在波长为450 nm的条件下进行吸光度检测,根据测试数据计算得到细胞存活率,表征细胞活性,间接反映样品的细胞毒性。细胞存活率γ计算公式为
γ=(As-Ab)/(Ac-Ab)×100%,
(1)
式中:As为实验孔(细胞、CCK-8培养液、待测物)的吸光度;Ac为对照孔(细胞、CCK-8培养液)的吸光度;Ab为空白孔(CCK-8培养液)的吸光度。
2 结果与讨论
2.1 多价态钒氧化物纳米颗粒表征
不同价态钒氧化物的样品VO-1、VO-2、VO-3和VO-4的微观形貌和X射线衍射(XRD)谱图如图2所示。由图2(a)—(d)可以看出,不同样品的颗粒形貌都趋于棒状,直径为几百纳米不等,长度不一,颗粒形貌与文献[11]中报道的类似。从图2(e)中可以发现,样品VO-1、VO-4的结晶度均较高,且衍射峰分别与VO2(M)标准粉末衍射(PDF)卡片(JCPDS No.82-0661)和V2O5标准PDF卡片(JCPDS No.89-0612)完全匹配,没有发现杂质相。由实验可知,在水热环境下V2O5经C4H6O6还原成为VO2的过程可能为V2O5→V3O7·H2O或V6O13→VO2,中间相V3O7·H2O和V6O13通常以混合物的状态出现,因此VO-2样品主相为V6O13(JCPDS No.71-2235),有少量的VO2(M)的衍射峰出现,表明小部分V5+被直接还原成V4+。样品VO-3的衍射峰基本与V3O7·H2O的标准PDF卡片(JCPDS No.28-1433)匹配良好,但是也存在少量的V6O13的衍射峰。由于V2O5还原过程中的中间相不稳定,较难获得完全纯相,因此在后续多价态钒氧化物细胞毒性研究时将样品VO-2、VO-3的主相作为不同价态钒氧化物进行讨论,即样品VO-2对应V6O13,样品VO-3对应V3O7·H2O。
根据图3所示的不同价态钒氧化物的XPS谱图和通过V 2p的峰值使用带有XPS Peak 4.1软件的Shirley函数拟合样品VO-1、VO-2、VO-3、VO-4的V 2p3/2峰的结合能(表2),结合XRD分析可以看出,所有样品应含2种钒价态,即+4价(结合能为515.7~516.2 eV)和+5价(结合能为516.8~517.5 eV)。计算了样品中的V4+、V5+的比例,结果如表2所示。
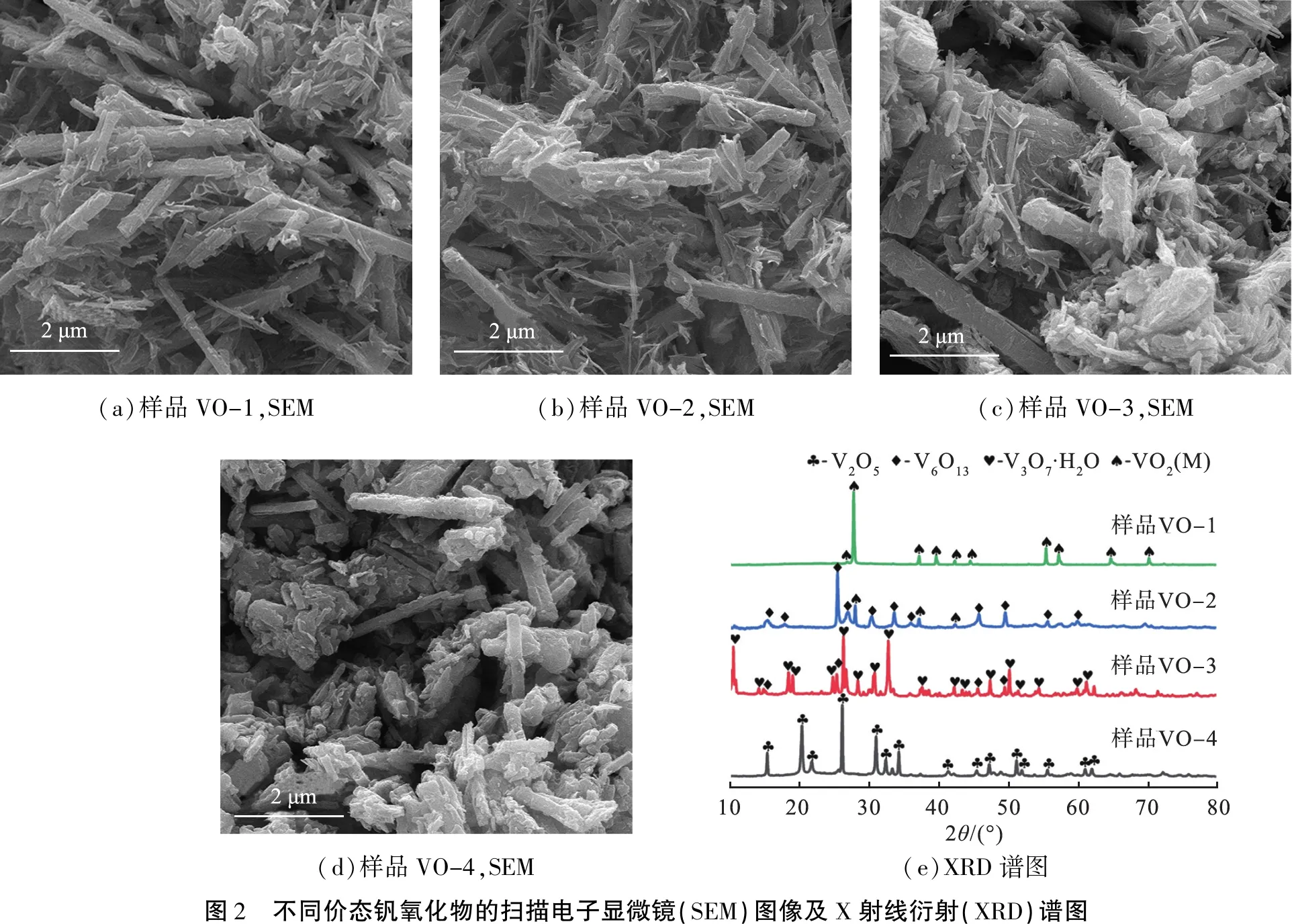
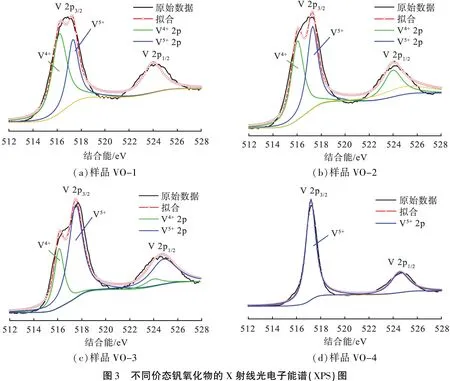
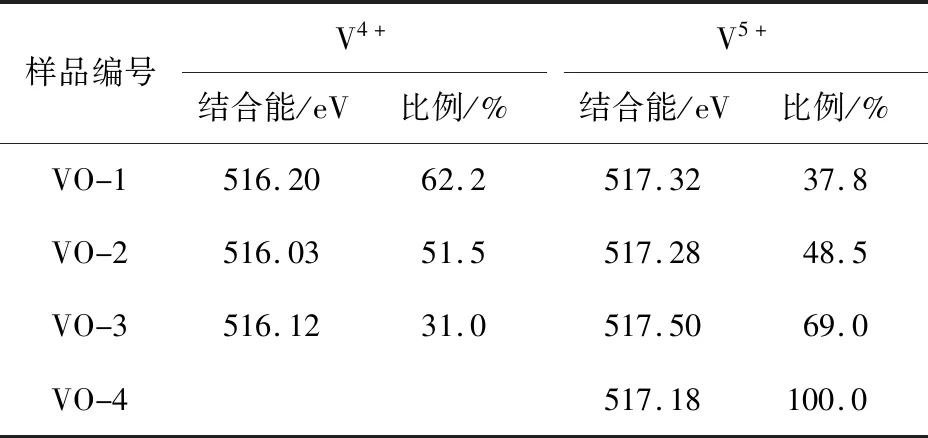
表2 不同价态钒氧化物拟合的V 2p3/2峰的结合能和峰面积所占比例
2.2 不同浓度样品的细胞形态变化
利用倒置相差显微镜观察细胞形态,对不同浓度的多价态钒氧化物的细胞毒性进行评估。正常的L929细胞多呈规则的短梭形,当外界环境发生变化时其形状会随之改变。L929细胞在添加了质量浓度为1、10、50 mg/L的不同价态钒氧化物的培养基内培养24 h后的细胞形态如图4所示。在倒置相差显微镜下观察发现,经不同浓度VO2(M)处理的L929细胞[图4(a)、(b)]大多数呈短梭形,细胞贴壁生长,折光性良好,且随着VO2(M)浓度的增大,细胞密度没有明显下降,表明在VO2(M)的质量浓度为1、10、50 mg/L时其细胞毒性较低。根据以往的研究结果可知,粉体材料可以通过细胞的吞噬作用进入到细胞内部,从而对细胞形态和生物学功能产生影响。从图4(c)可以看出,VO2(M)的质量浓度增加至50 mg/L,L929细胞内出现大量聚集的VO2(M)颗粒。与VO2(M)组相比,不同浓度V6O13[见图4(d)、(e)、(f)]以及V3O7·H2O[见图4(g)、(h)、(i)]与L929细胞孵化24 h后,细胞形态呈现为正常的短梭形和死亡的球形共存,随着样品浓度的增大,细胞数量有所减少,细胞密度降低,形状由梭形变为球形的细胞比例有所增加,可见V6O13和V3O7·H2O均具有一定程度的细胞毒性反应,且随样品浓度的增加而毒性增强。从图4(j)、(k)、(l)中可以看出,V2O5的质量浓度分别为1、10 mg/L的培养基处理的L929细胞多数出现圆缩、死亡,并且随着V2O5浓度的增加,细胞数量明显减少,当V2O5的质量浓度为50 mg/L时,L929细胞密度很小并且绝大多数细胞呈球形,不同浓度的V2O5均呈现明显的细胞毒性反应,高浓度的V2O5造成绝大多数细胞死亡。

从细胞形态学角度观察分析可知,VO2(M)的质量浓度分别为1、10、50 mg/L的培养基与L929细胞共培养24 h后,仍有多数细胞呈正常的梭形,表明VO2(M)的细胞毒性较低;不同浓度的V6O13、V3O7·H2O和V2O5与L929细胞共培养24 h后均有一定量的细胞形态出现圆缩,即表现出一定程度的细胞毒性,其中经较高浓度V2O5处理后的细胞圆缩最为严重,表明其细胞毒性最强。
2.3 不同浓度样品的细胞毒性测试
图5所示为不同浓度的4种价态钒氧化物处理 24 h后的L929细胞活性。从图中可以看到,经过不同浓度的VO2(M)、V6O13、V3O7·H2O和V2O5处理24 h后,L929细胞活性随着样品价态的增加、浓度的增大呈依赖性降低,表明钒氧化物的细胞毒性呈价态、浓度依赖性增加。在材料浸提液质量浓度较低(1、2、5 mg/L)时,4种价态钒氧化物处理后的L929细胞存活率均在 80%以上,可以推断低浓度的多价态钒氧化物的细胞毒性均较低。当质量浓度增加至10 mg/L及以上时,V6O13、V3O7·H2O和V2O5处理过的L929细胞活性出现骤降,活细胞数量随着样品浓度的增加大幅减少,表明样品的细胞毒性随着浓度的增大而增大。从图中还可以看出,在样品质量浓度为10 mg/L及以上的任一浓度值时,经处理后L929细胞的细胞活性在不同价态钒氧化物中由强到弱的顺序为VO2(M)、V6O13、V3O7·H2O、V2O5,表明钒氧化物的细胞毒性随着价态的增加而增大。与其他钒氧化物相比,经质量浓度小于100 mg/L的VO2(M)处理的L929细胞的存活率无明显变化,均为90%以上,表明质量浓度小于100 mg/L时VO2(M)的细胞毒性很低。当VO2(M)的质量浓度增加至200 mg/L时,L929细胞存活率降至80%以下,VO2(M)开始表现出一定的细胞毒性。当VO2(M)的质量浓度达到500 mg/L时,L929细胞存活率直接降低到45%,VO2(M)表现出明显的细胞毒性。总体来说,L929细胞活性随着钒氧化物价态的增加和浓度的增大而降低,表明样品的细胞毒性随价态的增加和浓度的增大而增强。
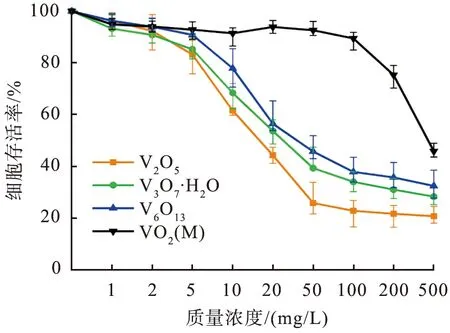
图5 不同浓度的多价态钒氧化物处理24 h后的小鼠成纤维细胞L929的细胞活性
3 结语
本文中采用原位搅拌辅助水热法和热处理方法制备了4种价态的钒氧化物,通过细胞形态观察和细胞活性检测(CCK-8试剂)2种方式研究了不同价态、不同浓度的钒氧化物对L929细胞的毒性。结果表明,细胞毒性与样品的浓度和价态有很大关系。对于孵化24 h的L929细胞,当钒氧化物的质量浓度小于5 mg/L时,细胞存活率均在80%以上,细胞毒性较低;当钒氧化物的质量浓度在大于5 mg/L的任一值时,随着钒离子价态增加,细胞存活率降低,细胞毒性增大;当样品浓度一致时,细胞活性在不同价态钒氧化物中由强到弱的顺序为VO2(M)、V6O13、V3O7·H2O、V2O5,说明细胞毒性随氧化钒的价态的增加而增强。随着VO2应用领域的逐步扩大,VO2暴露于周围环境和与人接触的可能性也逐渐增加,因此,也需要系统地评估VO2暴露引起的生物安全问题。本文中研究结果为评估VO2(M)在生产和生活中可能存在的毒性风险提供了参考。

