伊犁地区牛源大肠埃希菌血清分型和ERIC-PCR分型研究
刘英玉,张 妍,刘俊飞,吾买尔江·牙合甫,张晓红,姚 刚*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.昌吉天康畜牧科技有限公司,新疆昌吉 831100)
大肠埃希菌(Escherichiacoli,E.coli)在自然界中广泛存在,其抗原十分复杂,且变异性大,肉牛产业链中大肠埃希菌污染的关键环节是粪便、饲草料、屠宰加工环节,通过鉴定某地区肉牛产业链中大肠埃希菌的血清型和优势基因型,为该地区大肠埃希菌病的防治提供科学数据。目前常采用大肠埃希菌O抗原血清来进行血清分型,常用的血清学检测方法有玻片凝集试验、乳胶凝集试验和ELISA。玻片凝集试验是通过抗血清与抗原发生凝集反应,从而鉴定其血清型。郝彦龙等[1]报道新疆北疆地区致犊牛腹泻大肠埃希菌的优势血清型为O101、O6、O114和O78。不同地域和不同时间段的大肠埃希菌血清型存在差异。表型易受环境变化而发生变异,从而给菌株分型鉴定带来困难,可用基因分型方法获得指纹图谱,从而确定菌株之间的亲缘关系。庄孝飞等[2]证实,肠杆菌基因间重复共有序列-聚合酶链反应(Enterobacterial repetitive intergenic consensus-PCR,ERIC-PCR)对不同血清型具有快速、高效分型的优势,同时90株不同来源肠炎沙门菌也阐释了ERIC-PCR对高同源性血清型菌株亚型分型的局限性。ERIC-PCR对于确定暴发流行,追踪传染源及可能的传播途径,确定同一病人反复感染是源于复发或再感染,明确某一菌株与某些临床表现的相关性,增强对感染性疾病的流行病学认识等方面有重要意义。本研究对伊犁地区某规模化肉牛养殖场饲草料和粪便及屠宰加工环节中分离鉴定的224株大肠埃希菌采用O抗原多价血清进行初步检测,然后对多价4和多价5的大肠埃希菌进行单价PCR(O7、O39、O5、O114、O116、O6、O9、O30、O55)的扩增,同时进行ERIC-PCR的基因分型。从整体上分析伊犁地区肉牛产业链中牛源大肠埃希菌的优势血清型分布情况,对比分析PCR检测多价4和多价5大肠埃希菌中血清型和基因分型的存在情况和遗传关系。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠埃希菌CICC21530标准株,新疆农业大学动医学院况玲教授提供;试验菌株224株,均为前期试验[3]分离鉴定所得,其中粪样中大肠埃希菌164株,饲草料中肠埃希菌48株,屠宰加工环节样品[操作用具(刀、围裙、手、传送带),胴体表面,牛肉]中大肠埃希菌12株。
1.1.2 主要仪器 电热恒温培养箱,上海一恒科学仪器有限公司产品;YJ-875医用净化工作台,苏州净化设备公司产品;THZ-02型台式恒温振荡器,中国科学院新疆分院科学仪器厂产品;LDZX-50KB型立式压力蒸汽灭菌器,上海申安医疗器械厂产品;Bio-rad T100梯度PCR仪、移液器、高速离心机,德国Eppendorf公司产品;三洋制冰机,日本三洋有限公司产品;微波炉,广东美的电器有限公司产品;电子天平,梅特勒-托利多仪器有限公司产品;凝胶成像仪,美国伯乐公司产品;水平电泳槽、DYY-6C型电泳仪,北京六一仪器厂产品。
1.1.3 主要试剂 麦康凯培养基,北京奥博星生物技术有限责任公司产品;TaqMasterMix、DNA 100 Marker、琼脂糖等,新疆伟博鑫生物有限公司产品;溴化乙锭(EB),北京欣经科生物技术公司产品。O抗原多价血清,天津生物芯片技术有限责任公司产品。
1.2 方法
1.2.1 菌株的分离纯化 大肠埃希菌的检出率较高,参考GB/T18869—2002和GB/T4789.3—2016进行分离,在伊红美蓝培养基和麦康凯琼脂中进行鉴定和纯化[3]。
1.2.2 玻片凝集试验 制备浓稠菌悬液,采用玻片凝集试验检测牛源大肠埃希菌分离菌株的21种O抗原多价血清。同时做生理盐水对照。1 min~2 min内出现明显凝集者为阳性反应,呈均匀浑浊者为阴性。
1.2.3 PCR检测
1.2.3.1 PCR扩增引物和试剂 引物参考Atsushi的单价血清PCR引物设计方法[4],参照曹芸[5]的ERIC-PCR引物设计方法,由上海生工生物工程技术服务有限公司合成(表1),用1×TAE(10 mmol/L Tri-HCl,1 mmol/L EDTA,pH8.0)稀释引物为使用浓度10 μmol/L或20 μmol/L。
1.2.3.2 PCR检测 采用煮沸法制备细菌DNA模板,离心后收集上清。PCR反应体系共25 μL:TaqMaster Mix 12.5 μL,上游引物和下游引物各1 μL,细菌DNA 2 μL,灭菌双蒸水8.5 μL。PCR反应条件:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,共35个循环;72℃ 10 min。PCR产物保存于16℃。
ERIC-PCR 反应体系25 μL:12.5 μLTaqMaster Mix,1.5 μL 20 μmol/L ERIC1R,1.5 μL 20 μmol/L ERIC2,2 μL模板,7.5 μL灭菌双蒸水。反应条件:94 ℃ 5 min;94℃ 30 s,50 ℃ 1 min,72 ℃ 2min,共35个循环;72 ℃ 10 min,4 ℃结束反应。

表1 单价血清PCR引物序列和ERIC-PCR引物序列及扩增长度
注:-.无此项内容。
Note: -.None of this content.
1.2.3.3 琼脂糖凝胶电泳 PCR产物于10 g/L琼脂糖凝胶电泳,电压180 V。ERIC-PCR产物于1.5 g/L琼脂糖凝胶电泳,电压70 V。凝胶用EB染色,通过凝胶成像系统进行拍照并扫描保存。
1.2.4 数据分析 采用Bio Numerics软件的非加权配对平均法(Unweighted Pair Group Method with Arithmetic Mean,UPGMA)对ERIC-PCR指纹图谱进行分析,条件位置差异容许度选择1.5%,优化值1.5%,相似系数使用Dice系数(F值)表示。公式为:F=2nxy/(nx+ny)。其中,nx表示菌株X的条带数,ny表示菌株Y的条带数,nxy表示菌株X和Y相同的电泳条带数,F值得数在0~1之间,值越大则表示同源程度越高。同源度80%以上者为同一亚型,小于80%者为不同的基因亚型[6-7]。
2 结果
2.1 O抗原多价血清菌株检测
用大肠埃希菌O抗原多价血清分别检测粪样中大肠埃希菌164株、饲草料中大肠埃希菌48株及屠宰加工环节样品中大肠埃希菌12株的血清型,检测结果显示,菌株存在较多的交叉血清型约50余株。有51株未检出血清型,占O抗原多价血清检出的18.40%(图1)。检测的大肠埃希菌以多价1和多价4、多价5、多价6、多价14、多价15、多价18、多价19的菌株较多,其中多价4、多价5、多价6、多价19均超过5%的检测率。
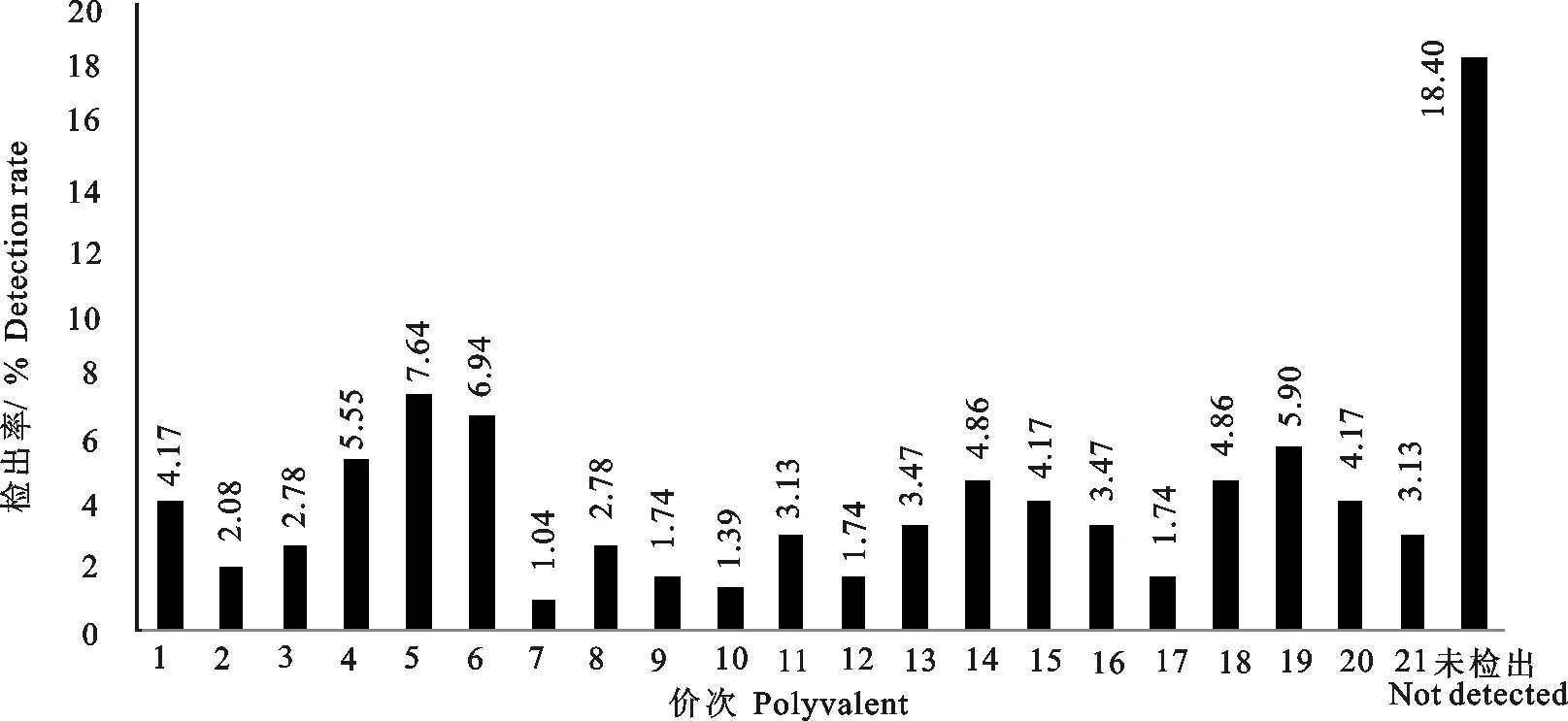
图1 牛源大肠埃希菌多价O抗原血清型的检出率
2.2 单价血清型PCR扩增多价4的检测
用O7、O39、O5、O114、O116血清型的引物分别扩增多价4血清型的16株大肠埃希菌,根据PCR检测的目的条带大小来判定。O7血清型的引物和O39血清型的引物没有扩增出阳性条带。O5血清型的引物扩增出目的条带大小为566 bp,多价4的菌株中有2株菌(262n、354n)扩增出目的条带大小为566 bp的DNA片段(图2A)。O114血清型的引物扩增出目的条带大小为553 bp,多价4的菌株中有3株菌(69n、203n、262n)扩增出目的条带大小为553 bp的DNA片段(图2B)。O116血清型的引物扩增出目的条带大小为156 bp,发现多价4的菌株中有4株菌(203n、32n、105s、56s)扩增出目的条带大小为156 bp的DNA片段(图2C)。
2.3 单价血清型PCR扩增多价5的检测
用O6、O9、O30、O55引物分别扩增多价O抗原血清O5的22株菌,根据PCR检测的目的条带大小来判定。O6血清型的引物扩增出目的条带大小为783 bp(图3),多价5的菌株中有6株菌(262n、220n、73n、28n、354n、69n)扩增出目的条带大小为783 bp的DNA片段。O9血清型的引物扩增出目的条带大小为1 235 bp,多价5的菌株中有2株菌(295n和69n)扩增出目的条带大小为1 235 bp的DNA片段(图3)。其中菌株69n属于交叉血清型,同时扩增出血清型的O6和O9。O30和O55血清型的引物没有扩增出目的条带。
2.4 多价4和多价5大肠埃希菌的ERIC-PCR基因分型图谱
将O抗原多价4和多价5血清型的38株大肠埃希菌进行ERIC-PCR扩增、电泳。ERIC-PCR指纹图谱显示有7株菌株没有扩增出条带,其他菌株扩增出2条~6 条条带,大小在250 bp~2 000 bp,产生的DNA 指纹图谱呈现出多态性(图4和图5)。

A.O5;B.O114;C.O116;M.DNA 标准DL 2 000;N.阴性对照;1.354n;2.203n;3.32n;4.105S;5.56S
A.O5;B.O114;C.O116;M.DNA Marker DL 2 000;N.Negetive control;1.354n;2.203n;3.32n;4.105S;5.56S
图2引物扩增的目的条带
Fig.2 The target bands of primers amplification
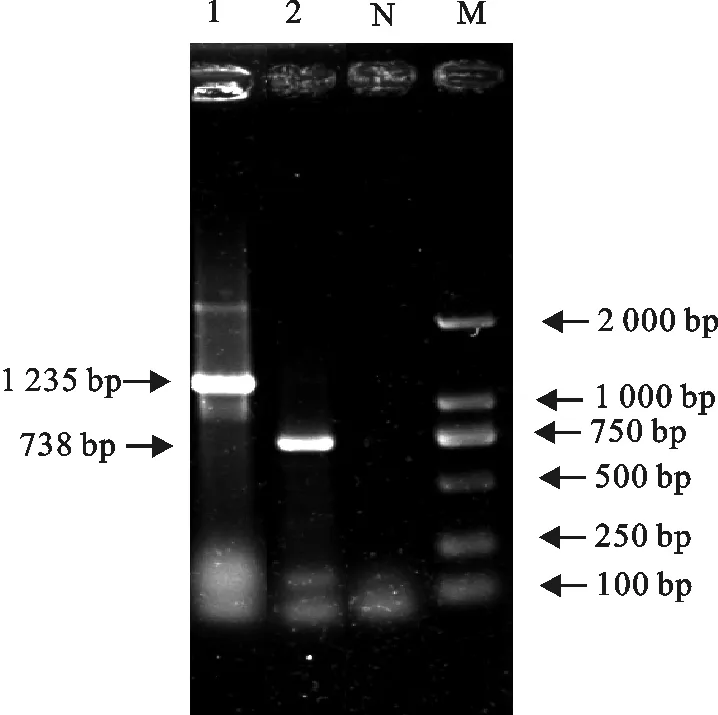
M.DNA 标准DL 2 000;N.阴性对照;1.295 n;2.354 n
M.DNA Marker DL 2 000;N.Negetive control;1.295 n;2.354 n
图3血清型O6和O9大肠埃希菌引物扩增的目的条带
Fig.3 The target bands of O6 and O9E.coliserotypes by primers amplification
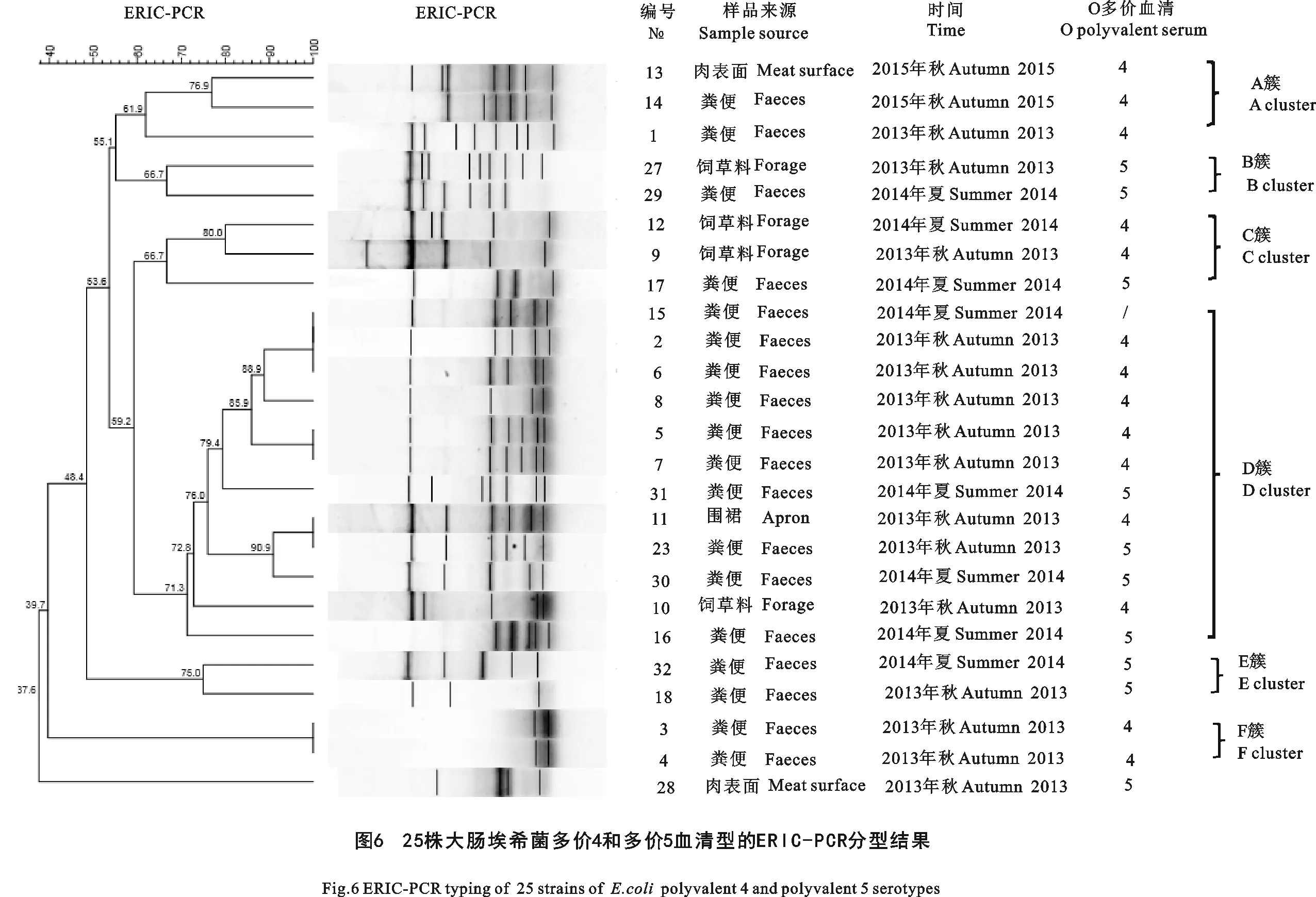
2.5 多价4和多价5大肠埃希菌的ERIC-PCR基因分型进化分析
将产生的DNA指纹图谱去除6株交叉血清型,通过Bio Numerics软件绘制成UPGMA聚类树产生了25种DNA指纹图,并进行遗传进化关系分析(图6)。25株多价4和多价5血清型的大肠埃希菌有13种基因型,分成6簇,相似性在59%~100%。同种多价在一个簇,D簇包括12株菌,同源性在70%以上。加工环节5-w与粪便72n的同源性为100%,其来源相同菌株。而加工环节R-21与其他簇的菌株之间相似性小于40%,其亲缘关系最远。
3 讨论
在大肠埃希菌O抗原多价血清型检测过程中,有些菌株的O抗原能够与O抗原多价血清产生凝集反应,且在进行O抗原单价血清型的PCR检测过程中,也存在一些菌株能够同时扩增出多个目的条带。在鉴定过程中,发现有些菌株的O抗原能够与多个单因子血清进行凝集反应,这和王文豪等[8]报道的一致。与多个多价血清发生凝集的菌株可能存在多种表面抗原,且这些表面抗原可能具有某种共同的特性。据报道,银川地区的奶牛中存在较多O10、O53、O92、O101、O158 血清型的大肠埃希菌,内蒙古奶牛场粪便样品中大肠埃希菌以O18、O146和O152为优势血清型,新疆北疆地区致犊牛腹泻中大肠埃希菌以O101、O6、O114、O78为优势血清型[1]。伊犁地区肉牛产业链中大肠埃希菌多价O血清以多价1和多价4、多价5、多价6、多价14、多价15、多价18、多价19为主,不同血清型的大肠埃希菌污染存在差异。其中多价4和多价5的菌株中以O5、O114、O116、O6和O9血清型为主。与新疆地区报道的犊牛腹泻优势血清型的检测结果存在相同血清型,但是个别菌株存在交叉血清型。
ERIC-PCR是目前常用的一种简便、快速的基因分型技术,其分辨率较强,结果可与细菌分子生物学分型技术的“金标准”PFGE分型有一定相关性[9-10]。在PFGE、Sau-PCR、ERIC-PCR等方法中,ERIC-PCR花费的时间和成本最低,是基层单位进行初期溯源分型的首选方法[11]。Warriner K等[12]成功地应用ERIC-PCR来追踪猪肉屠宰加工线上大肠埃希菌的污染源头。Wang H等[13]也成功地应用ERIC-PCR追踪了鸡肉屠宰加工线上沙门菌的污染源头。高宇等[14]应用ERIC-PCR技术分析了湖北省患病水产养殖动物分离的91株嗜水气单胞菌在各个地区之间的亲缘关系和基因多样性。本文中部分菌株没有扩增出ERIC-PCR指纹图谱,Bio Numerics软件分析多价4和多价5大肠埃希菌的遗传进化关系呈现多样性。多价4和多价5大肠埃希菌存在13种基因型,同源性在59%~100%,可以分成6簇。整体上同种多价在一个簇,D簇有12株菌,同源性在70%以上。通过分析可以发现ERIC-PCR基于基因组上的特定重复序列能够很好地把不同来源的大肠埃希菌进行区分和归类,进而达到溯源的目的。本研究发现多价4和多价5菌株以O5、O114、O116、O6和O9的同种血清型的不同菌株其基因型不在一个簇内,即某地区的是同种血清型其基因型存在差异是不同的。
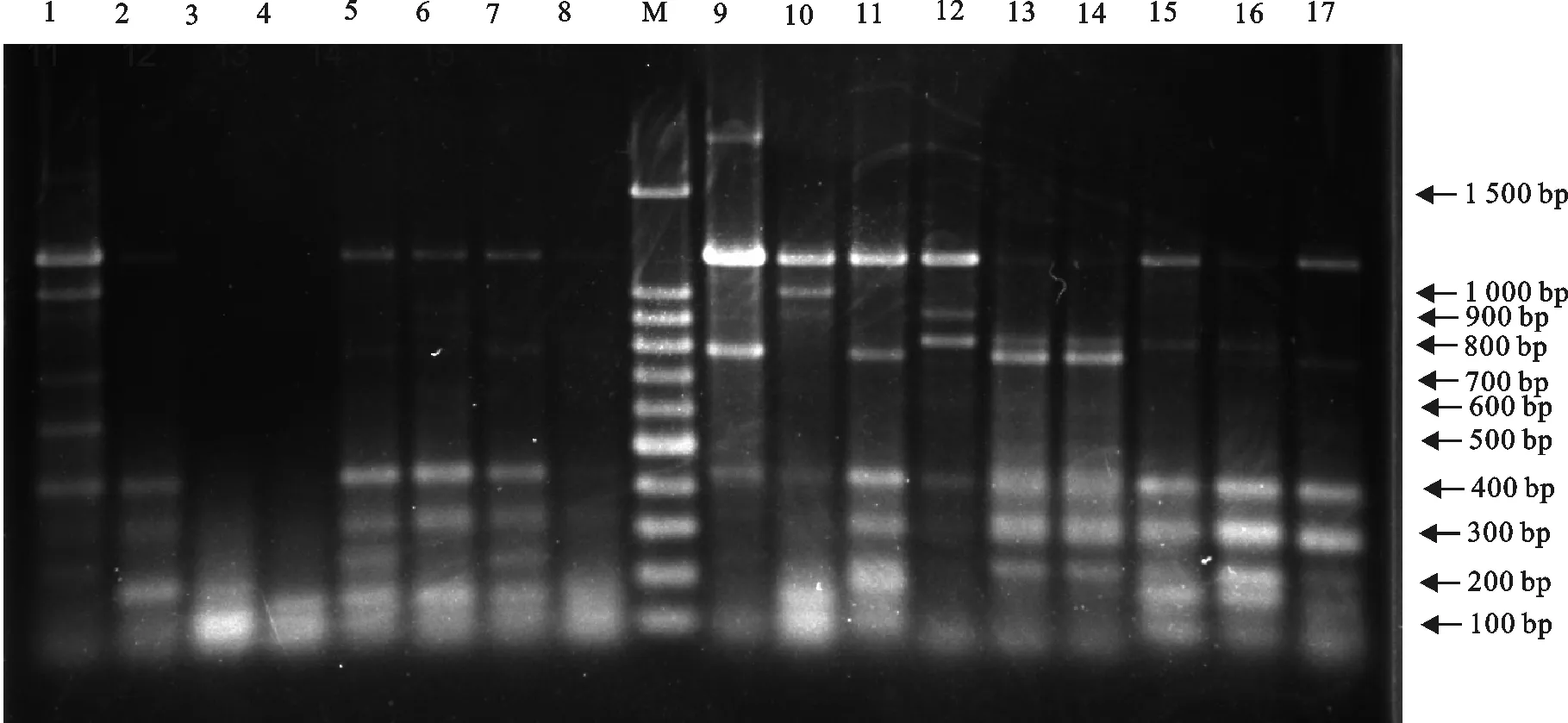
M.DNA标准DL 1 500; 1~14、16、17.大肠埃希菌多价4血清型的ERIC-PCR指纹图谱;15.大肠埃希菌检测出的O157的ERIC-PCR指纹图谱
M.DNA Marker DL1 500; 1-14,16,17.E.colipolyvalent 4 serotypes of ERIC-PCR fingerprinting;15.O157E.colipolyvalent 4 serotypes of ERIC-PCR fingerprinting
图4大肠埃希菌O抗原多价4的ERIC-PCR指纹图谱
Fig.4 ERIC-PCR fingerprint of polyvalent 4 ofE.coliO antigen
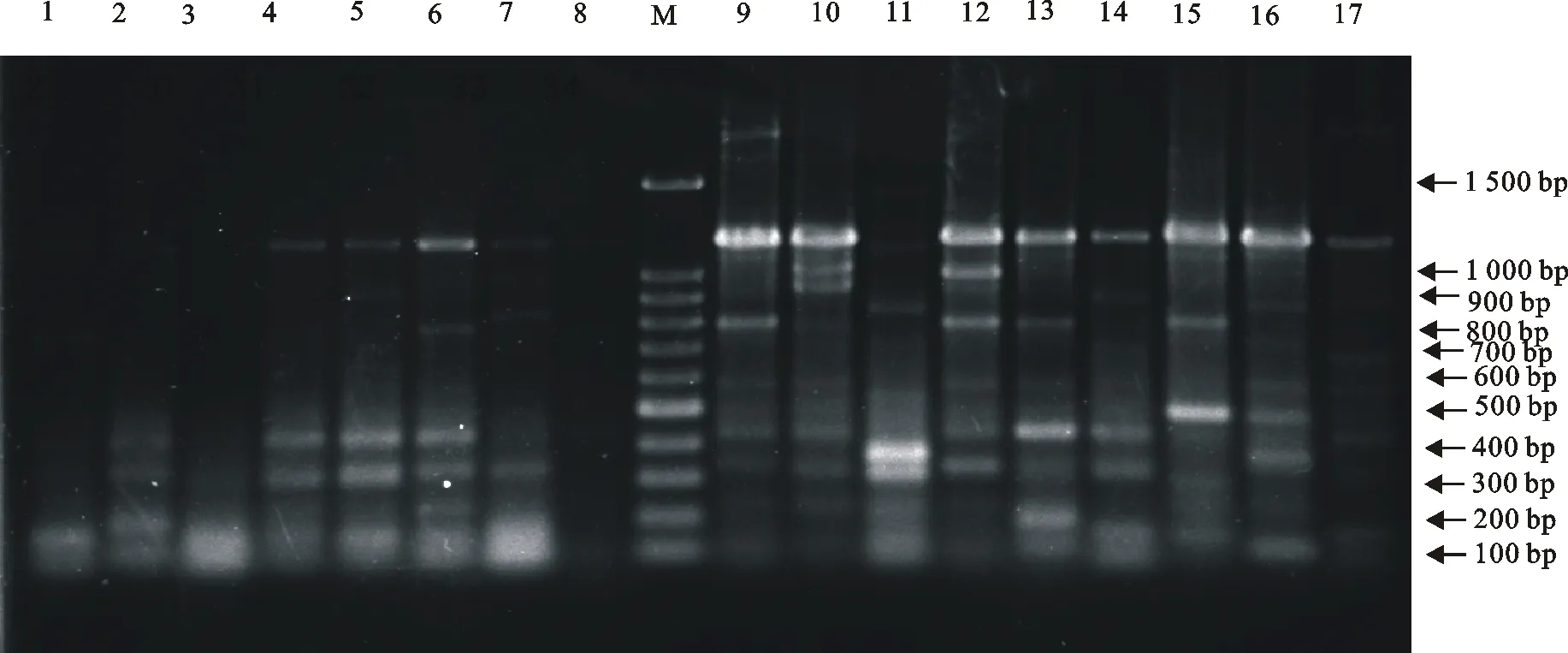
M.DNA标准DL 1 500; 18~34.大肠埃希菌多价5血清型的ERIC-PCR指纹图谱
M.DNA Marker DL 1 500;18-34.E.colipolyvalent 5 serotypes of ERIC-PCR fingerprinting
图5大肠埃希菌O抗原多价5的ERIC-PCR指纹图谱
Fig.5 ERIC-PCR fingerprint of polyvalent 5 ofE.coliO antigen
[1] 郝彦龙,剡根强,王静梅,等.新疆北疆地区致犊牛腹泻大肠杆菌的分离鉴定及部分生物学特性[J].中国兽医学报,2012,32(6):848-851.
[2] 庄孝飞,周秀娟,许学斌,等.2008-2012年上海市肠炎沙门氏菌分离株毒力基因筛查与ERIC-PCR分型[J].食品科学,2015,14(3):165-170.
[3] 刘英玉,杨 舟,吾买尔江·牙合甫,等.新疆伊犁某肉牛场大肠埃希菌及其毒力基因的检测[J].动物医学进展,2016,37(4):45-48.
[4] Atsushi I,Sunao I,Kazuko S,et al.EscherichiacoliO-genotyping PCR:a comprehensive and practical platform for molecular O serogrouping[J].J Clin Microbiol,2015,53(8):2427-2432.
[5] 曹 芸.检测副猪嗜血杆菌的乳胶凝集试验及ERIC-PCR方法的建立与应用[D].湖北武汉:华中农业大学,2009.
[6] 伍晓锋,黎毅敏,卓 超,等.18株铜绿假单胞菌的耐药谱和ERIC-PCR分型[J].中国抗生素杂志,2007,32(9):560-563.
[7] 韩海红.生食贝类中副溶血性弧菌污染水平调查、定量风险评估和分离菌株特征分析[D].北京:中国疾病预防控制中心,2015.
[8] 王文豪,苏丹萍,张丹琳,等.华南地区致病性猪大肠杆菌的鉴定和血清型分布[J].中国兽医杂志,2013,49(4):33-34.
[9] 李永丽,应春妹,陈艺升.ERIC-PCR技术在鲍曼不动杆菌基因分型中的应用评估[J].检验医学,2013,28(7):621-624.
[10] Fendri I,Hassena A B,Grosset N,et al.Genetic diversity of food-isolatedSalmonellastrains through pulsed field gel electrophoresis (PFGE) and enterobacterial repetitive intergenic consensus (ERIC-PCR)[J].PLoS One,2013,8(12):e81315-e81315.
[11] 王秋艳.三种基因分型技术在病原微生物溯源方面的应用[D].广东广州:华南理工大学,2010.
[12] Warriner K,Aldsworth T G,Kaur S,et al.Cross-contamination of carcasses and equipment during pork processing[J].J Appl Microbiol,2002,93(1):169-177.
[13] Wang H,Shu R,Zhao Y,et al.Analysis of ERIC-PCR genomic polymorphism ofSalmonellaisolates from chicken slaughter line[J].Eur Food Res Technol,2014,239(3):543-548.
[14] 高 宇,贾 丹,田 甜,等.湖北地区91株嗜水气单胞菌ERIC-PCR指纹图谱分型[J].云南农业大学学报:自然科学版,2016,31(6):1022-1030.

