酸碱中和滴定曲线的新变化
王 琴
(山东省邹城市第一中学)
酸碱中和滴定曲线的分析是高考的重、难点之一.传统试题中的酸碱中和滴定曲线主要考查溶液酸碱性的判断、弱酸的电离常数计算、溶液中各离子浓度大小比较、水的电离变化等.近年酸碱中和滴定曲线的考查点,如溶液的pH 变化、溶液中各离子浓度的负对数变化曲线等,由于溶液离子种类较多,曲线数目多,分析难度增大,成为考试的热点.解决此类问题可以从以下几个方面入手.
1 判断曲线表示的离子种类
酸碱中和滴定过程中,溶液的离子数目较多,特别是在二元弱酸中和的过程中出现弱酸、弱酸酸式根、弱酸根等,因此要分析清楚每条曲线代表的是哪种离子的浓度变化.
例1 常温下,向一定浓度的NaA 溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中c(HA)、c(A-)、c(H+)、c(OH-)的负对数(-lgc)随溶液pH 的变化关系如图1所示.下列叙述中不正确的是( ).

图1
A.曲 线 ① 表 示-lgc(H+)随 溶 液pH的变化情况
B.曲线①和曲线②的交点对应的溶液中存在c(Na+)=c(A-)

D.等物质的量浓度、等体积的NaA 溶液与HA溶液混合后:c(A-)>c(Na+)>c(HA)
分析 向一定浓度的NaA 溶液中加适量强酸,pH 越小,酸性越强,c(H+)越大,负对数越小,①表示的是c(H+)的负对数随溶液pH 的变化情况,选项A叙述正确.②表示的是c(OH-)的负对数随溶液pH的变化情况;曲线①和②的交点处c(H+)=c(OH-),对应的溶液为中性,由电荷守恒可知,存在c(Na+)+c(H+)=c(A-)+c(OH-),但题中不断加入强酸或强碱,因此,c(Na+)不一定等于c(A-),选项B叙述错误.将选项C中式子变形得
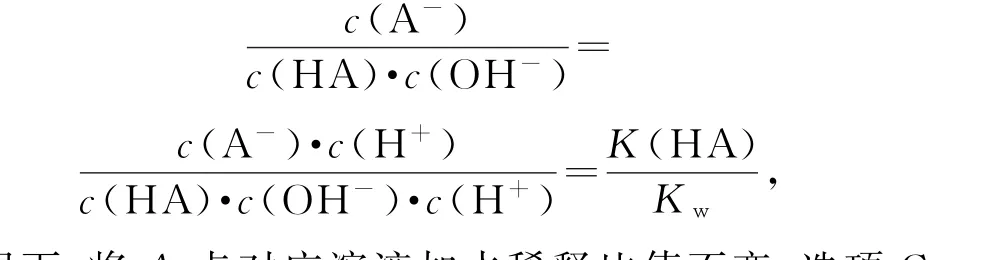
常温下,将A点对应溶液加水稀释比值不变,选项C叙述正确;③④分别表示-lgc(HA)、-lgc(A-)随溶液pH 的变化情况,③和④的交点代表c(HA)=c(A-),此时pH=4.35,显酸性,说明此时HA 电离大于A-水解,则c(A-)>c(Na+)>c(HA),选项D叙述正确.答案为B.
2 相交点计算酸的电离常数
明确了曲线图中每条曲线表示的离子浓度变化,就可以根据电离方程式计算弱酸的电离常数.
例2 常温下,保持某含Ca2+水体中的H2CO3与空气中CO2的平衡.水体中-lg[c(X)]与pH 的关系如图2 所示(其中X 为H2CO3、HCO-3、CO2-3或Ca2+).下列说法正确的是( ).

图2
A.曲线Ⅱ表示-lg[c(HCO-3)]与pH 的关系
B.该温度下,H2CO3的电离常数Ka2的数量级为10-10
C.a点的水体中:c(Ca2+)>c(HCO-3)>c(CO2-3)
D.向水体中加入适量Ca(OH)2固体,可使溶液由b点变到c点

3 比较溶液中离子浓度大小
比较溶液中离子浓度大小是中和滴定曲线必考点之一,解题时要知道溶液的酸碱性或明确溶液的溶质有哪些,中和滴定图像中还可以根据某点的pH 判断离子浓度大小.
例3 常温下,某酸H2A 溶液中含A 物种 的 浓 度 之 和 为amol·L-1,溶 液 中 各含A 物种的pc-pOH关系如图3 所示.图中pc表示各含A 物种浓度的负对数(pc=-lgc),pOH 表示OH-浓度的负对 数[pOH=-lgc(OH-)].x、y、z3 点 的 坐 标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3).下列说法错误的是( ).
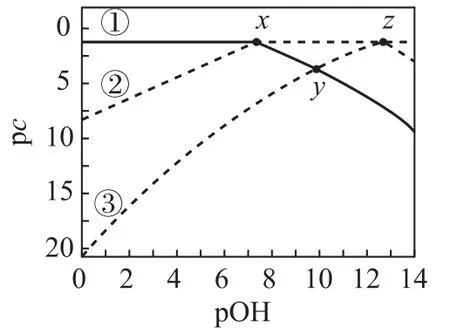
图3
A.曲线③表示pc(H2A)随pOH 的变化
B.pH=2的溶液中:c(H2A)>c(HA-)>c(A2-)
C.pH=4的溶液中:

D.H2A+A2-⇌2HA-的平衡常数K>1.0×105

选项D 说法正确.答案为B.
总之,解答新型酸碱中和滴定曲线图像类试题时,首先要根据化学反应原理分析清楚每条曲线表示的微粒,再根据曲线的交点、电离方程式等进行分析.

