生物絮团技术在凡纳滨对虾池塘淡化养殖中的应用研究
李慧耀,张 哲,葛 辉,潘柏霖,杨章武
(福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,海洋生物种业技术国家地方联合工程研究中心,福建 厦门 361013)
凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,俗称白虾,原产于中南美洲太平洋沿岸水域,在中国无自然分布。因生长快、可高密度养殖和适应低盐水域等优良性状,凡纳滨对虾成为世界三大养殖对虾品种之一,更是我国对虾养殖最主要的种类。2020年我国凡纳滨对虾养殖产量占全国对虾养殖总产量的72.33%,福建省凡纳滨对虾养殖产量占全省对虾养殖总产量的89.76%,其中福建省淡水养殖的凡纳滨对虾占42.83%,海虾淡养成为重要的养殖模式[1]。
生物絮团技术(Biofloc technology,BFT)是一种基于微生物活动的生态养殖技术,1999年由Avnimelech Y首先提出[2]。BFT的原理是通过向养殖水体添加碳源(蔗糖、葡萄糖、淀粉或纤维素等碳水化合物)提高水体中的碳氮比(C/N比),促进养殖环境中异养微生物的生长,从而将水中氮素转化为菌体蛋白。生物絮团颗粒主要包含浮游植物、微生物以及颗粒有机物[3],絮团中的微生物活动可以分解残余饵料、死亡的藻类和粪便等代谢废物,转化氮素、抑制病原微生物,维持养殖环境水质稳定,在某些条件下可达成零换水[4-5]。絮团富含蛋白质,是养殖动物良好的饵料来源[6-7];絮团中的微生物含有聚羟基丁酸酯或肽聚糖,可促进养殖动物的消化和免疫功能、提高存活率和提高生长性能[8]。
对虾养殖是BFT技术研究和应用的重点领域,研究内容涵盖了BFT系统的类型[9-10]、氮去除途径[11]、絮团的营养价值及作用[12-13]和经济因素分析[14]等。本研究的目的是探索一种基于BFT技术的低排放凡纳滨对虾池塘养殖模式,研究BFT技术在凡纳滨对虾养殖生产中的应用效果,为凡纳滨对虾健康养殖及产业发展提供参考。
1 材料和方法
1.1 养殖设施
试验于2021年10月21日开始在福建省漳州市长泰区进行,为期114 d。试验池塘为2个大小约0.15 hm2的无内衬的池塘,池底中间最深处设1个直径1.0 m、深0.5 m的集污池,集污池底设1台潜水泵。冬、春季节用聚乙烯膜大棚覆盖为温棚池,无人工控温设备,养殖水温为18~25℃。1#池为BFT试验池,2#池为对照池(不采取BFT技术措施的常规养殖)。
增氧条件配置为每个池塘750 W水车2台、1.5 kW水车2台,750 W叶轮1台,纳米管底氧盘8个,共用一台3 kW鼓风机,将纳米管固定在铁架上,保持离底20 cm,防止气流搅动底泥。

1.2 养殖用水
养殖池放苗前,排干池底,进行常规消毒,检测池底环境,确认无重要病原后再进水。养殖用水是上一茬养虾的池水经生石灰消毒并长期(30 d)曝晒、曝气自净处理,盐度约为3。养殖前期水深1.5 m、后期水深为2.0 m。养殖过程以抽取地下水缓慢添加,养殖过程只加水、不排水,每月使用集污池中的潜水泵,排出池底部分污泥。
1.3 养殖密度与水质、投饵管理
每个池塘投苗1.8×105尾,密度约为120尾/m2,全程投喂粗蛋白含量为42%的商业对虾饲料,日投饵率前期10%、中期4%、后期2%,每日分3次投喂。养殖期间不间断充气,确保溶解氧全程>5 mg/L。使用商品EM菌及氨基酸肥水膏进行肥水后,放苗,每隔10~20 d使用过硫酸氢钾进行底质改良,使用石灰水调节水质。
1.4 生物絮团技术方法
BFT的培养条件参考本课题组前期对虾育苗标粗水体生物絮团构建方法,选择蔗糖(红糖)为添加碳源,添加量为投饵量的70%,C/N比约为10,每日红糖量在当日第一次投饵时随饵料一起投入[15]。以南海水产研究所监制生产的浓缩芽孢杆菌(Bacillussp.)、光合细菌和嗜酸乳杆菌(Lactobacillusacidophilus)为异养菌,每5 d添加一次异养菌,芽孢杆菌添加量为6 kg·(hm2·m)-1水体,光合细菌和嗜酸乳杆菌添加量为75 L·(hm2·m)-1水体,添加量分别约为芽孢杆菌7.5×106cfu·L-1、光合细菌3.0×108cfu·L-1、嗜酸乳杆菌1.13×106cfu·L-1。2021年11月8日开始絮团培养,不使用消毒剂全池消毒,不使用抗生素。对照池塘按传统模式管理,视水质情况使用微生态制剂,所用微生态制剂与絮团模式相同(主要区别是不添加碳源和不定时定量添加微生物制剂)。
1.5 水样采集及分析
试验期间,约20 d测1次水质指标。采样时间为上午9:00,用采水器采集1 200 mL水样,根据GB 17378.4—2007《海洋监测规范 第 4部分:海水分析》、GB/T 12763.4—2007《海洋调查规范 第4部分:海水化学要素调查》、GB 17378.7—2007《海洋监测规范 第7部分:近海污染生态调查和生物监测》进行水质检测,主要检测指标有pH值、化学需氧量、氨氮、活性磷酸盐、硝酸盐、亚硝酸盐、总氮、总磷、无机氮、弧菌总数、异养细菌总数。絮团体积测定使用英霍夫式锥形管(1 L)静置水样20 min,读取絮团沉淀量,每隔20 d测定一次。
1.6 对虾生长速度、存活率和饵料系数
在养殖中期开始定期测量对虾体长、体质量等生长数据。用火车网诱捕,随机取30尾,使用精度为0.1 g的电子秤和0.1 mm的游标卡尺分别测量对虾样品的体质量与生物学体长。累计投饵量和对应的对虾产量的比值为饵料系数,以产量和平均规格估算存活数量、测算存活率。
1.7 浮游植物监测与指标计算
用采水器采集1 000 mL水样,使用终浓度为5%的甲醛固定样品后,带回实验室,静止沉淀24 h,浓缩至50 mL或其他合适体积。用移液枪吸取0.1 mL浓缩均匀样品置于计数框中,在CX43RF生物显微镜下进行种类鉴定和计数,计数三片,取其平均值,优势度Y≥0.02为优势种。
种类多样性指数(Shannon-Wiener):
(1)
均匀度指数(Peilou):J′=H′/log2S
(2)
丰富度指数:d=(S-1)log2N
(3)
优势度指数:Y=(ni/N)fi
(4)
式中:ni为第i种的个体数;N为样品的总个体数;S为样品中种类总数;fi是第i种的测站出现率。
生物种类名录主要参考黄宗国的《中国海洋生物种类与分布》[16]。
1.8 数据处理
采用SPSS 19.0软件进行统计分析;Student’s t test方法分析组间差异;Microsoft Excel绘图。数据以平均值±标准差(Mean±SD)表示,*表示P<0.05,**表示P<0.01。
2 结果与分析
2.1 生物絮团培养
采取BFT技术措施后,持续观察絮团的生成和变化。用烧杯取池水,经肉眼观察,未见明显形成絮团。用英霍夫式锥形管静置水样24 h后,未见明显絮团沉淀物。显微镜观察水样,见少量絮团颗粒,在相同视野(10×10)下,1#试验池絮团量较多,且絮团粒径大于2#对照池,最大絮团粒径大于100 μm(图2)。烧杯取水静置24 h可见明显泥状沉淀。

2.2 水质监测结果
2.2.1 pH值
养殖期间,两口池塘水体pH值均在适宜凡纳滨对虾生长的7.5~8.6之间波动,试验池波动相对较小,全程pH值8.13~8.63,处于更适宜范围,而对照池多数时间pH小于8(图3)。

注:1#为试验池,2#为对照池;*表示P<0.05,**表示P<0.01。下图同此。Notes:1 # was the experimental pool,2 # was the control pool;* meant P<0.05,* * meant P<0.01.The same as the following figure.
2.2.2 化学需氧量
养殖水体化学需氧量的变化如图4所示,在试验过程中,试验池与对照池水体化学需氧量基本维持一致,最高为19.7 mg/L,最低为12.6 mg/L。

2.2.3 总磷
如图5所示,试验池与对照池的总磷变化趋势相似,但全程低于对照池。检测峰值均出现在2021年12月7日,试验池的总磷峰值为892.27 mg/L,对照池峰值1 633.17 mg/L。养殖全程试验池总磷比对照池低27.00%~45.37%,显示BFT模式有利于水体中磷的消耗。

2.2.4 活性磷酸盐
养殖水体活性磷酸盐含量总体呈上升趋势,全程维持在0.4 mg/L以下。养殖中后期,试验池活性磷酸盐指标比对照池降低36.79%~94.82%。对照池活性磷酸盐含量显著高于试验池(图6)。

2.2.5 总氮
养殖期间,水体总氮含量呈先升高后降低的趋势,养殖前期试验池总氮比对照池稍低,但中期上升较快,中后期显著高于对照池(图7)。

2.2.6 无机氮
如图8所示,养殖起始阶段,两池无机氮含量均为0.1 mg/L左右,养殖过程逐步上升,总体上试验池无机氮低于对照池。养殖最后阶段对照池的无机氮最高达到6.8 mg/L,试验池比对照池低20.74%。

2.2.7 氨氮
养殖期间,试验池的氨氮含量呈缓慢平稳上升趋势,维持在较低水平,最高值仅为0.079 mg/L,远远低于凡纳滨对虾的可耐受水平。对照池氨氮含量峰值达到0.294 mg/L,同期试验池含量仅为0.029 mg/L,比对照池降低90.14%。对照池氨氮含量变化范围大,水质波动较大(图9)。

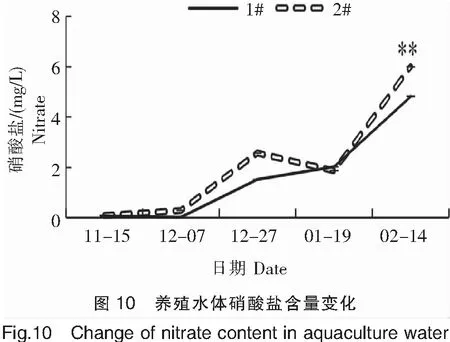
2.2.8 硝酸盐
硝酸盐是水体中无机氮的主要成分(占比在85%~90%之间),其变化趋势与无机氮完全一致。养殖过程,水体硝酸盐总体呈上升趋势,含量在0.086~5.999 mg/L之间,试验池和对照池差异不显著(图10)。
2.2.9 亚硝酸盐
养殖水体的亚硝酸盐含量变化如图11所示。养殖过程中,水体亚硝酸盐含量出现较大波动,变化范围在0.01~0.68 mg/L之间,试验池在养殖后期出现一次快速上升后缓慢下降的现象,对照池在前中期和后期均出现了一次快速上升现象。从5次定期检测的指标来看,试验池和对照池亚硝酸盐指标不同时间都有巨大的波动,相同时间两池互有高低,不同时间峰值均超过0.60 mg/L,未显示BFT技术的单向作用。

2.2.10 总异养菌和弧菌含量
水体中的总异养菌数(Total heterotrophic bacteria,THB)和弧菌含量以最大或然数表示,结果如表1所示。第一次检测的总异养菌密度较大,从第二次检测节点开始,试验池和对照池异养菌含量呈先升高后降低趋势,试验池的数量值稍高。弧菌密度全程都极低,两口池无差异。

表1 养殖水体总异养菌和弧菌含量Tab.1 Contents of total heterotrophic bacteria and Vibrio in aquaculture water
2.3 对虾生长速度及存活率
2.3.1 生长速度
冬季对虾的养殖周期一般为3~5个月,对虾生长数据采集是从投苗60 d后开始进行,此时对虾已经度过快速生长期,可明显观察到对虾生长速度的差异。如图12所示,在养殖第61 d,试验池与对照池已出现生长速度的显著差异(P<0.01),试验池平均体长和体质量分别为9.20 cm和8.37 g,对照池对虾平均体长和体质量分别为8.90 cm与7.61 g,试验池对虾生长速度显著高于对照池;后期的两次采样数据显示,试验池的生长均快于对照池(P<0.01)。养殖114 d,试验池平均体质量为20.41 g,比对照池高18.39%。

2.3.2 存活率和饵料系数
对虾的存活数量以最终产量除以平均体质量计算。试验池最终产量为1 836.5 kg,平均体质量为20.41 g,存活率为50%,饵料系数为1.07。对照池最终产量为2 132.5 kg,平均体质量为17.24 g,存活率为68.71%,饵料系数为1.19。
2.4 浮游植物监测
养殖过程,试验池浮游植物种类数量高于对照池,多样性指数变化较小。养殖前期,试验池浮游植物多样性更丰富,多样性指数比对照池高17.36%;养殖中期出现蓝藻暴发现象,对照池多样性指数下降至2.664,试验池为3.271,比对照池高22.79%,表明蓝藻暴发期间BFT技术有利于维持浮游植物多样性;养殖后期试验池多样性指数略低,但差异不显著。浮游植物丰度随养殖时间呈上升趋势,养殖后期浮游植物暴发性增长,试验池数量高于对照池。试验池均匀度指数波动较小,养殖中期对照池均匀度指数显著降低(表2)。结合浮游植物种类及数量(表3)分析,养殖前期,两池浮游植物均以绿藻为主、硅藻次之,试验池硅藻种类比对照池更丰富;养殖中期,两池均遇到蓝藻暴发,以微囊藻属(Microcystis)为优势种,两池的差异主要是硅藻的数量,尤其是翼茧形藻(Amphiproraalata)数量差异较大;养殖后期,两池浮游植物种类均以绿藻和硅藻为主,葡萄藻为第一优势种。
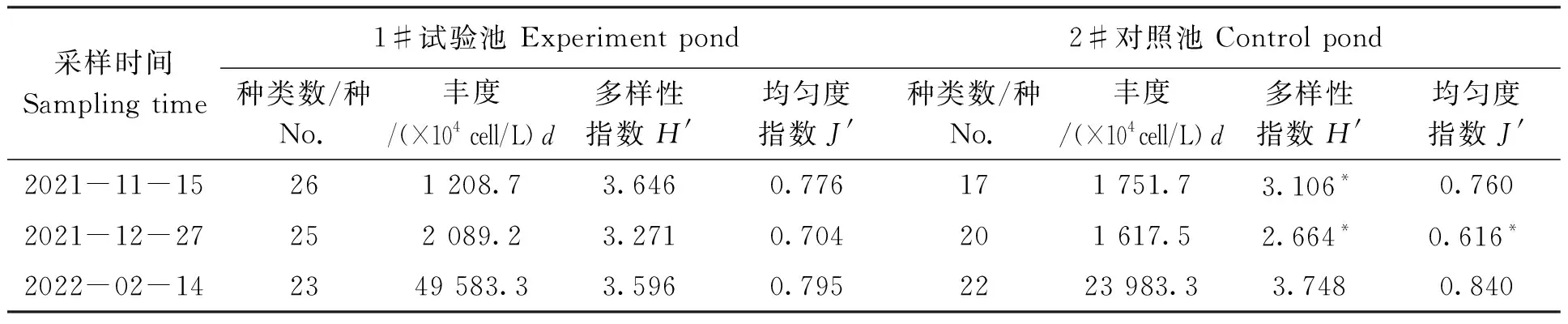
表2 浮游植物种类数、丰度及多样性指数Tab.2 Species,quantity and diversity index of phytoplankton

表3 浮游植物优势种类及丰度Tab.3 Dominant species and abundance of phytoplankton
3 讨论
作为一种高效的生态养殖模式,BFT模式的最大特点是在水体中形成大量的由细菌、藻类、原生动物和颗粒有机质构成的絮凝体,生物絮凝体参与到水生生态系统食物链中,负责水生生态系统的初始养分循环过程,生物絮团的形成受到C/N比、水温、pH值等条件影响[17]。叶继良等研究表明,絮团的形成还受到水体剪切力的影响,在低剪切力条件下絮团颗粒结构松散、边缘模糊;在中、高剪切力时,絮团结构紧实、边缘整齐,絮团粒径随剪切力增大而减小[18]。当室外系统暴露在阳光下时,微藻大量繁殖,也会导致水体pH、DO、CO2、氨和絮团悬浮物含量的波动[19]。在锦鲤[20]、草鱼[21]等淡水鱼室外池塘养殖模式中使用BFT模式,能改善水质条件,在40 m×30 m×1.5 m的聚乙烯内衬池塘中,絮团悬浮物数量可达200~700 mg/L[22]。本项目组在室内养殖桶条件下可成功构建生物絮团[15],但本次试验中,室外无内衬池塘中培养出的絮团量较少,可能与该池池底浮泥较多,导致水体浑浊有关,具体原因有待进一步探究。
养殖过程,水体的pH值变化较为稳定,试验池波动相对较小,全程8.13~8.63处于更适宜范围;养殖中后期,试验池活性磷酸盐含量比对照池降低36.79%~94.82%,总磷含量也显著低于对照池。水体中的磷是藻类生长的必需元素之一,也是动物必需的常量矿物元素,但过量的磷容易引发水体富营养化。养殖用水中的磷主要来源于饲料、肥料及其他矿物质类添加物,对磷的利用途径主要是菌类和藻类[23],其中活性磷酸盐可被藻类直接吸收同化,是藻类生长繁殖的营养基础。BFT模式试验池中异养菌与浮游植物数量均高于对照池,有利于池塘水体中总磷和活性磷酸盐的去除,该结果与在室内养殖箱[24]和生物反应器[25]中的研究结果一致。此外,养殖过程中,总磷含量从12月7日后呈降低趋势,其原因可能是:1)养殖过程中使用的石灰水与磷反应生成磷酸钙沉淀;2)养殖池底泥和浮泥颗粒有吸收磷元素的作用,养殖池底设置的排污泵在养殖后期排出大量污泥,推测这是水体总磷含量降低的重要原因。水体化学需氧量反映了水体受还原性物质污染的程度,也作为有机物相对含量的综合指标之一,BFT模式对化学需氧量没有显著的影响。
总氮为有机氮和氨氮、硝酸盐氮、亚硝酸盐氮等无机氮的总和。残余饵料、施肥和养殖动物代谢物(粪便)是养殖过程中氮的主要来源。养殖过程中,水体总氮含量先上升后下降,中、后期的试验池高于对照池;无机氮指标逐步上升,试验池总体上低于对照池,养殖最后阶段对照池最高达到6.8 mg/L,试验池比对照池低20.7%。在养殖系统中,总氮含量一般呈逐步上升趋势[26]。氮元素是藻类生长需要的重要元素,在本研究中,养殖后期总氮含量的降低可能与浮游植物的暴发性增长有关。养殖后期,试验池总氮含量高于对照池,无机氮含量低于对照池,表明BFT模式水体中有机氮化合物累积较多。试验池的氨氮含量呈缓慢平稳上升趋势,维持在较低水平,显著低于对照组;硝酸盐含量变化趋势与无机氮一致,总体呈上升趋势,试验池与对照池无显著差异;亚硝酸盐指标,试验池和对照池在不同时间都有较大的波动,在相同时间内两池也互有高低,未显示BFT技术的单向作用。氨氮、亚硝酸盐氮和硝酸盐氮之间的转化是养殖池塘水质调控的重点,氨氮主要由残饵粪便及死亡的浮游动植物分解产生,且冬棚养殖由于棚内密闭,更不利于氨氮的汽化蒸发,因而其是养殖期重点防控的指标之一。絮团中异养细菌以氨氮为氮源、以有机碳为碳源合成自身菌体蛋白,可以有效降低水体中氨氮含量[27]。硝酸盐是水体中氮转化的终产物,对水生动物的毒性较小。集约化跑道式养殖系统[28]和BFT系统[29]等养殖模式都会出现硝酸盐的积累,BFT试验池硝酸盐含量与对照池差异不显著,絮团中异养微生物的同化作用对硝态氮的利用效果有限。亚硝酸盐是有机物分解的中间产物,对水生动物具有较强的毒性,其浓度达到0.1 mg/L就会对水生动物产生危害,是对虾养殖水质最重要的防控指标。亚硝酸盐主要来自于亚硝化作用,主要去除途径是硝化作用、反硝化作用和藻类吸收,亚硝酸盐的毒性随着盐度的降低而增强[30]。本研究中,养殖前期试验池的亚硝酸盐含量维持稳定且显著低于对照池;养殖后期亚硝酸盐含量波动较大,可能是在较高的养殖密度条件下,BFT系统中的硝化与反硝化作用不足,而亚硝酸盐水平受到天气条件和藻类生长情况变化影响较大,试验过程中在亚硝酸盐上升时观测到阴雨天气,通过添加反硝化细菌可有效降低水体亚硝酸盐含量,因此在BFT构建中可适当增加硝化与反硝化功能菌株。研究表明,在成熟稳定的对虾BFT养殖系统中,适时停止添加有机碳对水体菌群去除TAN和 NO2-N 的效果不产生影响[31]。在高密度养殖环境中,养殖后期投料量大,碳源的投入成本大量提高,且对水质的改善效果不显著,因此考虑后期停止添加碳源。
从第二次检测节点开始,试验池和对照池异养菌含量呈先升高后降低趋势,结果与中国对虾[32]和花鳗鲡[33]养殖过程一致,试验池的数量值显著高于对照池;弧菌密度全程都极低,两口池没有显著差异。在首次取样时,异养菌含量数据异常,这可能是受到微生态制剂大量投入的影响。浮游植物是生物絮团颗粒的组成成分之一,养殖水体中浮游植物群落的演变是水质的重要影响因素。BFT模式提高了浮游植物多样性;养殖中期,试验池与对照池都出现蓝藻暴发现象,BFT模式有利于维持蓝藻暴发期间的浮游植物多样性,主要体现在有利于硅藻的生长繁殖,但对蓝藻优势藻种没有明显的抑制效果;养殖后期,浮游植物大量繁殖,可能由于投料量和对虾排泄物均大量增加,絮团中大量微生物分解有机物,为浮游植物提供了充足的营养,从而促进藻类大量繁殖。
凡纳滨对虾内陆池塘无换水生态养殖模式,养殖技术工艺较为细致。特别是隔茬养殖水自净后再利用,对水产养殖业节能减排具有重要意义。BFT模式可有效降低氨氮、总磷和非活性磷酸盐的含量,有利于养殖废水再利用;可维持养殖水体pH值稳定,提高浮游植物多样性,提高对虾生长速度,有效降低饵料系数[34],有利于维持养殖水质稳定,提升对虾养殖生态化、健康化和无害化水平,养殖114 d规格达到49 尾/kg,产量12 243 kg/hm2,是一种可行、有效的养殖模式。
本试验养殖存活率偏低主要是养殖前期受蜻蜓幼虫侵害,幼虾损失较多,特别是试验池虾苗损耗较严重。因此引起的实际养殖密度的差异可能对本试验结果有一定的影响。大田试验影响因素较多,结合定性观察,BFT技术还是有显著的正面效果。

