不同氮、磷营养盐对威氏海链藻生长和岩藻黄素积累的影响
钟 玥,苏永昌,陈由强,陈建楠*
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学南方海洋研究院,福建 福州 350117;3.福建省水产研究所,福建 厦门 361013)
威氏海链藻(Thalassiosiraweissflogii)是一种典型的中心纲浮游硅藻[1],体积小,生长周期短,由无定型二氧化硅组成的细胞壁硅质化程度高,生存能力较强,在海洋硅藻中分布较广[2-3]。作为硅藻生理学研究的代表藻株,威氏海链藻很早就被用于摄食率的实验[4],在水产养殖领域,是重要的鱼虾类饵料[5],可促进某些虾类幼苗的生长和发育[6],也可调节某些软体动物的生长[7]。
岩藻黄素(Fucoxanthin),亦称褐藻素、墨角黄素,是一种脂溶性橙色色素,为胡萝卜素的含氧衍生物,属于类胡萝卜素中的叶黄素类[8]。硅藻因含有大量岩藻黄素而呈现金褐色,是硅藻类植物的指标性色素[9]。岩藻黄素分子式为C42H58O6,含有5,6-单环氧基、9-共轭双键以及羰基和羟基[10],由于这些功能基团的存在,岩藻黄素易被氧化和异构化,因此其具有光不稳定性和热不稳定性[8]。各种研究表明,岩藻黄素具有抗氧化活性及很强的自由基清除能力[8,11],此外,还具有抗肥胖[12]、抗糖尿病[13]、抗炎[14-15]以及抗肿瘤[16]等作用。
海洋微藻中岩藻黄素提取的传统方法为有机溶剂浸提法,Wang W J等[17]用二甲基亚砜(DMSO)将海带置于黑暗中浸提,再以乙酸乙酯和硫酸铵混合溶液将浸提液中得到的色素萃取到乙酸乙酯中。由于有机溶剂提取法具有一定的局限性,因此现今各种新型提取技术也在不断研究中,如超临界CO2萃取技术[18-19]、微波萃取法[20]、加压溶剂萃取法[21]、超声波提取法[22]、酶提法[23]等。对分离纯化后得到的岩藻黄素进行检测鉴定,采用的方法通常有超高效液相色谱(UPLC)[24]、高效液相色谱-质谱联用(LC-MS)[25]和核磁共振技术(NMR)[26]。
营养盐是海洋微藻生长的重要生态因子,影响着藻类生物的生理活动和生化组成,以及其种群的生长和繁殖[27-28]。其中,氮、磷营养盐是海水的主要组分,近年来,有关氮、磷限制对海洋微藻生长及生化组成的影响已有许多进展。研究表明,氮是藻细胞中光合作用的必需元素,当氮营养盐不足时,藻细胞内叶绿素总量减少,光反应中心蛋白合成减少,光能的利用效率降低,影响微藻的生长与繁殖[29];无机磷在微藻细胞中合成有机磷化合物,参与合成ATP、GTP、辅酶等光合作用所需的底物或调节物[30-31]。夏建荣等[29]研究发现,小新月菱形藻细胞的比生长速率和稳定期细胞密度随氮浓度的增加而增加,说明无机氮浓度的升高有利于细胞分裂;同时,磷浓度越低,小新月菱形藻的比生长速率越低。梁晶晶等[32]研究了氮、磷、铁对三角褐指藻诱变株MP-2生长、总脂及脂肪酸的影响,结果表明该诱变株生长最适氮浓度为20 mg·L-1,当氮浓度为30 mg·L-1时,总脂积累量最高;生长最适磷浓度为2.5 mg·L-1,当磷浓度为1.0 mg·L-1时总脂积累量最高。然而,对于不同氮、磷营养盐条件下岩藻黄素的积累研究仍较少。本研究拟在f/2培养基的基础上,研究不同的氮、磷营养盐对威氏海链藻生长和岩藻黄素积累的影响,通过HPLC定量检测岩藻黄素含量,探讨氮、磷营养盐对威氏海链藻生长的影响,以优化培养条件,提高岩藻黄素产量。
1 材料与方法
1.1 材料
1.1.1 实验材料
实验所需威氏海链藻(Thalassiosiraweissflogii)购于上海光语生物科技有限公司;采用f/2培养基培养,待用。
1.1.2 实验试剂
无水乙醇、甲醇、丙酮等试剂为国药分析纯;色谱级乙腈、色谱级甲醇购于德国默克公司;岩藻黄素标准品为液相色谱级。
1.1.3 主要仪器设备
真空冷冻干燥机(松原华兴LGJ-12)、超声波清洗器(昆山禾创KQ5200E)、分析天平(奥豪斯CP114)、高速离心机(艾本德5424R)、台式高速离心机(赛默飞世尔)、涡旋仪(塞维尔生物MV-100)、自动细胞计数仪(上海睿钰生物有限公司)、高效液相色谱(美国Waters e2695)等。
1.2 方法
1.2.1 氮营养盐条件设计
配制f/2缺氮培养基,选用硝酸钠、硫酸铵、尿素作为氮营养盐,根据f/2培养基配方及参考梁晶晶等[32]对三角褐指藻的生长研究,设置氮的浓度为0、0.882、1.323、1.764、2.205 mmol·L-1,每种处理设3个平行,以正常f/2培养基培养的藻作为对照。培养条件:23℃,75 μmol·m-2·s-1,全天光照,每天手摇2~3次。
1.2.2 磷营养盐条件设计
上述优化的氮营养盐配制f/2缺磷培养基,选用磷酸二氢钠和磷酸二氢钾作为磷营养盐,磷的浓度设置为0.018、0.036、0.054、0.072 mmol·L-1,每种处理设3个平行,以正常f/2培养基培养的藻作为对照。培养条件:23℃,75 μmol·m-2·s-1,全天光照,每天手摇2~3次。
1.2.3 威氏海链藻细胞密度曲线的建立
接种后,每日于超净台定时取样,卢戈氏碘液固定后,通过自动细胞计数仪计数,并绘制细胞密度曲线。
1.2.4 威氏海链藻生物量测定
待生长至稳定后期,藻液8 000 r/min离心5 min,蒸馏水洗涤2~3次以除去海水中的盐离子,于-20℃冰箱中放置3 h后转移到-80℃冰箱中预冷。从-80℃冰箱中取出,置于真空冷冻干燥机中,冷冻干燥40 h。结束后用分析天平称重,计算可得威氏海链藻生物量(dw)=干燥后总重量(m2)-离心管重量(m1)。
1.2.5 威氏海链藻岩藻黄素的提取与检测
在无光/弱光环境中,加入100 mL/g干重4℃预冷的混合溶液(丙酮∶甲醇=1∶1),涡旋震荡20~30 s混匀后,置于4℃冰箱避光浸提45 min。取出后10 000 r/min离心5 min,此时离心管中的上清液即为岩藻黄素粗提液。通过0.22 μm有机微孔滤膜过滤,装入2 mL棕色样品瓶中。使用高效液相色谱仪Waters e2695对样品进行检测,得到每个样品中岩藻黄素的含量(μg·mL-1)。
1.2.6 岩藻黄素标准曲线的建立
以色谱级甲醇为溶剂,溶解岩藻黄素标准品,分别配置浓度为1、5、10、20、40、60、80、100 μg·mL-1的岩藻黄素标准液,HPLC检测后根据浓度和峰面积建立标准曲线。
2 结果与分析
2.1 岩藻黄素标准曲线
HPLC对不同浓度梯度的岩藻黄素标准品进行检测,根据浓度和峰面积绘制标准曲线,如图1所示。其回归方程为Y=6.88×104X+3.21×104,R2=0.998 5。从图1可知,岩藻黄素浓度在5~100 μg·mL-1时具有良好的线性关系。后续根据该标准曲线进行样品中岩藻黄素含量(mg·g-1)及总量(mg·L-1)的计算。

2.2 氮营养盐对威氏海链藻生长和岩藻黄素含量的影响
2.2.1 不同浓度硝酸钠对威氏海链藻生长和岩藻黄素含量的影响
不同浓度的硝酸钠对威氏海链藻生长和岩藻黄素含量的影响如图2所示。添加了硝酸钠的4组威氏海链藻在接种后的第6天,细胞密度基本上都达到最高值;而缺氮组在第4天就达到最高值,且远低于其他4组(图2A)。当硝酸钠浓度为1.764 mmol·L-1时,生物量最高,但与其他3组添加了硝酸钠的相比,无显著性差异(P>0.05)(图2B)。当硝酸钠浓度分别为0.882、1.764 mmol·L-1时,每g干重威氏海链藻中岩藻黄素的含量较高,两组之间无显著性差异(P>0.05),但含量最高组(硝酸钠浓度1.764 mmol·L-1)与其他2组(硝酸钠浓度分别为1.323、2.205 mmol·L-1)相比,存在显著性差异(P<0.05)(图2C)。当硝酸钠浓度为1.764 mmol·L-1时,每L威氏海链藻藻液中岩藻黄素的总量较高,与其他4组相比,均存在显著性差异(P<0.05)(图2D)。在不添加硝酸钠时,威氏海链藻生物量、岩藻黄素含量及总量均与其他4组存在显著性差异,威氏海链藻的生长和岩藻黄素积累受到明显影响(图2)。

2.2.2 不同浓度硫酸铵对威氏海链藻生长和岩藻黄素含量的影响
以正常f/2培养基(硝酸钠浓度0.882 mmol·L-1)为对照,不同浓度硫酸铵对威氏海链藻的生长和岩藻黄素含量的影响如图3所示。不同硫酸铵浓度培养的威氏海链藻基本上均在接种后的第6天,细胞密度达到最高值;当硫酸铵浓度为0.441 mmol·L-1时,威氏海链藻细胞密度较大,且高于对照组,较低浓度的硫酸铵有助于威氏海链藻细胞密度的增长(图3A)。当硫酸铵浓度为0.441 mmol·L-1时,生物量最高,与较高浓度硫酸铵处理(硫酸铵浓度分别为0.882、1.103 mmol·L-1)及对照组相比,存在显著性差异(P<0.05)(图3B)。当硫酸铵浓度分别为0.441、0.662 mmol·L-1时,每g干重威氏海链藻中岩藻黄素的含量较高,两组之间无显著性差异(P>0.05),但与最高浓度处理组(硫酸铵浓度为1.103 mmol·L-1)相比,存在显著性差异(P<0.05)(图3C)。当硫酸铵浓度为0.441 mmol·L-1时,每L威氏海链藻藻液中岩藻黄素的总量较高,与高浓度处理组(硫酸铵浓度为0.882、1.103 mmol·L-1)相比,存在显著性差异(P<0.05)(图3D)。由图3可以看出,与对照组相比,以硫酸铵作为氮营养盐培养威氏海链藻,低浓度的硫酸铵有利于威氏海链藻生长及岩藻黄素积累,而在不添加硫酸铵时,威氏海链藻的生长和岩藻黄素积累则受到明显影响。

2.2.3 不同浓度尿素对威氏海链藻生长和岩藻黄素含量的影响
以正常f/2培养基(硝酸钠浓度0.882 mmol·L-1)为对照,不同浓度尿素对威氏海链藻的生长和岩藻黄素含量的影响如图4所示。不同尿素浓度培养的威氏海链藻基本上均在接种后的第6天,细胞密度达到最高值;不同浓度尿素对威氏海链藻细胞密度的影响不明显。当尿素浓度为0.882 mmol·L-1时,细胞密度较大(图4A);生物量最高,与尿素浓度为0.662、1.103 mmol·L-1的实验组及对照组相比,存在显著性差异(P<0.05)(图4B);每g干重威氏海链藻中岩藻黄素含量较高,与其他组相比,均存在显著性差异(P<0.05)(图4C);每L威氏海链藻藻液中岩藻黄素总量较高,与其他组相比,均存在显著性差异(P<0.05)(图4D)。由图4可以看出,与对照组相比,以尿素作为氮营养盐培养威氏海链藻,浓度为0.882 mmol·L-1的尿素明显有利于威氏海链藻生长及岩藻黄素积累,在不添加氮营养盐时,威氏海链藻的生长和岩藻黄素积累受到明显影响。
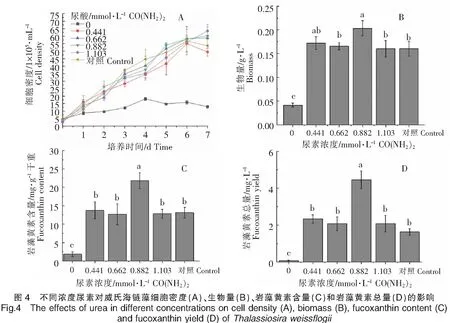
2.2.4 三种最佳浓度的氮营养盐对威氏海链藻生长和岩藻黄素含量影响的比较
根据前述比较,选取三种最佳浓度的氮营养盐进行数据分析,结果如图5所示。不同最佳浓度的氮营养盐培养的威氏海链藻基本上均在接种后的第6天,细胞密度达到最高值;其中在硫酸铵浓度为0.441 mmol·L-1时,威氏海链藻细胞密度最高(图5A)。在0.882 mmol·L-1尿素处理下,生物量最高,与对照组相比存在显著性差异(P<0.05)(图5B);每g干重威氏海链藻中岩藻黄素含量最高,与其他2组及对照组相比,均存在显著性差异(P<0.05)(图5C);每L威氏海链藻藻液中岩藻黄素总量最高,与其他2组及对照组相比,均存在显著性差异(P<0.05)(图5D)。由图5可以看出,以0.882 mmol·L-1尿素为氮营养盐,有利于威氏海链藻的生长及岩藻黄素积累。在0.441 mmol·L-1硫酸铵处理下,细胞密度最大,但在0.882 mmol·L-1尿素处理下,生物量最大,结合岩藻黄素含量结果,分析可能的原因为在0.441 mmol·L-1硫酸铵处理下的威氏海链藻生长速度较快,但油脂等代谢产物较少,细胞个体较小,导致生物量较低。
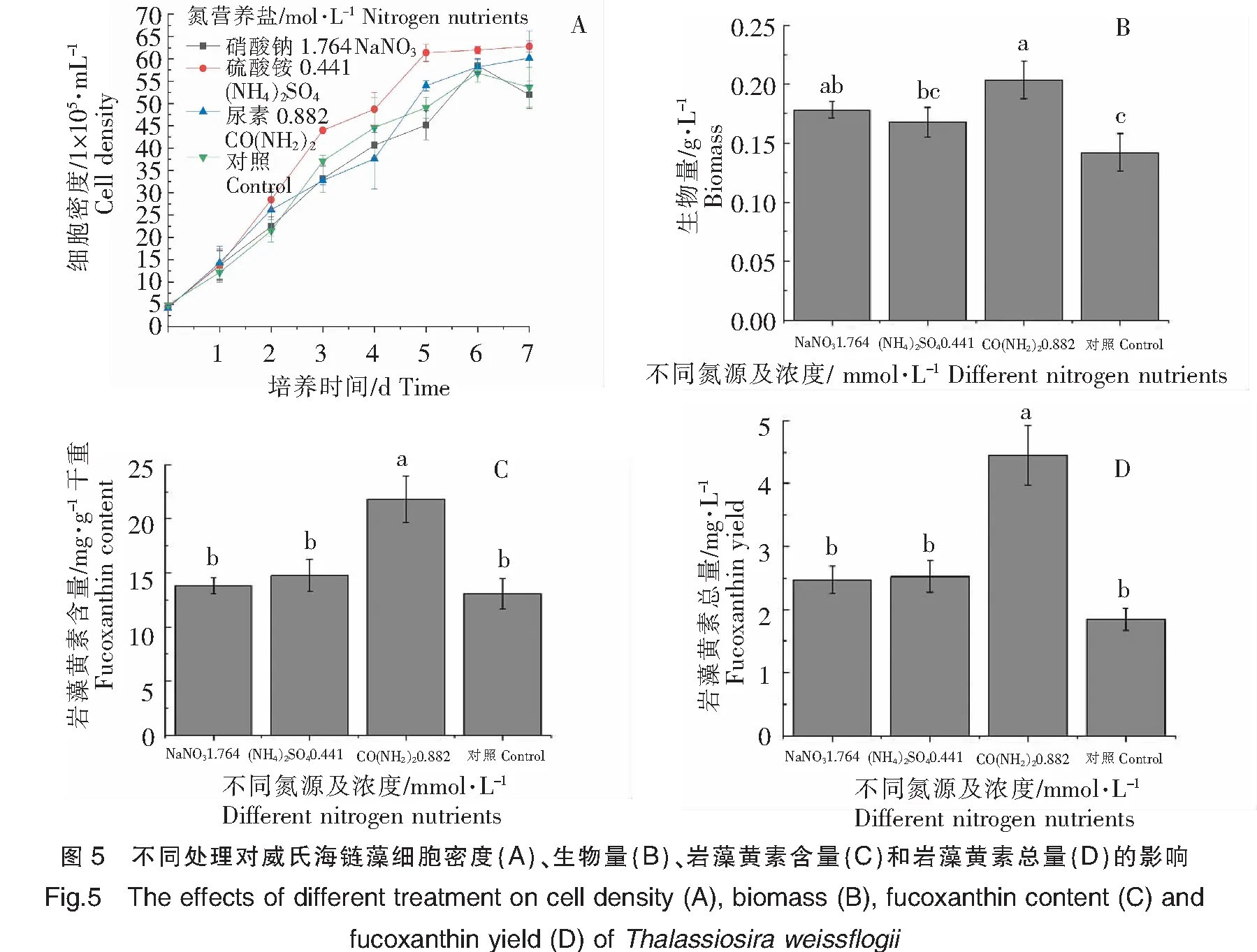
2.3 磷营养盐对威氏海链藻生长和岩藻黄素含量的影响
2.3.1 不同浓度磷酸二氢钠对威氏海链藻生长和岩藻黄素含量的影响
不同浓度磷酸二氢钠对威氏海链藻的生长和岩藻黄素含量的影响如图6所示。添加了磷酸二氢钠的4组和对照组在接种后的第6、7天,威氏海链藻的细胞密度达到最高值,而缺磷组则在第5天就达到最高值,且远低于其他5组,较高浓度的磷酸二氢钠有助于威氏海链藻细胞密度的增长(图6A)。不同浓度磷酸二氢钠对生物量的影响不明显,不存在显著性差异(P>0.05)(图6B)。不同浓度磷酸二氢钠对每g干重威氏海链藻中岩藻黄素含量及每L威氏海链藻藻液中岩藻黄素总量的影响均不明显,不存在显著性差异(P>0.05)(图6C、图6D)。由图6可以看出,磷酸二氢钠对威氏海链藻生长及岩藻黄素积累无明显影响。
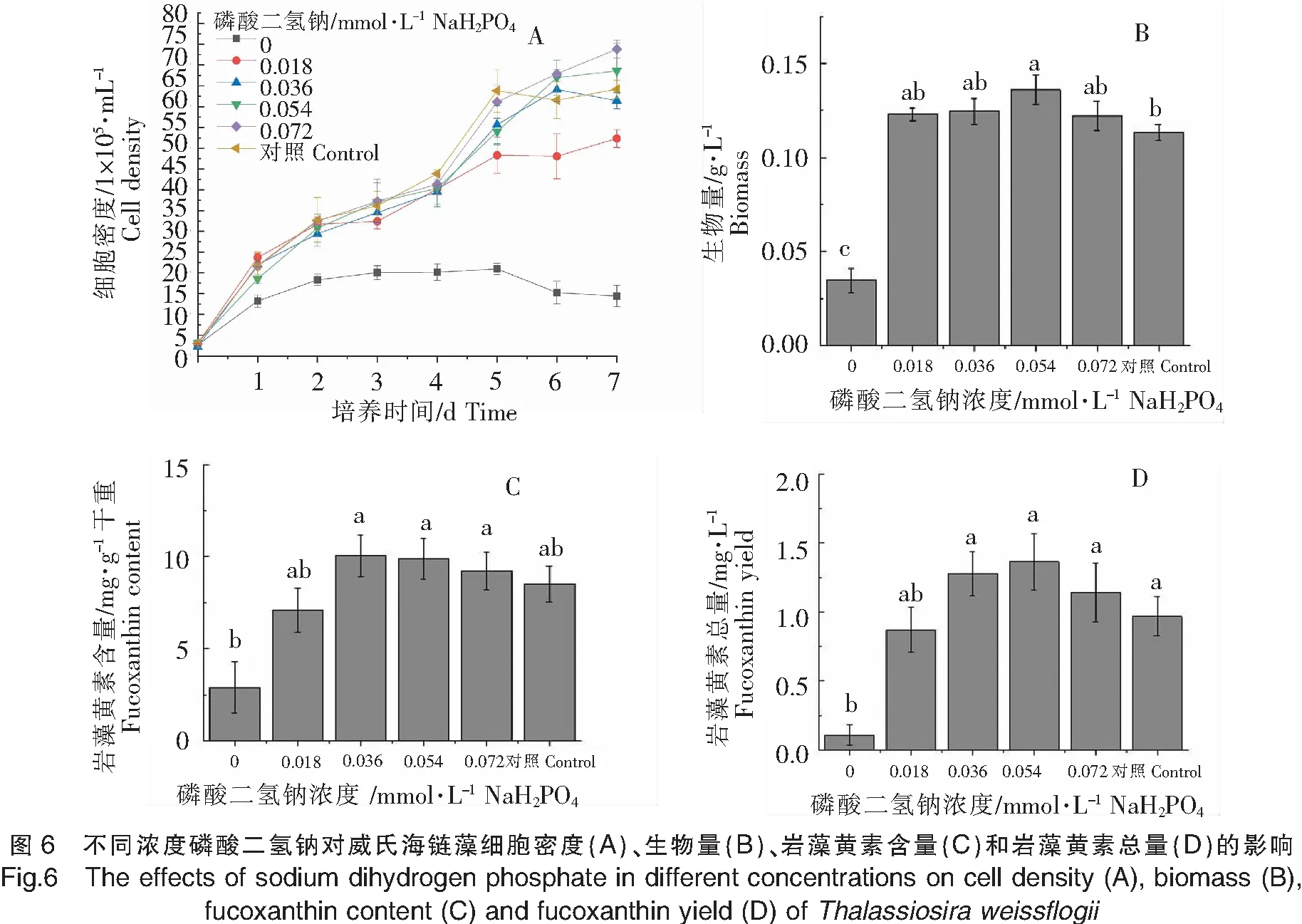
2.3.2 不同浓度磷酸二氢钾对威氏海链藻生长和岩藻黄素含量的影响
不同浓度磷酸二氢钾对威氏海链藻的生长和岩藻黄素含量的影响如图7所示。添加了磷酸二氢钾的4组和对照组在接种后的第5、6天,威氏海链藻的细胞密度达到最高值,较低浓度的磷酸二氢钾(浓度为0.018 mmol·L-1)不利于威氏海链藻细胞密度的增长(图7A)。不同浓度磷酸二氢钾对生物量的影响不明显,不存在显著性差异(P>0.05)(图7B)。当磷酸二氢钾浓度为0.054 mmol·L-1时,每g干重威氏海链藻中岩藻黄素含量较高,与其他组相比,均存在显著性差异(P<0.05)(图7C)。当磷酸二氢钾浓度为0.054 mmol·L-1时,每L威氏海链藻藻液中岩藻黄素总量较高,与其他组相比,均存在显著性差异(P<0.05)(图7D)。由图7可以看出,0.054 mmol·L-1磷酸二氢钾有利于岩藻黄素的积累。
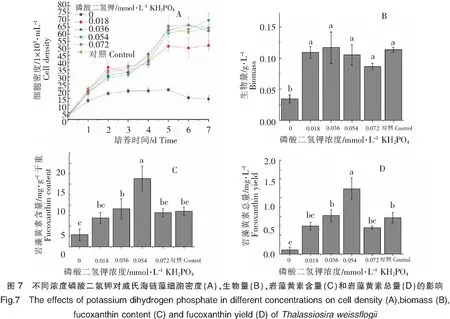
2.3.3 两种最佳浓度磷营养盐对威氏海链藻生长和岩藻黄素含量影响的比较
根据前述比较结果,选取两种最佳浓度的磷营养盐进行数据分析,结果如图8所示。不同最佳浓度的磷营养盐培养的威氏海链藻基本上均在接种后的第6、7天,细胞密度达到最高值(图8A)。在0.054 mmol·L-1磷酸二氢钠处理下,生物量最高,与磷酸二氢钾组相比,存在显著性差异(P<0.05)(图8B)。在0.054 mmol·L-1磷酸二氢钾处理下,每g干重威氏海链藻中岩藻黄素含量最高,与其他组相比,均存在显著性差异(P<0.05)(图8C);每L威氏海链藻藻液中岩藻黄素总量最高,与其他组相比,均存在显著性差异(P<0.05)(图8D)。由图8可以看出,从细胞密度和生物量来看,以0.054 mmol·L-1磷酸二氢钠为磷营养盐,有利于威氏海链藻的生长,但0.054 mmol·L-1磷酸二氢钾更有利于岩藻黄素的积累。

3 讨论与结论
本研究主要通过改变培养基中氮、磷营养盐浓度,比较其对威氏海链藻生长及岩藻黄素积累的影响。氮是威氏海链藻生长发育的重要生态因子,藻细胞能够对不同形态的氮营养盐进行选择性吸收和利用。徐兴莲等[33]研究发现,氮限制抑制了三角褐指藻的生长与光合活性,其叶绿素a含量降低,PSⅡ光反应中心部分关闭。不同藻类对氮营养盐的利用存在差异,张青田等[34]研究了相同浓度下氯化铵和尿素对几种藻类生长的影响,发现氯化铵作为氮营养盐更有利于赤潮异弯藻、纤细角毛藻和亚历山大藻的生长,而尿素更有利于隐藻的生长。朱明等[35]研究表明,与硝酸盐相比,氨盐作为氮营养盐更有利于威氏海链藻的生长代谢,这是因为微藻对于氨盐的吸收引起培养基pH值的下降,对因光合作用导致的培养液pH值上升起到缓冲作用,而有利于微藻生长。本研究中,在相同氮浓度(0.441 mmol·L-1硫酸铵和 0.882mmol·L-1硝酸钠)培养下,硫酸铵更有利于威氏海链藻的生长与岩藻黄素的积累。窦勇等[5]研究发现,与无机氮营养盐相比,尿素更有利于提高威氏海链藻细胞密度和叶绿素a质量浓度,本研究中,0.882 mmol·L-1的尿素最适合威氏海链藻的生长及岩藻黄素的积累。另外,也有许多学者研究了氮磷比对威氏海链藻生长的影响,在相同氮磷比条件下,提高氮磷营养盐浓度有利于威氏海链藻的生长与光合作用[5];同时,刘皓等[36]研究发现,相比于磷营养盐,氮营养盐浓度对威氏海链藻的生长影响较大。本研究中,与磷营养盐相比,氮营养盐浓度对威氏海链藻生长及岩藻黄素积累影响较大,生物量增长与岩藻黄素积累量增加均更为明显,与前述研究结果基本一致。
本研究选取了硝酸钠、硫酸铵与尿素为氮营养盐,磷酸二氢钠与磷酸二氢钾为磷营养盐,分别设置了4个浓度梯度,实验结果表明:1)0.882 mmol·L-1尿素明显有利于威氏海链藻的生长及岩藻黄素的积累,与其他氮营养盐相比,存在显著性差异(P<0.05);生物量、岩藻黄素含量和岩藻黄素总量最高分别可达到 0.203 g·L-1、21.806 mg·g-1和4.449 mg·L-1,与对照组相比,生物量提高了45.4%,岩藻黄素含量提高了66.5%,岩藻黄素总量提高了173.1%。2)以上述优化的氮营养盐为基础,比较磷酸二氢钠和磷酸二氢钾两种磷盐对威氏海链藻生长及岩藻黄素积累的影响,发现0.054 mmol·L-1磷酸二氢钾在威氏海链藻生物量的积累上无显著性差异(P>0.05),但在岩藻黄素含量积累方面,与其他磷营养盐相比,存在显著差异(P<0.05)。与对照组相比,岩藻黄素含量提高了78.9%,岩藻黄素总量提高了92.1%。在缺氮、缺磷的条件下,威氏海链藻的生长及岩藻黄素的积累均受到严重影响。
本次实验研究了氮、磷营养盐对威氏海链藻生长的影响,在f/2培养基的基础上设置了不同的氮、磷营养盐及不同的浓度,为培养基优化及提高威氏海链藻岩藻黄素产量提供了理论基础。

