钛表面纳米形貌介导的巨噬细胞极化对骨髓间充质干细胞的影响
王静文, 张 磊, 苏俭生
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔修复教研室,上海 200072)
钛种植体作为临床上应用最广泛的材料之一,一直以来都是种植修复领域的研究热点[1]。为此,研究人员对钛种植体表面改性进行了大量研究,以期待保留钛种植体原有特性的同时赋予其新功能,进而实现早期成骨[2-3]。目前已证实,钛表面纳米形貌能促进成骨细胞的黏附和分化[4]。课题组前期通过水热法成功构建载钙微纳结构并验证其对成骨细胞的促进作用[5]。
种植体在植入体内后,来自血液和体液中的各种蛋白分子等吸附在其表面,不可避免地会引起免疫反应,其中巨噬细胞作为主要免疫细胞发挥了重要作用。但巨噬细胞本身性质并不稳定,在不同因子的刺激下会产生不同极化方向,从而影响炎症因子的表达。有研究表明,钛表面不同形貌能够介导巨噬细胞的极化方向[6]。
因此,本实验使用水热法构建钛表面纳米形貌,旨在探究其对RAW264.7巨噬细胞的调控作用,及对骨髓间充质干细胞(BMSCs)成骨分化的影响。
1 材料和方法
1.1 材料
1.1.1 实验试剂及设备 α-MEM培养液、DEME高糖培养液和青霉素-链霉素(双抗)(Hyclone公司,美国);胎牛血清(fetal bovine serum,FBS;Gibco公司,美国);磷酸盐缓冲溶液(phosphate buffered saline,PBS;Hyclone公司,美国);CCK-8试剂盒(碧云天公司,中国);TRIzol总RNA提取试剂盒、逆转录试剂盒 (TaKaRa公司,日本);酶联免疫吸附试验(ELISA)检测试剂盒(江苏酶免公司,中国);扫描电子显微镜(SEM;Hitachi公司,日本);实时荧光定量PCR仪(罗氏公司,瑞士)。
1.1.2 实验动物 SD大鼠由同济大学实验动物中心提供,饲养于上海牙组织修复与再生工程技术研究中心SPF级实验动物房内。
1.2 实验方法
1.2.1 材料制备及表征 本实验所用钛片为机械加工纯钛片(Φ15 mm×2 mm),丙酮、无水乙醇、去离子水依次用超声机清洗后烘干待用。将清洗后的纯钛片记为对照组(control-Ti组);将纯钛片放在聚四氟乙烯内衬的反应釜中,加入25 mL 0.5 mol/L的NaOH水溶液,180℃下反应12 h,取出钛片后行超声振荡清洗,去离子水冲洗、烘干,即可得到表面改性的钛片,作为纳米组(nm-Ti组)。
使用SEM观察各组钛片表面结构,使用接触角测量仪测量各组钛片表面的水接触角,比较不同组钛片的亲水性差异。
1.2.2 细胞培养 选取2~3周龄的雄性SD大鼠,颈椎脱臼处死后分离其股骨和胫骨,并将其浸泡在含10%双抗的PBS中,转入无菌操作台。用镊子小心夹持股骨,无菌器械剪剪去两端骨骺,用1 mL无菌注射器吸取适量培养液(含10%FBS、1%双抗的α-MEM培养液),将骨髓冲入10 cm培养皿中,用同样的方法将同一侧胫骨内骨髓冲入同一培养皿中,各皿共加入8 mL培养液,将骨髓吹散均匀,放入恒温培养箱(5%CO2、37℃)中培养,每3 d换液,待BMSCs汇合度达80%~90%时,使用含2.5%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化后传代培养,取第2代BMSCs进行实验。小鼠RAW264.7巨噬细胞系用含10%FBS的DMEM高糖培养液,于恒温培养箱(5%CO2、37℃)内培养,待细胞密度达80%~90%时,培养液吹打消化后待用。
1.2.3 细胞黏附 当BMSCs汇合度达80%~90%时,使用含2.5%EDTA的胰酶消化,以1×104个/孔(24孔板)的密度接种于各组钛片表面。培养24 h后,用PBS轻柔冲洗3次,4%多聚甲醛固定10 min,Triton X-100破膜5 min,使用PBS再次浸泡冲洗3次,以200μL/孔将配制好的鬼笔环肽加入各组钛片,室温避光孵育90 min。PBS浸泡冲洗3次后,以200μL/孔加入4′,6-二脒基-2-苯基吲哚 (4′,6-diamidino-2-phenylindole,DAPI)溶液对细胞核进行复染5 min,最后用PBS清洗3次后于荧光显微镜下观察细胞形态。
1.2.4 细胞增殖 当BMSCs汇合度达80%~90%时,使用含2.5%EDTA的胰酶消化,以1×104个/孔(24孔板)的密度接种于各组钛片表面,每3 d换液。分别于接种后第1、4、7天弃去孔板中的原培养液,使用CCK-8试剂盒,将CCK-8原液与培养液以1∶10的比例配制成CCK-8工作液,以550μL/孔加入各孔板内,37℃避光孵育3 h。使用酶标仪在波长450 nm处测试其吸光度值,比较各组钛片表面细胞增殖情况。各组重复3次实验,以消除实验误差。
1.2.5 实时荧光定量聚合酶链式反应(RT-qPCR)检测各组钛片表面BMSCs成骨相关基因的表达 当BMSCs汇合度达80%~90%时,使用含2.5%EDTA的胰酶消化,以2×104个/孔(24孔板)的密度接种于各组钛片表面,每3 d换液。分别于接种后第3、7天时弃去原培养液,得到3 d和7 d的BMSCs样本,用TRIzol法提取细胞总RNA,参照逆转录试剂盒说明书对获得的总RNA进行逆转录,然后通过实时荧光定量PCR仪检测成骨相关基因的表达。
1.2.6 ELISA检测各组钛片表面RAW264.7巨噬细胞炎症相关因子的表达 当RAW264.7巨噬细胞汇合度达80%~90%时,向培养皿中加入培养液冲洗消化,以5×104个/孔(24孔板)的密度接种于各组钛片表面。并分别于接种后24、48 h时收集各孔上清液,1 000×g离心20 min后取上清液。根据试剂盒说明设置标准品孔和样本孔,标准孔加入不同浓度标准品50μL,样本孔加入待测上清液50μL,然后将其密封于室温下孵育30 min,弃去液体,洗板5次,加入酶标试剂,室温下孵育30 min,然后再次弃去液体,洗板5次,加入显色液A、B,室温下显色10 min,加入终止液,于450 nm波长处测定各孔吸光度值,根据标准品曲线计算各组样品浓度。
1.2.7 RT-qPCR检测各组钛片表面RAW264.7巨噬细胞极化相关基因的表达 当RAW264.7巨噬细胞密度达80%~90%时,向培养皿中加入培养液冲洗消化,以5×104个/孔(24孔板)的密度接种于各组钛片表面。其中一组在培养24 h后,用白细胞介素-4(IL-4,10 ng/mL)诱导24 h后收样,作为IL-4/48 h组。并分别于接种后24、48 h时弃去原培养液,得到正常培养24 h组和48 h组样本。与1.2.5中的方法一致,通过RT-qPCR测量RAW264.7巨噬细胞极化相关基因的表达。
1.2.8 RAW264.7巨噬细胞条件培养液培养BMSCs后检测成骨相关基因的表达 细胞分组及处理方法同1.2.5和1.2.7,在培养48 h后将48 h组和IL-4/48 h组巨噬细胞培养液更换为基础培养液,饥饿刺激24 h后,收集各组细胞上清液,以1 200 r/min离心后吸取上清液。将收集的上清液与完全培养液(含10%FBS和1%双抗的α-MEM培养液)以1∶2的比例制备成条件培养液。对2组正常培养4 d的BMSCs进行条件培养,并在第7天时收样,得到正常7 d组(normal组)和条件培养组(+CM组和+IL-4/CM组)。通过RT-qPCR检测条件培养后各组钛片表面BMSCs成骨相关基因的表达。
1.3 统计学处理
通过SPSS 20.0软件对实验数据进行处理分析,数据均采用均数±标准差(±s)表示。组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 材料表征
2.1.1 SEM观察 各组钛片表面形貌图像如图1所示,对照组(control-Ti组)表面平坦,无特殊结构;纳米组(nm-Ti组)表面为成簇的片状结构。

图1 各组钛片表面SEM图像Figure 1 SEM images of the surface of different titanium disc samples
2.1.2 水接触角测量 各组钛片表面水接触角测量结果如图2所示,对照组钛片表面的水接触角约为87.93°;而纳米组钛片表面的水接触角约为26.49°,接触水滴后迅速湿润铺展,亲水性显著高于对照组(P<0.01)。

图2 各组钛片表面水接触角Figure 2 Water contact angles of different titanium disc samples
2.2 细胞黏附
BMSCs在各组钛片表面细胞黏附形态如图3所示,24 h时对照组和纳米组钛片表面细胞均得到伸展,且纳米组表面细胞可见明显的细长突触。
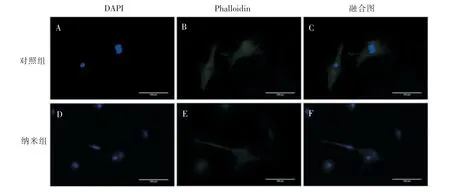
图3 BMSCs在各组钛片表面黏附形态(×400)Figure 3 BMSCs adhesion on the surface of different titanium disc samples(×400)
2.3 细胞增殖
细胞增殖结果如图4所示,随时间增加,BMSCs在各组钛片表面细胞数量也逐渐增加,且纳米组表面细胞增殖更为活跃,第7天时细胞增殖能力显著高于对照组(P<0.01)。

图4 BMSCs在各组钛片表面的增殖情况Figure 4 BMSCs proliferation on the surface of different titanium disc samples
2.4 各组钛片表面BMSCs成骨相关基因的表达
BMSCs成骨相关基因表达结果如图5所示,纳米组BMP-2和ALP的表达量均显著高于对照组,以第3天时BMP-2和ALP表达最高(P<0.05)。
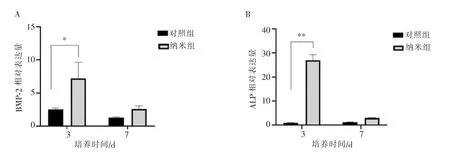
图5 成骨相关基因的表达Figure 5 Expression of osteogenesis related genes
2.5 各组钛片表面RAW264.7巨噬细胞炎症相关因子的表达
ELISA检测各组钛片表面RAW264.7巨噬细胞炎症相关因子分泌水平,结果如图6所示,随着时间递增,对照组和纳米组分泌白细胞介素-10(IL-10)和肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)的水平均有所升高。培养48 h时,纳米组IL-10的表达水平显著高于对照组(P<0.01)。

图6 巨噬细胞相关炎症因子的分泌水平Figure 6 Secretion level of macrophage related inflammatory factors
2.6 各组钛片表面RAW264.7巨噬细胞极化相关基因的表达
RAW264.7巨噬细胞极化相关基因表达结果如图7所示,各组极化相关基因表达均随着时间递增而不断增多。与正常培养48 h相比,IL-4刺激培养后,对照组Arg-1和iNOS的表达均增多,而纳米组Arg-1的表达增多,iNOS的表达则有所降低,且纳米组与对照组间差异具有统计学意义(P<0.05)。

图7 巨噬细胞极化相关基因的表达Figure 7 Expression of macrophage polarization related genes
2.7 RAW264.7巨噬细胞条件培养BMSCs后成骨相关基因的表达
BMSCs成骨相关基因检测结果如图8所示,与正常培养7 d的BMSCs相比,条件培养后,纳米组和对照组BMSCs的BMP-2和ALP表达量降低;而在加了IL-4刺激巨噬细胞的条件培养液培养BMSCs后,纳米组和对照组BMSCs的BMP-2和ALP的表达较之前均有所增加,以对照组BMP-2的增加最为显著(P<0.01)。

图8 成骨相关基因的表达Figure 8 Expression of osteogenesis related genes
3 讨论
研究证实,粗糙的钛表面更有利于细胞的黏附和增殖。且相比于传统喷砂酸蚀处理后获得的粗糙表面,近些年来,学者们研究发现钛表面纳米级粗糙表面不仅有利于细胞黏附,还具有促进成骨的作用[7-8]。然而,一些实验结果表明,目前针对种植体的表面改性,在体内成骨方面常常达不到预期效果[3]。不少学者便重新将目光转投到种植体植入体内后引起的生物反应[9]。种植体植入体内后,巨噬细胞作为主要的免疫细胞参与炎症调节和组织修复过程。目前,巨噬细胞的不同极化表型对骨再生的作用机制尚未有明确定论,但M2型巨噬细胞能够促进炎症由损伤转向修复,进而促进骨组织再生的结论得到普遍认可[10]。因此,如何改变种植体表面特性,使其具有调节巨噬细胞极化进而促进骨组织再生的能力得到越来越多的关注。
钛表面形貌不仅对成骨细胞有作用,对巨噬细胞生物学行为也有一定的影响,有学者通过阳极氧化法制备出不同管径的二氧化钛纳米管,证明其不仅对成骨细胞有促进作用,不同管径的纳米管也会诱导巨噬细胞发生不同方向的极化,其中30 nm和80 nm纳米管分别促进巨噬细胞向M2和M1方向极化,并且从破骨细胞激活途径对此进行解释讨论[11-13]。课题组前期通过水热法同样成功制备出钛表面纳米结构,并通过体内外实验证明这种纳米结构对成骨细胞的黏附、增殖和成骨分化等生物学活性均有显著的促进作用[5],但其仅局限在某一个方面的研究,对巨噬细胞极化的影响及其与成骨细胞间的相互作用缺乏进一步研究。本实验便在此基础上,以小鼠来源的RAW264.7巨噬细胞系和大鼠BMSCs为研究对象,探究钛表面纳米形貌调控巨噬细胞促进骨再生修复的影响。
本实验采用水热法制备出钛表面纳米结构,通过测量水接触角和观察细胞黏附形态,证明这种纳米结构具有良好的亲水性,有利于细胞的黏附伸展。RT-qPCR结果显示,与对照组相比,纳米组成骨相关基因BMP-2和ALP表达显著增加,表明该纳米形貌有利于BMSCs的成骨分化。ELISA实验结果表明,随时间递增,与对照组相比,纳米组钛片在48 h时分泌抗炎因子IL-10显著增多,而促炎因子TNF-α没有显著变化,提示早期纳米钛表面可能以M2方向极化为主。RT-qPCR结果显示,随时间递增,各组材料表面巨噬细胞Arg-1和iNOS表达也不断增多,与对照组相比,纳米组以Arg-1表达为主,与ELISA结果趋势一致。但在IL-4刺激巨噬细胞向M2方向极化后,对照组Arg-1和iNOS表达水平均明显增加,又以Arg-1显著增高为主,这可能与巨噬细胞极化处于动态平衡有关,在IL-4的刺激下,巨噬细胞M1和M2极化都很活跃。而纳米组Arg-1表达显著增多,iNOS表达降低,但其变化趋势明显不如对照组显著,提示钛表面纳米形貌对巨噬细胞极化可能存在一定的调控机制。在对BMSCs的条件培养实验中,加入巨噬细胞条件培养液后,BMSCs的成骨基因BMP-2和ALP表达明显减少,且差异具有统计学意义,而BMSCs在IL-4刺激后的巨噬细胞条件培养液培养后,成骨相关基因的表达量又有所提升,说明巨噬细胞分泌的细胞因子对BMSCs成骨分化具有一定的作用。根据IL-4刺激后的实验结果推断,纳米表面以M2方向极化为主,其条件培养BMSCs后应促进其成骨分化,而实际结果是成骨相关基因的表达减少。但在IL-4直接刺激,巨噬细胞向M2方向极化后,RT-qPCR的结果表明其成骨相关基因BMP-2和ALP表达均明显增多,与其他相关的研究结果一致,说明钛表面纳米形貌介导的巨噬细胞极化对BMSCs的调控可能存在更为复杂的过程。
综上所述,本实验成功构建了钛表面纳米形貌,并验证了其对BMSCs的黏附、增殖和成骨分化均有促进作用,实验结果提示早期钛表面纳米形貌以促进巨噬细胞M2极化为主,且由纳米表面介导的巨噬细胞极化会进一步影响BMSCs的成骨分化。但其具体的作用方向及作用机制仍需深入研究,下一步将深入检测相关炎症因子分泌和基因表达情况,从而通过干预巨噬细胞的极化方向,进而影响成骨细胞行为,以达到促进早期骨整合的目的。

