雷公藤二萜类化合物通过抑制多条信号通路缓解巨噬细胞炎症反应
饶凯瑞,廖彩岑,伊 然,杜欣烨,周晓琼,李蓉涛,刘 丹
(昆明理工大学生命科学与技术学院,云南 昆明 650500)
炎症是对有害刺激(如病原体、受损细胞、有毒化合物或辐射)的一种先天免疫反应,但是不受控制的炎症可能会导致组织损伤或各种慢性炎症性疾病[1],因此,控制炎症的持续时间和程度是非常有必要的。巨噬细胞是一种高度异质的细胞,具有抗原提呈与加工、免疫调节、吞噬等功能,可根据局部微环境迅速改变其功能,它可以吞噬死亡细胞和细胞碎片,并招募更多的巨噬细胞以响应炎症信号[2],但吞噬活动发生的同时也会导致炎症体的活化,使炎症反应过度并对机体产生损害[3]。
脂多糖(LPS)是革兰阴性菌细胞外膜的主要成分[4],它通过与其特异性受体Toll样受体4(TLR4)结合并激活MyD88,从而激活多条参与巨噬细胞免疫应答的通路,包括丝裂原活化蛋白激酶(MAPK)通路、核转录-κB(NF-κB)通路和JAK-STAT通路等,这些通路可以促进炎性介质(COX-2和iNOS)和细胞炎性因子(IL-6、IL-1β、TNF-α等)的生成[4-6]。NF-κB是最重要的转录因子之一,大量参与炎症反应基因的表达都受到NF-κB的调控,如COX-2、iNOS、促炎细胞因子(IL-1、IL-2、IL-6和TNF-α)、趋化因子、黏附分子、免疫受体、生长因子以及其他与增殖和侵袭有关的因子。p38丝裂原活化蛋白激酶(p38MAPK)、c-jun氨基末端激酶(JNK)和细胞外信号调节激酶(ERK)是MAPK超家族的成员,它们在细胞应激时被激活,能够诱导NF-κB的核转位和上调促炎细胞因子的表达,在炎症反应中发挥重要作用[5-6]。巨噬细胞的炎症反应中,MAPK位于NF-κB的上游,抑制其磷酸化可以导致LPS诱导的RAW 264.7巨噬细胞中IκBα降解的减少,进而下调p65的激活[1,7]。核苷结合寡聚域(NOD)样受体(NLR)家族pyrin结构域3(nucleotide-binding oligo-merization domain(NOD)like receptors(NLR)pyrin domain-containing 3,NLRP3)炎性小体是一种多蛋白复合体,能够激活caspase-1,caspase-1作为一种效应因子,能够切割蛋白质,将pro-IL-1β和pro-IL-18分别加工为成熟的促炎细胞因子IL-1β和IL-18[8],从而促进炎症反应的发生。模式识别受体(pattern recognition receptors,PRRs)是机体先天免疫系统的重要组成部分,PRRs会促进NF-κB途径和MAPK途径的激活,从而增加与NLRP3炎症体相关蛋白编码基因的转录[9]。
雷公藤(Tripterygiumwilfordii)属于卫矛科雷公藤属植物, 是一种传统的中草药。雷公藤最早记载于《神农本草经》,在中国、日本和朝鲜已经被广泛使用了几个世纪[10]。雷公藤中含有70多种成分,包括二萜、三萜类、苷类和生物碱[11],其中95%是萜类化合物。雷公藤具有免疫抑制、抗肿瘤、抗炎、抗HIV等功效,临床上常用于治疗免疫和炎性疾病,而二萜类成分被认为是这些活性的主要来源[12]。LPS诱导的RAW264.7细胞是炎症研究的经典模型,被广泛用于巨噬细胞相关炎症信号通路的研究中[4-5]。为了探究雷公藤二萜类化合物抗炎活性的具体作用机制,本研究采用LPS诱导的RAW264.7巨噬细胞炎症模型,对我们前期工作中从雷公藤中分离得到的一系列二萜类化合物进行抗炎活性筛选,发现其中包括松香烷型二萜、海松烷型二萜在内的7个化合物对NO的生成具有明显的抑制作用,对其中活性较好化合物进行抗炎机制探索,旨在进一步明确它们的作用机制。
1 材料
1.1 细胞株小鼠单核巨噬细胞白血病细胞RAW264.7购自中国科学院典型培养物保藏委员会昆明细胞库。
1.2 药材与试剂雷公藤干燥的茎于2019年7月购自于昆明市新螺蛳湾药材市场,并由昆明理工大学陈宣钦老师鉴定为雷公藤(Tripterygiumwilfordii),样品标本(KUMST20190716)存放在昆明理工大学生命科学与技术学院天然药物化学重点实验室。
DMEM培养基和胎牛血清购自美国Thermo Fisher公司,噻唑蓝(MTT)、二甲基亚砜(DMSO)和青链霉素混合液购自北京索莱宝科技有限公司,Griess试剂、一氧化氮合酶抑制剂(L-NMMA)和辣根过氧化物酶二抗购自上海碧云天生物技术有限公司,脂多糖(LPS)购自美国Sigma公司,ELISA试剂盒(IL-6、IL-1β、TNF-α)购自美国Novus Biologicals公司,IL-18的ELISA试剂盒购自武汉华美生物工程有限公司,单克隆抗体购自美国Cell Signaling Technology公司,羧酸盐修饰荧光微球(F8827)购自美国Invitrogen公司。
1.3 仪器Agilent 1200/1260高效液相色谱仪、分析型色谱柱Zrobax SB-C18反相柱、半制备型Zrobax SB-C18与C8反相柱均为Agilent公司产品;Western blot电泳仪,美国Bio-Rad公司产品;CO2恒温培养箱,美国Thermo Fisher公司产品;Spectra Max M2多功能读板机,美国Moleccular Devices公司产品。
2 方法
2.1 细胞培养小鼠单核巨噬细胞白血病细胞RAW264.7用含有10%胎牛血清和1%青链霉素混合液的DMEM培养基置于37 ℃,5% CO2培养箱中进行传代培养,收集对数生长期的细胞用于后续的实验。
2.2 样品配置精密称取化合物适量,用DMSO试剂配置成浓度为50 mmol·L-1的母液备用,4 ℃冰箱保存。
2.3 MTT法检测细胞活度取对数生长期RAW264.7细胞,按照3×104/孔接种到96孔细胞培养板内,置于37 ℃培养箱中培养24 h后,加入不同浓度的化合物(3.125、6.25、12.5、25、50 μmol·L-1)继续培养24 h,设置正常对照组(细胞+样品等量DMSO)和空白对照组(样品等量DMSO)。加入20 μL/孔MTT(5 g·L-1)继续孵育培养3.5 h后,吸去孔内的液体,加入150 μL/孔DMSO,避光振荡10 min使其混匀,多功能读板机490 nm处测量吸光度。
细胞活度/%=(OD实验组-OD空白对照组)/(OD正常对照组-OD空白对照组)×100%
2.4 Griess法检测NO含量取对数生长期RAW264.7细胞按照4×104/孔接种到 96孔细胞培养板内,置于37 ℃培养箱中培养24 h后,设置对照组(细胞+样品等浓度DMSO)、模型组(细胞+样品等浓度DMSO+100 μg·L-1LPS)和给药组(细胞+不同浓度化合物+100 μg·L-1LPS)继续孵育培养24 h后,收集上清后加入Griess试剂,多功能读板机540 nm处测量吸光度。
NO抑制率/%=(OD模型组-OD给药组)/(OD模型组-OD对照组)×100%
2.5 ELISA法检测细胞因子的分泌取对数生长期RAW264.7细胞,按照1.5×105/孔接种到12孔细胞培养板内,置于37 ℃培养箱中培养24 h后,分组处理同“2.4”,化合物预处理2 h后,再加入100 μg·L-1的LPS共同孵育24 h,收集上清,按照ELISA试剂盒说明书检测IL-6、IL-1β、IL-18和TNF-α的含量。
2.6 Western blot实验取对数生长期RAW264.7细胞,按照1.5×105个/孔接种到12孔细胞培养板内,置于37 ℃培养箱中培养24 h后,分组处理同“2.4”,化合物预处理2 h后,再加入100 μg·L-1的LPS共同孵育30 min(MAPK、NF-κB)或24 h(COX-2、iNOS、NLRP3、caspase-1、cleaved-caspase-1、STAT3),加入含1%蛋白酶抑制剂和PMSF的RIPA裂解液裂解蛋白。蛋白样品经10%的SDS-PAGE凝胶分离并转移到PVDF膜上,在4 ℃封闭液中封闭2 h后一抗中低温孵育过夜,再用相对应的二抗室温孵育1 h,经ECL化学发光并用成像仪进行显影,实验结果用ImageJ软件分析,用GraphPad Prism软件作图。
2.7 上清蛋白富集细胞处理同“2.5”,用1.5 mL的EP管收集上清液体与三氯乙酸按照4 ∶1混匀,置于冰上1 h后,12 000 r·min-1,4 ℃离心10 min,小心地吸去上清,每个EP管加入1 mL预冷的丙酮吹打沉淀,12 000 r·min-1,4 ℃离心15 min,重复3次,等丙酮挥发之后加入loading buffer制备蛋白样品(富集上清中蛋白用于检测cleaved-caspase-1)。
2.8 吞噬实验取对数生长期RAW264.7细胞,按照1.5×105个/孔接种到12孔细胞培养板内,置于37 ℃培养箱中培养24 h后,分组处理同“2.4”,给药24 h后弃去上清,每孔1 mL PBS小心清洗2次后,每孔加入1.5 mL的DMEM培养基和100 μL荧光微球(按照说明书提前配置好),然后在CO2培养箱避光孵育2 h,反应结束后弃去上清,每孔用1 mL的PBS小心清洗2次后,收集细胞于1.5 mL的EP管中,每管加入1 mL的PBS吹打均匀后,用流式细胞仪进行分析。
吞噬百分率/%=已吞噬的巨噬细胞/巨噬细胞总数×100%
2.9 统计学分析使用SPSS 23.0进行数据分析,实验结果用表示,组间差异使用单因素方差分析(One-way Anova)。
3 结果
3.1 雷公藤二萜类化合物对RAW264.7细胞活力及NO生成的影响我们在之前的工作中从干燥的雷公藤茎中分离得到了一系列化合物并进行了结构鉴定[13-14],为了寻找雷公藤中的活性物质,我们对其中分离得到的二萜类化合物进行了抗炎活性筛选,其中7个化合物具有抗炎活性,结构式如Fig 1所示。结果如Tab 1所示,雷公藤二萜类化合物1和6在50 μmol·L-1浓度内对RAW264.7细胞的细胞活力没有明显的影响;雷公藤二萜类化合物1、2、4、5、7、8、和9对NO的生成具有明显的抑制作用,IC50分别为(7.0±2.8)、(7.3±2.4)、(3.2±0.2)、(1.7±0.4)、(1.9±0.2)、(1.8±0.6)和(7.9±1.7) μmol·L-1,综上实验结果,我们选择雷公藤二萜类化合物1和6进行进一步的研究。
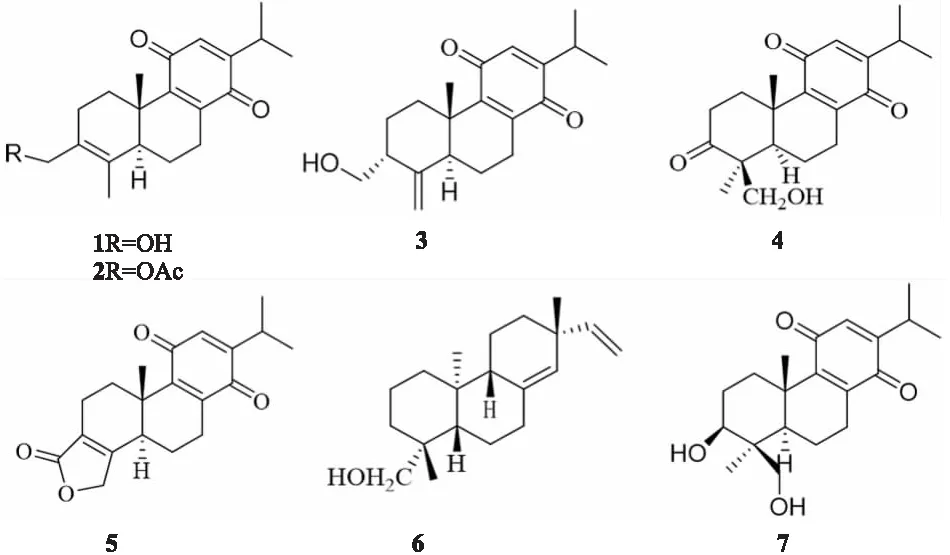
Fig 1 The structural formulas of seven compounds isolated from Tripterygium wilfordii
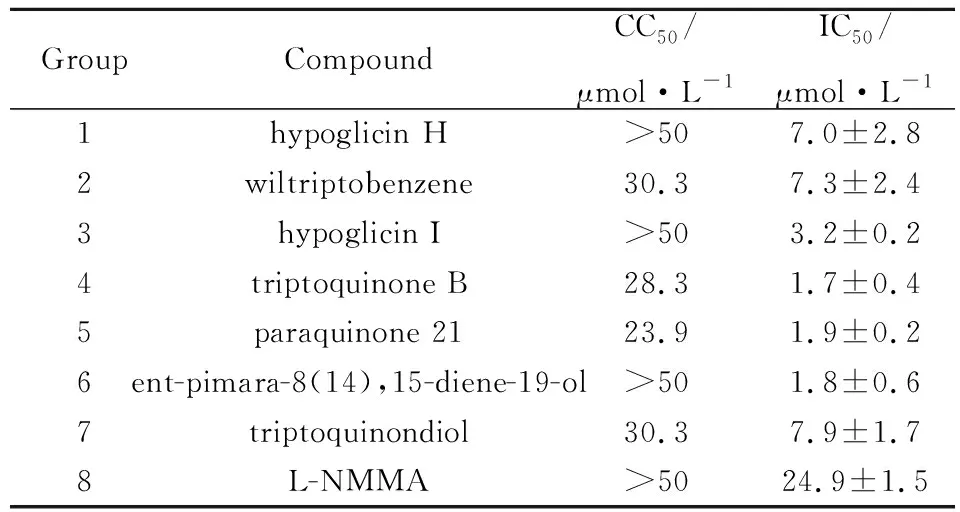
Tab1 Effects of seven compounds on cell activity and NO production of RAW264.7
3.2 雷公藤二萜类化合物对巨噬细胞中多种细胞因子的影响为了更进一步的确认雷公藤二萜类化合物1和6的抗炎活性,我们检测了其对LPS诱导的RAW264.7细胞中IL-6、IL-1β、IL-18和TNF-α分泌的影响,如Fig 2所示,与对照组相比,LPS诱导激活巨噬细胞炎症反应,明显增加IL-6、IL-1β、IL-18和TNF-α的分泌;与LPS组相比,化合物组呈剂量依赖性明显抑制IL-6、IL-1β和IL-18的分泌,但对TNF-α的分泌没有明显的影响。
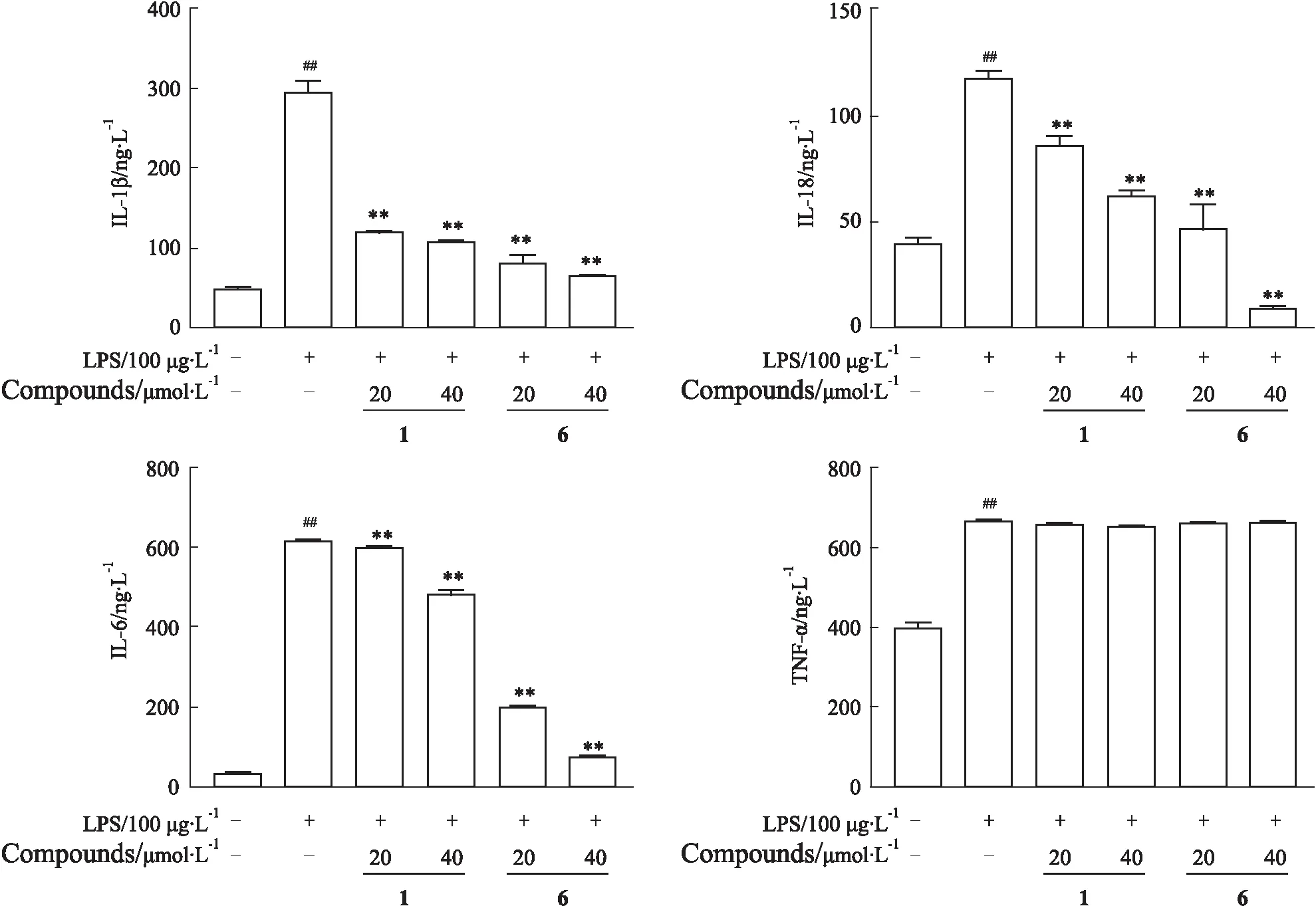
Fig 2 Effects of compound 1 and 6 on secretion of cytokines in RAW264.7 n=3)##P<0.01 vs Control;**P<0.01 vs LPS.1:hypoglicin H;6:ent-pimara-8(14),15-diene-19-ol
3.3 雷公藤二萜类化合物对巨噬细胞中MAPK信号通路的影响为了明确雷公藤二萜类化合物1和6的抗炎作用机制,我们检测了其对MAPK信号通路的影响,如Fig 3所示,与对照组相比,LPS处理激活RAW264.7细胞中MAPK信号通路,JNK、p38、ERK蛋白磷酸化明显增加;与LPS组相比,化合物组JNK、p38、ERK蛋白磷酸化的水平明显降低。这表明化合物可能是通过抑制MAPK信号通路的激活来发挥抗炎作用。

Fig 3 Effects of compound 1 and 6 on JNK, p38, ERK and their phosphorylation in LPS-induced RAW264.7 n=3)
3.4 雷公藤二萜类化合物对巨噬细胞中IκBα,STAT3及其磷酸化的影响为了进一步明确雷公藤二萜类化合物1和6的抗炎作用机制,我们检测了其对LPS诱导的RAW264.7细胞中IκBα,STAT3及其磷酸化的影响,如Fig 4所示,与对照组相比,LPS处理明显促进RAW264.7细胞中IκBα磷酸化,激活NF-κB信号通路,同时还引起STAT3的高度磷酸化,而化合物组呈剂量依赖性明显抑制RAW264.7细胞中的IκBα,STAT3磷酸化。这表明化合物可能是通过抑制NF-κB信号通路的激活以及STAT3的磷酸化来发挥抗炎作用。
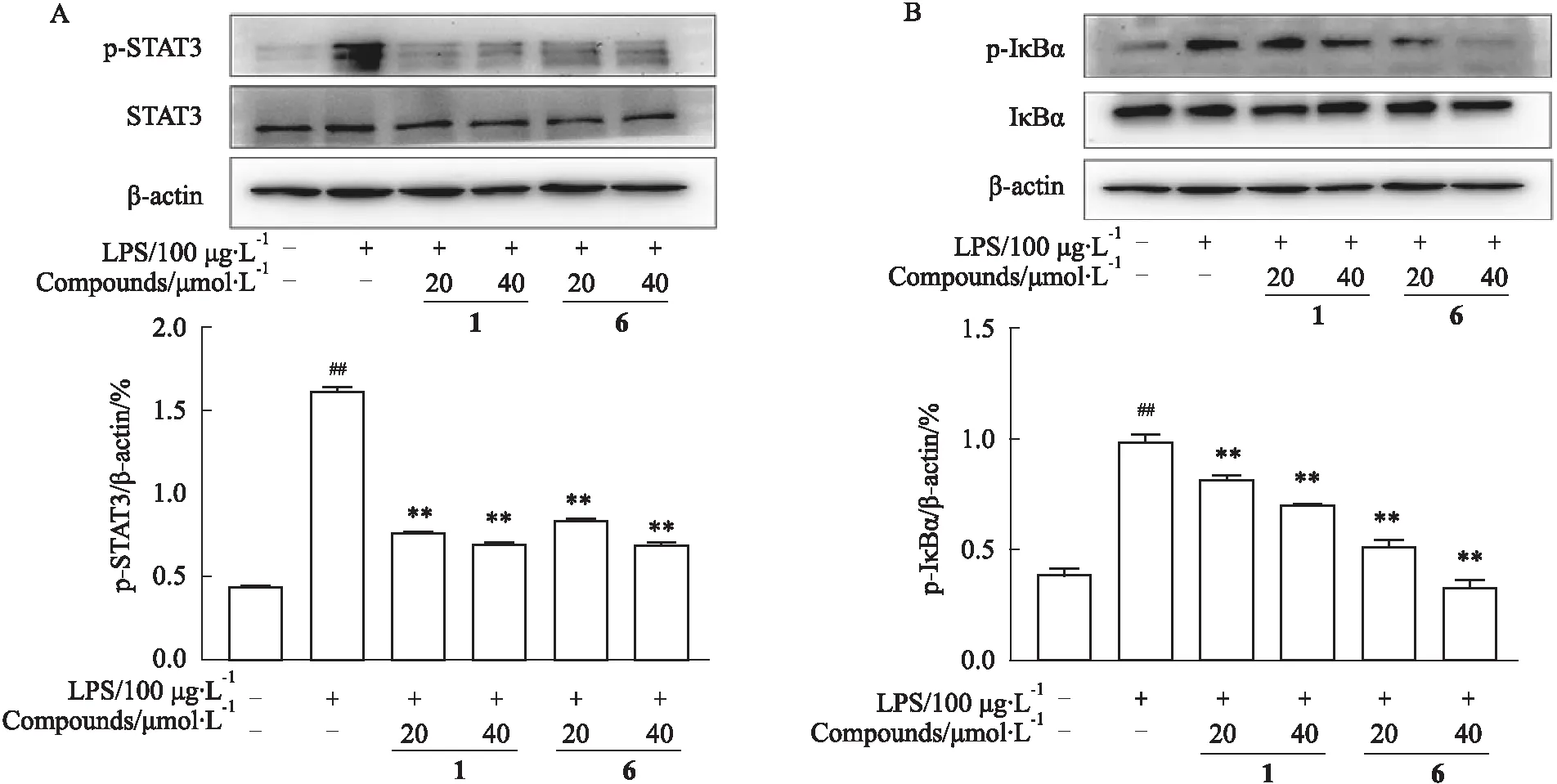
Fig 4 Effects of compounds on IκBα, STAT3 and their phosphorylation in Raw264.7 n=3)
3.5 雷公藤二萜类化合物对巨噬细胞中COX-2、iNOS表达和炎症小体生成的影响诱导型一氧化氮合酶(iNOS)和环氧合酶(COX-2)在炎症相关疾病的发展中起着关键作用,我们检测雷公藤二萜类化合物1和6对LPS诱导的RAW264.7细胞中COX-2、iNOS、NLRP3、caspase-1、cleaved-caspase-1的影响,如Fig 5所示,与对照组相比,LPS诱导的RAW264.7细胞中COX-2、iNOS、NLRP3、cleaved-caspase-1明显增加;与LPS组相比,化合物组呈剂量依赖性明显抑制RAW264.7细胞中的COX-2、iNOS、NLRP3、cleaved-caspase-1。
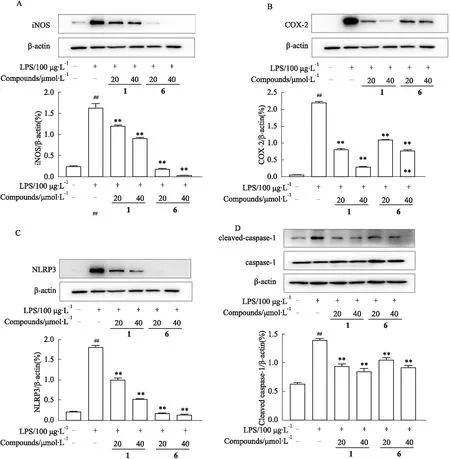
Fig 5 Effects of compounds on COX-2, iNOS, NLRP3, caspase1, cleaved-caspase1 in Raw264.7 n=3)
3.6 雷公藤二萜类化合物对对巨噬细胞吞噬功能的影响为了明确雷公藤二萜类化合物1和6是否能够调节巨噬细胞的吞噬功能,我们检测其对巨噬细胞吞噬功能的影响,结果如Fig 6所示,与空白组巨噬细胞吞噬百分率(34.71%)相比,LPS诱导RAW264.7细胞后能够增强其吞噬能力(47.32%),化合物单独处理巨噬细胞和化合物与LPS共同处理巨噬细胞的条件下,巨噬细胞的吞噬功能均被抑制。
4 讨论
巨噬细胞是免疫系统启动和调节免疫反应的哨兵,在应对病原菌、病毒、真菌等的免疫应答中起着关键的作用,它能够产生和分泌细胞因子,细胞因子可以调节感染或炎症的免疫反应,并通过复杂的相互作用网络调节炎症本身[2]。LPS作用于TLR4与受体结合后可以在巨噬细胞中引发多种炎症反应,介导促炎细胞因子、生长因子、趋化因子等的合成和释放[4-6]。
在LPS刺激下,JAK/STAT通路被激活,导致STAT3上705残基和STAT1上701残基酪氨酸被磷酸化[15]。STAT3被认为是免疫和炎症途径中的关键转录因子,STAT3可以通过延长RELA的核滞留在慢性炎症期间和转化细胞中维持NF-κB的持续激活,并且STAT3和NF-κB在多个水平上相互作用,两者都能调节炎症介质的表达,COX-2、iNOS和IL-6、TNF-α都受到NF-κB和STAT3的调控[16]。雷公藤的提取物在中国已被广泛用于治疗各种自身免疫性和炎症性疾病,包括类风湿性关节炎(RA)、系统性红斑狼疮(SLE)、强直性脊柱炎、牛皮癣等[10-12]。
为了探究雷公藤二萜类化合物1和6抗炎活性的具体作用机制,本研究检测了LPS诱导的RAW264.7巨噬细胞炎症模型中相关炎性介质的生成和炎症相关蛋白的表达。脂多糖激活的MAPK在炎性介质因子的分泌和p65的转位中起重要作用[1],MAPK和NF-κB都介导炎性介质(COX-2和iNOS)和细胞炎性因子(IL-6、IL-1β、IL-18等)的生成[5-7],研究结果显示雷公藤二萜类化合物1和6呈剂量依赖性的抑制ERK、JNK、p38、IκBα的磷酸化,但是对ERK、JNK、p38、IκBα蛋白的表达没有明显的变化,这表明雷公藤二萜类化合物1和6发挥抗炎作用可能是通过抑制MAPK相关蛋白磷酸化水平,使LPS诱导的RAW 264.7巨噬细胞中IκBα降解的减少,导致下调p65的激活,进而抑制炎性介质(COX-2和iNOS)和细胞炎性因子IL-6、IL-1β、IL-18的生成。
此外,本研究还发现雷公藤二萜类化合物1和6呈剂量依赖性的抑制NLRP3,cleaved-caspase-1的活化和STAT3的磷酸化水平。在巨噬细胞的免疫反应中,炎性小体是介导炎症反应的重要因素,NLRP3能够激活caspase-1,从而介导促炎细胞因子IL-1β和IL-18的分泌[9],促进炎症反应的发生。NF-κB途径和MAPK途径的激活也会促进NLRP3炎症体的生成[5,9]。并且有研究表明,抑制STAT3的磷酸化可以抑制下游的促炎细胞因子以及NLRP3启动子上组蛋白H3和H4的乙酰化,从而抑制NLRP3炎症小体的活化来介导炎症反应的进程[17]。
综上所述,雷公藤二萜类化合物1和6可能是通过抑制LPS诱导的RAW264.7细胞中MAPK和NF-κB信号通路以及STAT3磷酸化,减少炎症小体NLRP3的活化,降低炎性介质(COX-2和iNOS)和细胞因子(IL-6、IL-1β和IL-18)的表达来发挥抗炎作用,同时巨噬细胞的吞噬功能也受到抑制。本研究为阐明雷公藤二萜化合物抗炎活性的机制研究提供了理论依据和实验基础。

