浓香型菜籽油中极性多酚的提取及分析
符润灏,贾朋朋,2,吴立樟,罗 清,张 睿,段宝伟,操丽丽,2
(1.合肥工业大学食品与生物工程学院,安徽合肥 230601;2.安徽省农产品精深加工重点实验室,安徽合肥 230601)
菜籽油在我国拥有非常广阔的市场,同时我国是全球最大的菜籽油消费国[1]。菜籽油含有大量的不饱和脂肪酸,这些脂肪酸有益健康,可以预防心脑血管疾病;菜籽油中还富含生育酚、甾醇和多酚等活性物质,有助于提高其营养价值和氧化稳定性[2]。研究表明,油菜籽中含有丰富的多酚,含量是其他油料作物种子的10~30 倍[3],但油菜籽经过压榨之后,大部分多酚仍残留在菜籽粕中[4],并且菜籽油经过脱酸、脱色和脱臭等精炼工序,其中的多酚损失严重[5]。
菜籽油中多酚物质主要为Canolol、芥子酸、芥子碱、阿魏酸、丁香酸、白藜芦醇等,不同类型、不同等级的菜籽油中多酚的种类和含量存在一定的差异[6-7]。浓香型菜籽油符合中国人传统饮食习惯,在市场上深受广大消费者的喜爱。同时,浓香型菜籽油中富含多酚物质,具有良好的氧化稳定性。根据“极性悖论”及“胶体缔合”假说认为油脂体系中,极性强的抗氧化剂往往表现出更强的抗氧化活性[8],因此试验对浓香型菜籽油中极性多酚物质提取工艺进行优化,并利用HPLC 分析其中酚类物质分布情况。
1 材料与方法
1.1 材料与试剂
四级压榨浓香菜籽油,市售;没食子酸标准品、多酚标准品(Canolol、芥子酸、芥子碱、咖啡酸、白藜芦醇),阿拉丁试剂公司提供;福林酚、甲醇、乙醇、丙酮、乙腈、碳酸钠等,均为国产分析纯;乙酸、甲醇,色谱纯。
1.2 仪器与设备
T6 型新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司产品;MTN-2800D 型氮吹仪,天津奥特塞恩斯公司产品;万分之一电子天平,赛多利斯科学仪器有限公司产品;5430R 型冷冻离心机,德国Eppendorf 公司产品;Waters 高效液相色谱仪,美国Waters 公司产品。
1.3 试验方法
1.3.1 菜籽油极性多酚的提取
称取1.50 g 菜籽油样品,分别加入不同体积、不同比例的甲醇、乙醇、丙酮、乙腈水溶液,混合均匀,涡旋振荡提取一定时间,以转速5 000 r/min离心10 min,取下层清液即得菜籽油极性多酚提取液。
1.3.2 单因素试验
分别考查溶剂种类(甲醇、乙醇、丙酮、乙腈)、提取时间(2,4,6,8,10 min)、溶剂体积分数(30%,50%,60%、70%,80%,90%,100%)、提取次数(1,2,3,4,5 次)、料液比(1∶1.0,1∶1.5,1∶2.0,1∶2.5,1∶3.0 g/mL)5 个单因素对菜籽油极性多酚提取量的影响。
1.3.3 正交试验
根据单因素试验结果,不将溶剂种类考虑进正交试验,为选取出各单因素的最佳组合,分别以溶剂比(A)、提取次数(B)、提取时间(C)、料液比(D)4 个因素为基础,进行正交试验。每个因素,3 个水平,以极性多酚提取量作为衡量指标。选用L9(34)正交试验表来进行试验。
正交试验因素与水平设计见表1。
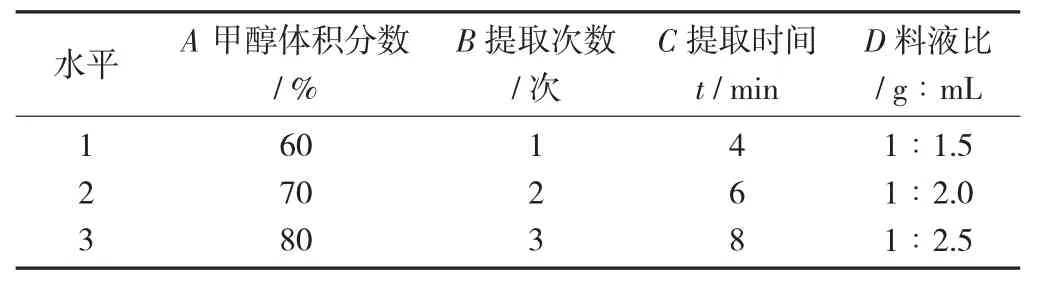
表1 正交试验因素与水平设计
1.3.4 菜籽油极性多酚提取率的测定
参照Folin-Ciocalteu 法[9]测定菜籽油中极性多酚含量。取1.0 mL 提取液于比色管中,加入0.5 mL 福林酚试剂、6.0 mL 蒸馏水,静置3 min 后,加入质量分数为7.5%的碳酸钠溶液2.5 mL,避光静置反应60 min后,于波长765 nm 处测其吸光度。以没食子酸为标准品,以溶液质量浓度(Y)为横坐标、吸光度(X)为纵坐标,建立标准曲线,得到回归方程为Y=0.020 5X-0.011 6(R2=0.999 2),据此方程求得提取液中极性多酚含量,并按下式计算极性多酚提取量[10]。
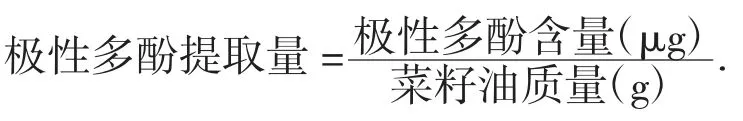
1.3.5 HPLC 法分析菜籽油中极性多酚化合物
将3 次提取的菜籽油甲醇提取液合并,用氮气吹干后,用1.0 mL 甲醇复溶,过0.22 μm 微孔滤膜后进行HPLC 分析。色谱分析条件如下:
色谱柱:Venusil MP C18(2)型(4.6 mm×250 mm,5 μm);流动相A:甲醇;流动相B:乙酸溶液(pH 值2.8),梯度洗脱(0~5 min,20%~30% A;5~30 min,30%~50% A;30~35 min,50%~20% A;35~40 min,20% A,流速1.0 mL/min,柱温25 ℃,检测波长为320 nm 和280 nm,进样量15 μL。
2 结果与分析
2.1 提取溶剂对极性多酚提取量的影响
在溶剂∶水=7∶3,料液比1∶1(g∶mL),提取时间6 min,重复提取3 次的条件下分别考查不同提取溶剂(甲醇、乙醇、丙酮、乙腈)对菜籽油极性多酚提取量的影响。
提取溶剂种类对极性多酚提取率的影响见图1。
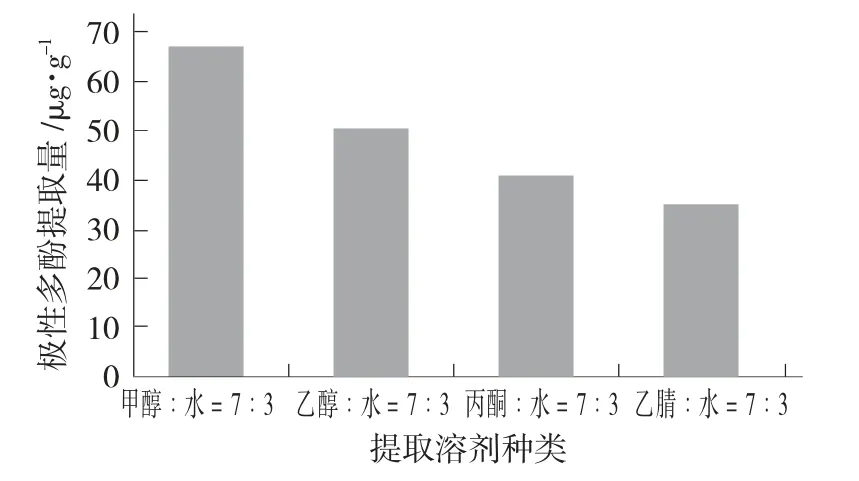
图1 提取溶剂种类对极性多酚提取量的影响
由图1 可看出,以甲醇作为提取溶剂时,极性多酚提取量显著得高于其他3 种溶剂,提取效果最好,极性多酚提取量达到67.20 μg/g,根据极性相似相溶的原理,这可能是由于甲醇极性较高的原因,因此选择甲醇/水作为提取溶剂。
2.2 提取时间对极性多酚提取量的影响
以70%甲醇作为提取溶剂,料液比1∶1(g∶mL),重复提取3 次的条件下分别考查不同提取时间(2,4,6,8,10 min)对菜籽油极性多酚提取率的影响。
提取时间对极性多酚提取量的影响见图2。
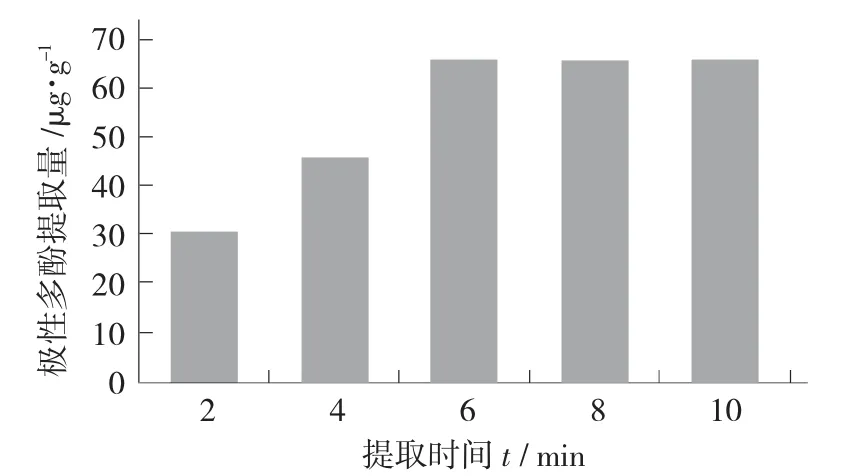
图2 提取时间对极性多酚提取量的影响
由图2 可看出,提取时间从2 min 升高到6 min的过程中,极性多酚提取量逐渐升高,提取6 min极性多酚提取量达到66.14 μg/g;6 min 之后,随着提取时间的增加,极性多酚提取量无显著性提高,可能是由于随着振荡时间的延长,菜籽油中的极性多酚已经基本被完全提取,因此选择6 min 作为最佳提取时间。
2.3 甲醇体积分数对极性多酚提取量的影响
以甲醇/ 水作为提取溶剂,料液比1∶1(g∶mL),提取时间6 min,重复提取3 次的条件下分别考查不同甲醇体积分数(30%,50%,60%,70%,80%,90%,100%)对菜籽油极性多酚提取量的影响。
甲醇体积分数对极性多酚提取量的影响见图3。
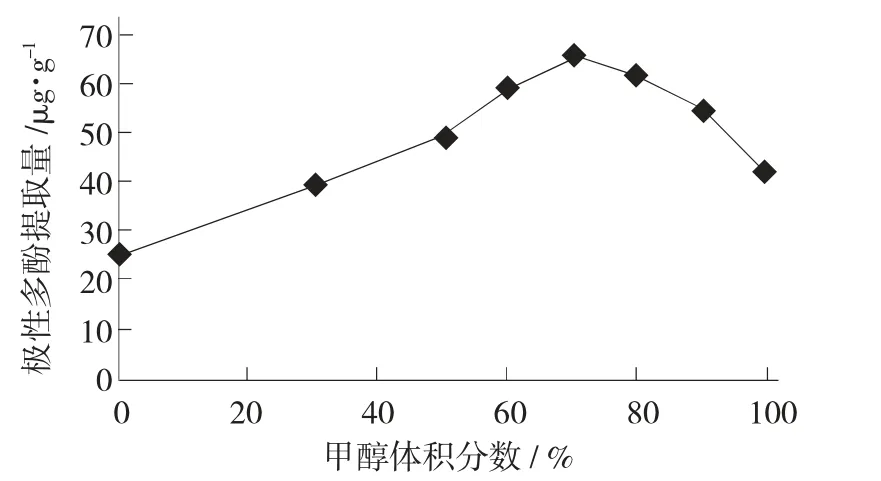
图3 甲醇体积分数对极性多酚提取量的影响
由图3 可看出,以纯甲醇作为提取溶剂时,极性多酚提取量仅为24.89 μg/g,随着甲醇体积分数的增加,极性多酚提取量呈现出先升高后降低的趋势;当甲醇体积分数为70%时提取效果最好,极性多酚提取量达到66.43 μg/g,因此选择将70%体积分数的甲醇作为提取溶剂。
2.4 提取次数对极性多酚提取量的影响
以70%甲醇作为提取溶剂,料液比1∶1(g∶mL),提取时间6 min 的条件下分别考查不同提取次数(1,2,3,4,5 次)对菜籽油极性多酚提取量的影响。
提取次数对极性多酚提取量的影响见图4。
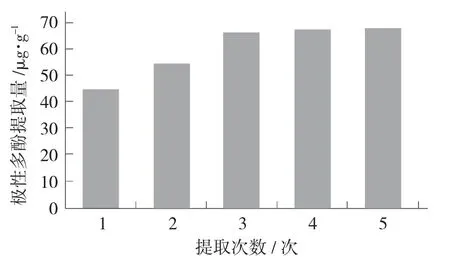
图4 提取次数对极性多酚提取量的影响
由图4 可看出,随着提取次数的增多,菜籽油极性多酚提取量逐渐增高,提取3 次后极性多酚提取率达到66.14 μg/g,但3 次提取后,极性多酚提取量没有显著的提高,考虑到溶剂消耗等实际因素,因此选择3 次作为最佳提取次数。
2.5 料液比对极性多酚提取量的影响
以70%甲醇作为提取溶剂,提取时间6 min,重复提取3 次的条件下分别考查不同料液比(1∶1.0,1∶1.5,1∶2.0,1∶2.5,1∶3.0)对菜籽油极性多酚提取量的影响。
料液比对极性多酚提取量的影响见图5。
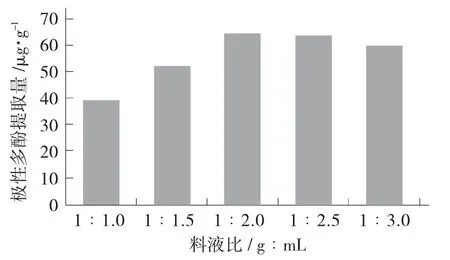
图5 料液比对极性多酚提取量的影响
由图5 可看出,随着溶剂比例的增加,极性多酚提取率呈现先升高后降低的趋势,可能是由于溶剂的增加会菜籽油和溶剂之间多酚浓度差,有利于多酚的转移扩散。当料液比为1∶2(g∶mL)时,极性多酚提取量最高,最高提取量达到64.84 μg/g,因此选择1∶2(g∶mL)作为最佳料液比。
2.6 正交试验结果
正交试验结果见表2。
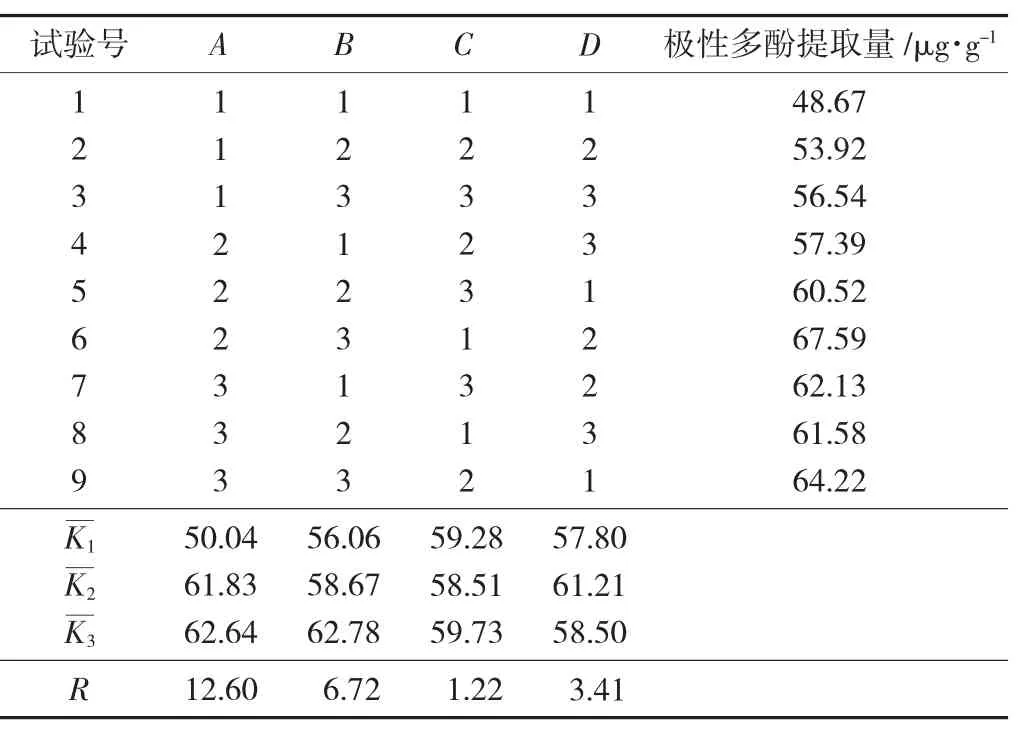
表2 正交试验结果
由表2 可看出,最佳工艺条件为A3B3C3D2,即体积分数为80%的甲醇溶液为提取溶剂,提取次数3 次,提取时间8 min,料液比1∶2(g∶mL)。在最佳条件提取条件下,菜籽油极性多酚提取量达到68.72 μg/g。溶剂比、提取次数、提取时间、料液比均对菜籽油极性多酚提取量有不同程度的影响,影响最大的是溶剂比,其余依次是提取次数、料液比、提取时间。
正交试验方差分析见表3。
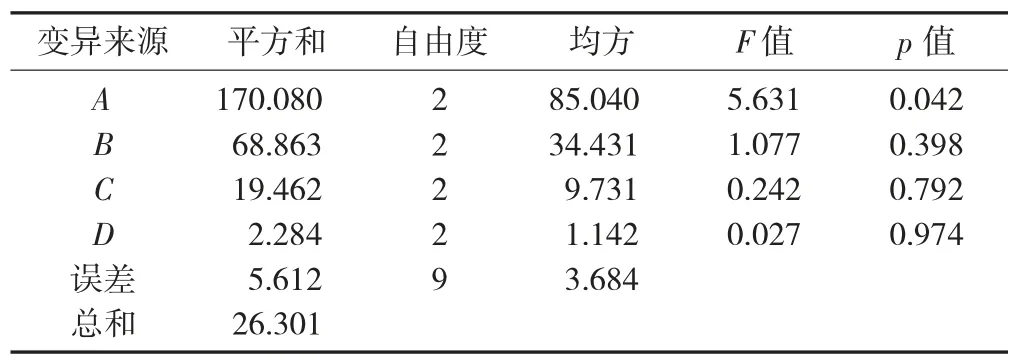
表3 正交试验方差分析
2.7 HPLC 法分析菜籽油极性多酚组分
多酚混合标准品(A)和菜籽多酚提取液(B)HPLC 图谱见图6。
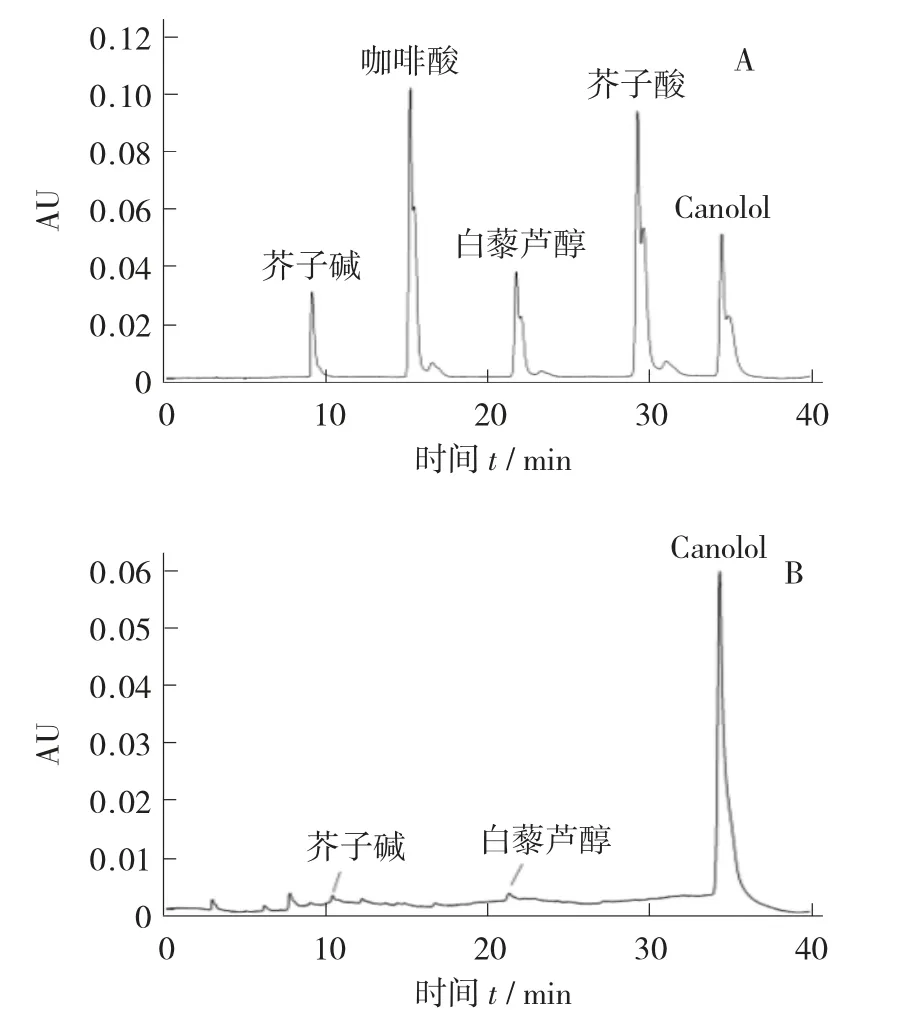
图6 多酚混合标准品(A)和菜籽多酚提取液(B)HPLC 图谱
由图6 可看出,浓香型菜籽油中多酚主要由Canolol、芥子碱、白藜芦醇等酚类物质构成,其中Canolol 的含量最高,达到68.72 μg/g,其占总酚含量的91.36%。
3 结论
通过单因素试验和正交试验优化了浓香型菜籽油中极性多酚的提取工艺,结果表明,菜籽油中极性多酚最佳提取工艺条件为以体积分数80%的甲醇溶剂作为提取溶剂,料液比1∶2(g∶mL),涡旋振荡8 min 后,以转速5 000 r/min 离心10 min,收集下清液,重复3 次上述操作。在最佳工艺条件下,浓香型菜籽油极性多酚提取量可达到68.72 μg/g,HPLC法分析其中多酚组分,Canolol 是浓香型菜籽油中含量最高的酚类物质,达到91.36%。

