鼻息肉组织相关受体表达与Eos浸润相关性
赵 冉 许建华
鼻腔组织高度水肿是鼻息肉的主要表现,发病率为1%~4%[1]。鼻黏膜嗜酸性粒细胞(eosinophils,Eos)浸润增多是鼻息肉发病的主要病理基础之一,可致鼻息肉组织微环境失调,加重鼻息肉病情[2]。白介素-5(interleukin-5,IL-5)可通过刺激Eos前体细胞的增殖、分化来调节Eos浸润程度,是Eos的重要趋化因子[3]。芳香烃受体(aryl hydrocarbon receptor,AhR)可与配体相结合参与多种免疫反应过程并调节机体功能,与哮喘、特异性皮炎和类风湿性关节炎等自身免疫疾病的发病密切相关[4]。维甲酸相关孤儿受体(retinoic acid-related orphan γt,RORγt)是小鼠及人类辅助性T细胞17(T helper cell 17,Th17)主要转录因子,通过促进Th17细胞分化和特异性表达分泌参与癌症、感染性疾病和免疫疾病的发病过程[5]。既往研究[6]指出,IL-5可刺激Eos生物学活性继而影响鼻息肉发病。但AhR、RORγt等细胞因子是否同样与Eos浸润以及鼻息肉发病机制有关目前尚不明确。本研究对鼻息肉患者息肉组织中IL-5、AhR和RORγt表达水平进行检测,分析其与Eos浸润程度之间的关系,以深入了解鼻息肉的发病机制,为临床治疗鼻息肉提供参考。
1 资料与方法
1.1 一般资料 选取2021年3~12月重庆医科大学附属渝北医院耳鼻喉科收治的37例鼻内镜下行鼻窦手术切除的鼻息肉患者作为息肉组,同期20例行单纯鼻中隔偏曲矫正术的中鼻甲黏膜患者作为正常组。两组患者性别、年龄、病程等一般资料相比,差异无统计学意义(P>0.05)。按照浸润程度不同将患者分为I度浸润组(n=11)、Ⅱ组浸润组(n=17)和Ⅲ度浸润组(n=9),Ⅰ度浸润组男性7例,女性9例,年龄(32.10±2.85)岁;Ⅱ度浸润组男性9例,女性8例,年龄(32.18±3.11)岁;Ⅲ度浸润组男性5例,女性4例,年龄(32.15±2.79)岁,3组患者性别、年龄等一般资料相比,差异无统计学意义(P>0.05)。本研究经重庆医科大学附属渝北医院伦理委员会批准(伦理批号:ZCYLC20200815)。
1.2 纳入与排除标准 纳入标准:①息肉组患者均符合《慢性鼻-鼻窦炎诊断和治疗指南》[7]中指出的鼻息肉相关诊断标准;②所有患者均经术前鼻内窥镜检查、CT检查及术后病理检查证实为鼻窦炎鼻息肉或鼻中隔偏曲者;③临床资料完整,均留取鼻息肉或鼻黏膜组织待测者。排除标准:①近1个月内接受过糖皮质激素、类固醇激素及抗组胺药物治疗者;②近1周内并发急性呼吸道感染者;③合并变异性鼻炎、真菌性鼻窦炎;④合并哮喘患者。
1.3 样本收集及保存 息肉组患者均于鼻内窥镜视野下钳取3 mm×3 mm的息肉头端组织,正常组研究对象取距鼻甲头端上缘4~5 mm处的正常黏膜组织,生理盐水洗去杂质后用洁净的纱布蘸干水分,以4%多聚甲醛固定24~48 h,取其中一部分以石蜡包埋后制成组织切片,另一部分于4℃条件下保存于70%乙醇溶液中。
1.4 检测方法
1.4.1 实时荧光定量聚合酶链式反应(quantitative Real-time polymerase chain reaction,qRT-PCR)[8]取经上述方法处理后的两组研究对象冷冻鼻息肉组织及鼻黏膜组织,以Trizol试剂提取组织中的总RNA,采用反转录试剂盒(上海康朗生物科技有限公司,货号:KL-170403-10)将样本中的总RNA逆转录成cDNA,采用实时荧光定量PCR仪(美国Invitrogen公司,型号:ABI 7500)进行qRT-PCR,以β-actin(上海艾博抗公司,货号:ab8226)为标准化内参检测鼻息肉及鼻黏膜组织中IL-5和AhR的表达水平。见表1。

表1 IL-5和AhR引物设计
1.4.2 苏木素-伊红染色法(hematoxylin-eosin staining,HE)和免疫组织化学法 取经上述方法处理后的两组研究对象鼻息肉及鼻黏膜组织石蜡切片,均行HE染色和RORγt免疫组化[9]。石蜡标本脱蜡水化后以pH值为7.4的磷酸盐缓冲液冲洗3次,以枸橼酸盐缓冲液高温高压修复抗原,室温下与3%过氧化氢溶液共同孵育10 min,磷酸盐缓冲液冲洗3次,与50 μL的RORγt一抗室温下共同培养1 h,磷酸盐缓冲液冲洗3次,滴加50 μL的聚合物增强剂,室温下共同培养20 min后磷酸盐缓冲液再次冲洗3次,与50 μL酶标鼠抗兔聚合物室温下共同培养30 min,磷酸盐缓冲液冲洗3次。加入DAB显色液共同培养5 min,电镜下观察到棕黄色或黄色即为阳性显色。苏木精染色液复染后以0.1%氯化氢溶液分化,流水冲洗后氨水返蓝,梯度乙醇脱水后透明封片,晾干后电镜下观察。
1.5 观察指标 ①病情程度:参考《慢性鼻-鼻窦炎诊断和治疗指南》[7]和文献[10]对所有研究对象进行视觉模拟量表(visual analog scale,VAS)评分、CT评分和内镜评分;②实验室指标:观察并比较两组研究对象鼻息肉组织和鼻黏膜组织中IL-5、AhR、RORγt和Eos计数,依据400倍镜视野下100个炎性细胞中Eos计数水平计算Eos浸润程度,将浸润指数为0%~33%视为I度浸润,浸润指数为34%~66%视为Ⅱ度浸润,浸润指数为67%~100%视为Ⅲ度浸润[11]。比较不同浸润程度患者鼻息肉组织IL-5、AhR和RORγt表达水平,并分析鼻息肉组织IL-5、AhR和RORγt表达水平与Eos浸润程度之间的相关性。

2 结果
2.1 两组研究对象VAS评分、CT评分和内镜评分比较 息肉组患者VAS评分、CT评分和内镜评分均高于正常组,差异有统计学意义(P<0.05)。见表2。
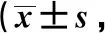
表2 两组研究对象VAS评分、CT评分和内镜评分比较分)
2.2 两组研究对象IL-5、AhR和RORγt表达水平比较 息肉组患者鼻息肉组织中IL-5、AhR和RORγt表达水平均高于正常组,差异有统计学意义(P<0.05)。见表3、图1。
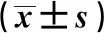
表3 两组研究对象IL-5、AhR和RORγt表达水平比较
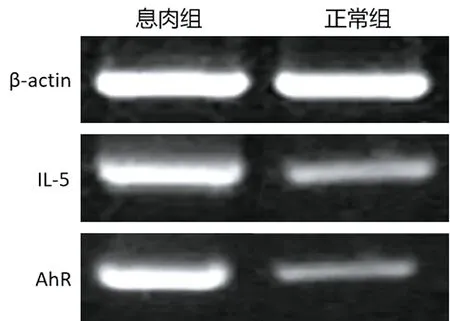
图1 两组研究对象IL-5和AhR的mRNA表达水平比较
2.3 两组研究对象嗜酸性粒细胞浸润程度比较 息肉组患者Eos计数和Eos密度均高于正常组,差异有统计学意义(P<0.05)。见表4、图2。
表4 两组研究对象嗜酸性粒细胞浸润程度比较
2.4 不同浸润程度患者鼻息肉组织IL-5、AhR和RORγt表达水平比较 3组不同浸润程度患者息肉组织中IL-5、AhR和RORγt表达水平差异有统计学意义(P<0.05)。见表5。

注:A为息肉组;B为正常组;箭头所示为嗜酸性粒细胞。
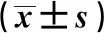
表5 不同浸润程度患者鼻息肉组织IL-5、AhR和RORγt表达水平比较
2.5 鼻息肉组织IL-5、AhR和RORγt表达水平与嗜酸性粒细胞浸润程度的相关性 鼻息肉组织中IL-5、AhR和RORγt表达水平与Eos计数及Eos密度均呈正相关关系(P<0.05)。见图3。

注:IL-5为白介素-5,AhR为芳香烃受体,RORγt为转录因子维甲酸相关孤儿受体,EOS为嗜酸性粒细胞。
3 讨论
鼻息肉是指鼻腔及鼻窦黏膜并发慢性炎症性疾病,患者临床表现为单侧或双侧持续性鼻塞、流涕且伴有渐进性加重,部分患者还因息肉阻塞鼻道、咽鼓管等部位引发嗅觉减退、耳鸣和听力下降[12]。现阶段临床治疗鼻息肉多采用糖皮质激素辅助鼻内镜切除手术方式,但存在易复发问题[13]。本研究从鼻息肉发病机制出发,探讨息肉组织与正常黏膜组织中IL-5、AhR、RORγt表达和Eos浸润差异,分析IL-5、AhR和RORγt与Eos浸润之间的关系,旨在为临床治疗鼻息肉提供更多思路。
本研究结果显示,息肉患者各项评分、组织标本在IL-5、AhR、RORγt表达和Eos浸润程度均高于正常组,且3组不同浸润程度患者息肉组织中IL-5、AhR和RORγt表达水平差异有统计学意义(P<0.05),表明IL-5、AhR和RORγt在鼻息肉患者Eos浸润及发病过程中发挥重要作用。IL-5是诱导Eos浸润的主要炎性细胞因子[14],AhR可与小分子配体结合促进Th17细胞产生白介素-17等炎性介质[15],RORγt可与信号转导和转录激活因子5结合加速Th17释放炎性细胞因子[16]。Eos浸润是导致鼻息肉加重的重要病理基础,趋化的Eos大量聚集于临近息肉组织,引起IL-5、白介素-17等炎性细胞因子大量释放,加速中性粒细胞聚集,并持续作用于上皮细胞、成纤维细胞、基底膜及呼吸道黏膜,使得息肉附近血管通透性增加,EOS浸润和息肉病情进行性加重[17]。因此,鼻息肉组织中Eos浸润程度不同,IL-5、AhR和RORγt表达水平也不同。
本研究发现,鼻息肉组织中IL-5、AhR和RORγt表达水平与Eos计数及Eos密度均呈正相关关系,这与李帅祥等[18]研究结论相似。IL-5作为诱导Eos浸润发生的最关键因子,对于鼻息肉组织中Eos浸润增加具有重要调节作用,可与Th17细胞协同作用加重Eos浸润[19]。AhR可与其受体结合参与Th17炎性反应的发生,与低浓度的转化生长因子-β和IL-5、白介素-6相互作用,上调细胞及组织中RORγt的表达,诱导TH17细胞分化,使Th17反应增强,诱导基质细胞分泌大量的白介素-6、前列腺素E2、一氧化氮等炎性介质,增厚鼻息肉组织基底膜,加速基质纤维化进程和组织结构重塑,引起鼻腔黏膜慢性炎症性损伤[20],进一步增加Eos浸润,引起鼻息肉组织中Eos计数和密度增加[21]。
综上所述,鼻息肉组织中IL-5、AhR和RORγt水平与Eos浸润程度有关,监测上述细胞因子的表达可作为预测和判断Eos浸润和鼻息肉发病的有效指标,对于鼻息肉的临床诊治有较高的指导价值。

