骨髓间充质干细胞与CD133+肾脏细胞治疗急性肾损伤的机制研究
黄远航,范立明,黄盈,童若宇,申萌,周淑珍,李璟,丁遂碧
(中国人民解放军南部战区总医院肾脏病科,广东 广州 510010)
急性肾损伤(Acute kidney injury, AKI)是指由于多种病因引起的肾功能快速下降而出现的临床综合征[1]。可发生于既往无肾脏病者,也可发生在原有慢性肾脏病的基础上。若不及时给予针对性治疗,会导致肾功能衰竭,对患者生命造成严重威胁[2]。目前有关AKI尚未特定的治疗,相关研究证实,抗氧化剂、利尿剂等多种药物治疗可预防性的改善AKI患者症状,但治疗效果仍无法令人满意,其死亡率仍居高不下,且预后较差[3]。
既往研究显示,肾脏损伤后的修复、再生有多种干细胞参与,其中以骨髓间充质干细胞(mesenchymal stem cell, MSCs)、肾脏MSCs研究报道较多见,在治疗AKI上具有一定疗效[4-5]。然而有关两者对AKI修复作用的大小尚未清楚。故本组就MSCs与CD133+肾脏细胞治疗急性肾损伤的机制进行了研究,以此为临床治疗AKI提供新的方向。
1 材料与方法
1.1 材料
选取由山东大学医学院实验动物中心提供的6~8周龄雄性C57 BL/6小鼠作为实验对象,共48只,体质量(20.01±2.24)g。根据不同的治疗方案将48只小鼠分为正常对照组、缺血再灌注损伤(I/R)组、I/R+MSCs组及I/R+CD133+组4组,每组12只。本次实验经医院伦理委员会批准。
1.2 方法
1.2.1骨髓MSCs、肾脏MSCs的制备 本研究48只C57 BL/6小鼠(湖北贝恩特生物科技有限公司)骨髓MSCs分离采用Percoll密度梯度离心法结合贴壁分离法。随后采用F12-DMEM细胞培养(购自美国Hyclone公司)基进行培养。当细胞生长到80 %~90 %融合时,用0.25%胰酶消化,进行传代培养,收集足够数量的细胞以备后续使用。取第3代细胞,0.05%胰酶消化成单细胞悬液,PBS 洗涤2次,分别加入荧光标记的间充质标志物CD29、CD90 以及血源性标志物CD34、CD45的流式抗体,4 C孵育30 min, PBS 洗去未标记的抗体,1%多聚甲醛固定后应用流式细胞仪检测。
CD133+肾脏细胞分离采用免疫磁珠筛选法结合贴壁分离法,将分离出的CD133+肾脏细胞进行培养。当细胞生长到80%~90% 融合时,进行传代培养,收集足够数量的细胞备用。用免疫荧光法测定其有无表达。
1.2.2不同组别治疗方法 4组均进行常规麻醉,麻醉药物:2%戊巴比妥钠溶液;打开腹腔,用不同的方法对暴露肾蒂进行处理。(1)正常对照组:肾蒂暴露10 min,将腹腔关闭,即刻尾静脉注射生理盐水,注射剂量0.2 mL;(2)I/R组:双侧肾蒂用动脉夹夹闭10 min,随后松开,将腹腔关闭,即刻尾静脉注射生理盐水,注射剂量0.2 mL;(3)I/R+MSCs组:双侧肾蒂用动脉夹夹闭10 min,随后松开,将腹腔关闭,分别即刻尾静脉注射0.2 mL含有 约2×106个MSCs的PBS溶液(购自武汉博士德生物工程有限公司);(4)I/R+CD133+组:双侧肾蒂用动脉夹夹闭10 min,随后松开,将腹腔关闭,分别即刻尾静脉注射0.2 mL含有 约2×106个MSCs的CD133+肾脏细胞溶液。4组小鼠在同一环境下喂养,自由饮食。
1.2.3术后处理 在模型建立的第1、2、4、8 d分别处死部分小鼠(每次每组均处死3只),采用无菌注射器进行心脏穿刺抽血,随后离心,保留血清,-20 ℃低温保存备用。获取肾脏组织,制作病理切片。
1.3 观察指标
比较各组小鼠术后不同时间点血清尿素氮(blood urea nitrogen,BUN)与肌酐(creatinine,Cr)水平;检测方法:采用Beckman 自动生化仪检测;对病理切片进行急性肾小管坏死评分,计算其平均值,作为肾小管坏死的评分指数(ATN评分),随后比较各组不同时间点ATN评分;比较各组小鼠术后不同时间点肾组织匀浆中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10, IL-10)、肝细胞生长因子(hepatocyte grow th factor, HGF)、骨形态发生蛋白-7(bone morphogenetic protein-7,BMP-7)的浓度。检测方法上述因子均采用酶联免疫法进行检测,检测试剂盒购自上海钰森公司。每只小鼠均从左肾取80 mg置于研磨器中,加入1 mlPBS,随后研磨至无肉眼可见的组织块。将匀浆移入1.5 ml离心管,1500 g离心5 min,取上清,移入另一个离心管,进行检测。
1.4 统计学方法
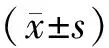
2 结 果
2.1 骨髓MSCs与CD133+肾脏细胞培养结果
经分离培养后,骨髓MSCs在培养皿中呈梭形(见图1);CD133+肾脏细胞经免疫荧光法检测,结果显示细胞呈现绿色荧光(见图2)。

图1 传代培养的骨髓MSCs(400×)
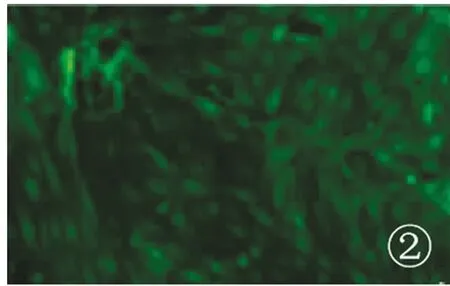
图2 CD133+肾脏细胞(400×)
2.2 各组小鼠术后不同时点BUN、Cr水平比较
I/R+MSCs组、I/R+CD133+组术后BUN、Cr水平均显著高于正常对照组;术后4、7 d的BUN、Cr水平均低于I/R组,其中I/R+MSCs组以术后8 d最为显著(P<0.05);I/R+CD133+组以术后4 d最为显著(P<0.05)。详情见表1。
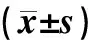
表1 各组小鼠术后不同时点BUN、Cr水平比较
2.3 各组小鼠术后不同时点ATN评分比较
I/R+MSCs组、I/R+CD133+组术后ATN评分均显著高于正常对照组;术后2、4、7 d的ATN评分均低于I/R组,I/R+MSCs组与I/R+CD133+组术后不同时点ATN评分比较,I/R+CD133+组术后不同时点ATN评分均略低于I/R+MSCs组,但组间比较无差异(P>0.05)。详情见表2。
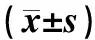
表3 各组小鼠术后不同时点ATN评分比较
2.4 各组小鼠术后TNF-α、IL-10、HGF、BMP-7水平变化情况比较
I/R+MSCs组、I/R+CD133+组术后TNF-α水平均显著高于正常对照组术后,低于I/R组(P<0.05);术后2、4、8 d I/R+MSCs组、I/R+CD133+组TNF-α水平有所下降,但仍高于正常对照组,低于I/R组。详情见表3。
表3 各组小鼠术后不同时点TNF-α水平比较
I/R+MSCs组、I/R+CD133+组术后IL-10、HGF、BMP-7水平均低于正常对照组,高于I/R组(P<0.05);术后2、4、8 d I/R+MSCs组、I/R+CD133+组IL-10、HGF、BMP-7水平有所上升,但仍低于正常对照组,高于I/R组。详情见表4、5、6。
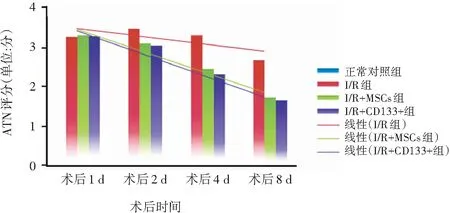
图3 各组小鼠术后不同时点ATN评分情况
表4 各组小鼠术后不同时点IL-10水平比较
表5 各组小鼠术后不同时点HGF水平比较
表6 各组小鼠术后不同时点BMP-7水平比较
3 讨 论
AKI是临床上常见的一种疾病,发病率呈逐渐上升趋势,且死亡率高,预后不佳[6]。目前有关干细胞治疗AKI的报道最多的是骨髓、肾脏MSCs。骨髓MSCs是在骨髓中发现的一种起源于胚胎中胚层,具有自我复制和多向分化潜能的非造血干细胞,对骨髓造血干细胞起支持、诱导作用[7-8]。其次因骨髓MSCs易于提取和体外培养、免疫原性和成瘤性低等特点,使其在临床治疗AKI与实验研究等方面优势更大[9]。国外大量研究发现,使用MSCs治疗AKI安全可靠,且效果良好,可有效减轻患者肾功能损伤,促进肾功能恢复[10-11]。
肾脏MSCs主要来源于人体后肾间质,在成人肾脏中可长时间不进行有丝分裂,但在适当环境下可快速进行大量分裂繁殖,且可分化为成熟细胞,具有干细胞的多功能性及自我更新性[12-13]。Der Sarkissian S[14]等报道发现,在成年人肾小囊、肾小管及间质中,有少量细胞表达内皮祖细胞表面抗原CD133(CD133 +细胞)。CD133 +细胞可表达其他干细胞标志物,而且在一定条件下可形成肾小管样结构。所以,有部分学者将CD133 作为肾脏干细胞的标志物。另外大量文献报道指出CD133+肾脏细胞在肾脏损伤后的修复过程中具有重要作用[15]。
本组研究结果发现,CD133+肾脏细胞在AKI修复过程中的作用较骨髓MSCs更为明显,分析其原因可能与干细胞所处环境有关。干细胞的正常存在、自我更新及其分化能力均与其所处的微环境有关[16]。Johnson A K[17]等研究认为,MSCs可改善急性肾损伤,可能是因为其可直接分化为肾小管上皮细胞。但Liu N[18]等研究发现,MSCs直接分化呈肾小管上皮细胞的百分率极低。这表明。肾脏损伤后的微环境并不利于分化、增殖成正常肾小管细胞,而是通过其他途径修复肾脏损伤。Sun B[19]等研究认为,骨髓MSCs主要是通过调控细胞因子水平,抑制炎症细胞浸润、受损细胞的坏死与凋亡,同时使残留的上皮细胞分化成具有分裂功能的细胞,再进行分化、增殖成成熟细胞,从而改善局部肾功能。而CD133+肾脏细胞在肾脏损伤后,可增殖、分化呈肾小管上皮细胞。其次,在肾脏损伤过程中常伴有局部微血管损伤,而CD133+细胞可形成毛细血管样结果,可为肾脏修复提供营养需求[20]。此外,CD133+细胞也可通过调控细胞因子,促进肾小管上皮细胞、内皮细胞的修复,进而修复肾损伤。本组研究通过比较各组TNF-α、IL-10、HGF、BMP-7水平发现,与I/R组比较,I/R+MSCs组、I/R+CD133+组TNF-α水平明显下降,IL-10、HGF、BMP-7水平明显上升(P<0.05),说明骨髓MSCs、CD133+肾脏细胞可调控小鼠组织中的炎症细胞因子水平,减少炎症细胞因子对肾脏的继续损伤。推测其原因可能是骨髓MSCs、CD133+肾脏细胞通过旁分泌机制,调控部分细胞因子的水平,抑制炎症细胞的浸润,抑制受损细胞的坏死与凋亡。同时,本组研究还发现,I/R+MSCs组、I/R+CD133+组术后BUN、Cr水平、ATN评分均显著高于正常对照组,其中I/R+MSCs组以术后8 d最为显著(P<0.01);而I/R+CD133+组以术后4 d最为显著(P<0.01),侧面表明CD133+肾脏细胞修复受损肾脏的效能比骨髓MSCs更佳。究其原因可能是由于CD133+可形成毛细血管样结构,为肾脏修复提供所需营养;另外CD133+可通过调控细胞因子促进肾小管上皮细胞、内皮细胞的修复,更有助于修复肾损伤。
综上所述,骨髓MSCs、CD133+肾脏细胞均可有效改善肾脏微环境,促进由I/R诱导的AKI恢复,但CD133+肾脏细胞对AKI的修复作用更为显著。

