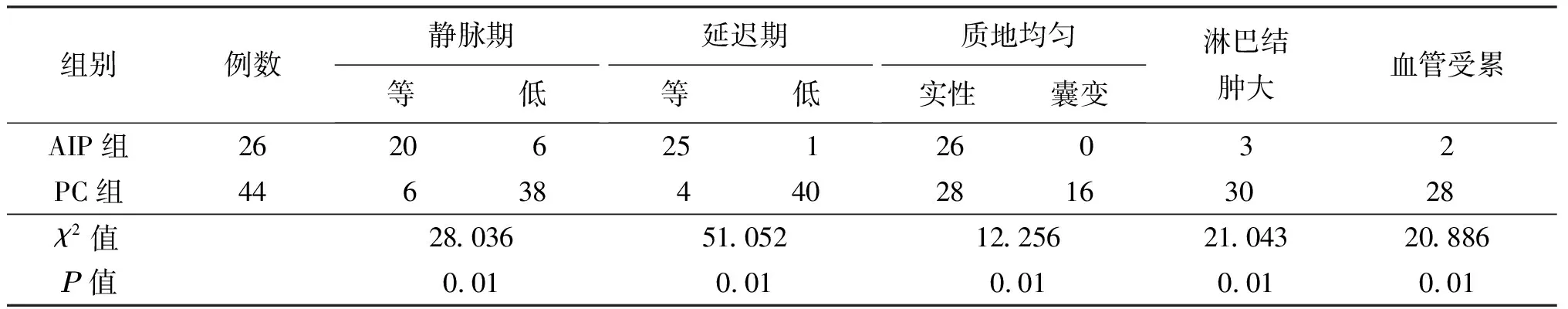
多模态MR鉴别自身免疫性胰腺炎及胰腺癌的价值分析
孔梅,朱付立,夏好成
(山东省东营市胜利油田中心医院磁共振室,山东 东营 257000)
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种临床少见的,与自身免疫有关的炎性病变,占慢性胰腺炎5%~6%[1]。多数情况下,依据典型的影像学表现和血清学异常能准确诊断该病,但部分病变以局限性胰头肿大为主,引起主胰管和胆管不规则狭窄、继发性扩张[2],临床上常被误诊为胰腺癌(pancreatic cancer,PC),但两者治疗方法和预后迥然不同。影像学检查在该病的诊断中具有至关重要的作用,其中MRI检查拥有良好的软组织分辨力,动态增强能准确显示AIP微观血流动力学变化,MRCP成像可直观显示胰管和胆管受累情况,在DWI中定量测量表观扩散系数(apparent diffusion coefficient,ADC)可客观评价病变组织的病理和生物学特性。本研究旨在探讨多模态MR技术对AIP和PC的鉴别诊断价值。
1 资料与方法
1.1 一般资料
AIP组:近8年收治的符合2011年国际胰腺病诊断标准[3]的26例AIP患者,其中2例误诊为胰腺癌行手术切除,8例经手术或ERCP、超声内镜活检证实,16例经影像学表现和/或血清学检查加激素治疗后随访证实。年龄43~77岁,中位年龄62.3岁;男16例,女10例;临床表现为无痛性黄疸20例、间歇性腹痛17例、腹胀14例、糖尿病7例,2例以泪腺炎首诊。实验室检查IgG升高18例,IgG 4升高2倍以上12例,CA19-9升高7例。治疗前均行MRCP、DWI、动态强化检查。
PC组:44例经手术病理检查证实为PC的患者,年龄47~79岁,中位年龄65岁;男27例,女17例;临床表现为腹痛、黄疸、腹部包块、消瘦等。术前行MRCP、DWI、动态强化检查。
对照组:44例因其他原因行上腹部MRCP及DWI检查者,无胰腺疾病病史,年龄36~63岁。
1.2 影像学检查
AIP组和PC组均行呼吸触发薄层MRCP平扫联合动态增强扫描,采用3.0 T(SimensTIM,skyra)超导场强 MR成像仪及八通道相控阵线圈进行扫描。具体序列为:(1)平扫呼吸导航快速自旋回波 T2WI 压脂FSE序列:横轴位:TR/TE 3 000/85 ms,层厚5 mm,ETL:29,FA 118°,视野380 mm,矩阵 320 × 320。(2)薄层 MRCP:TR/TE 2 500/701 ms,层厚1.0 mm,ETL 256,FA 150°,视野380 mm,SLAB:64 mm,矩阵384 × 320。(3)T1 vibe fs序列:TR/TE:3.97/1.29 ms,FA 70°,层厚3.0 mm,视野380 mm,矩阵320 × 256。分别于注射对比剂后15、60、180和300 s行动脉期、静脉期、平衡期和延迟期四期扫描。(4)DWI使用EPI序列:TR/TE 2 000/68 ms,层厚5 mm,视野400 mm,矩阵 128 × 128。b值包括50和800 s/mm2。
1.3 图像分析及标准方法
由两名高年资放射科医师采用盲法独立测量及分析MR资料,记录AIP组和PC组病变的形态、部位、分布范围及周围情况,观察病变处胰管形态以及病变以外的胰胆管形态。对以下征象评价:①胰腺外观改变:胰腺肿大类型(弥漫型、局灶型)、受累部位(胰头、体、尾)、腊肠样肿胀[4]、假包膜[5]、远端胰腺萎缩。②胰管改变:病变处胰管截断、胰管狭窄部位、数目、上游胰管扩张(管腔>3.0 mm)。③胰周改变:血管受累(病变包绕血管周径超过180°、血管变形或闭塞)、淋巴结增大(淋巴结短径>1.0 cm)。④胰腺病变平扫及各期强化信号特点:平扫及增强各期信号强度(实性成分相对于正常胰腺实质低、等、高)、质地均匀(有无囊变)。⑤观察各组DWI表现,计算表观扩散系数(apparent diffusion coefficient,ADC)值并进行对照,ROI尽可能大,PC组避开坏死囊变区,重复测量3次取平均值。
1.4 统计学方法
应用SPSS 22.0统计学软件进行分析,采用 Kappa 统计量检验两位医师对胰腺病变评价结果的一致性。Kappa值参考评价标准:0.75 AIP组中17例弥漫性肿大,累及整个胰腺(图1A);9例局限性肿大(图2B),7例累及胰头部,1例累及胰尾,1例胰头及体尾受累;大小(2.3±0.4)cm;受累胰腺轴面T2WI上呈等信号6例、略高信号17例、低信号3例,均未见坏死、囊变、出血,动脉期表现为点片状强化较正常胰腺信号略低(图2F),静脉期、延迟期多呈等强化(图2G)。PC组44例均表现为结节样肿块(图3),病变位于胰头颈28例、体尾部16例;大小(3.8±1.5)cm;T2WI病灶均呈较高信号,16例伴坏死、囊变,动脉期均为低强化,静脉期和延迟期多呈不均匀低强化。 注:A:胰腺弥漫性肿大,胰周假包膜呈稍低信号,双肾多发楔形低信号;B:胰管多发狭窄 注:A:胰头肿大,呈均质稍长T2信号(箭);B:DWI稍高信号;C:ADC图呈低信号;D:MRCP胆总管下端均匀变细,胰头部胰管单发狭窄,远端胰管扩张达5.3 mm,呈冰锥征;E:激素治疗后胰管恢复;F:病灶动脉期点片状强化;G:病灶延迟期均匀强化 注:A:胰头病灶呈不均匀稍长T2信号(箭);B:DWI病变呈稍高信号;C:ADC图呈稍低信号,高于AIP病灶;D:MRCP胰头部胰管狭窄闭塞,上游胰管明显扩张,胆总管下段截断性狭窄 两组影像学征象及发生率见表1。两组病灶均匀度、静脉期、延迟期强化程度比较,差异均有统计学意义(P<0.05),见表2。 表1 两组MR征象比较结果(例,%) 表2 两组病灶MRI增强扫描表现比较结果(个) AIP组主胰管18例(图2D)呈单节段性狭窄,其中6例管腔完全闭塞、4例(图1B)多节段跳跃性狭窄;24例可见不同程度贯通;病变远端胰管10例未见扩张,5例轻度扩张均<3.5 mm,2例扩张显著达4.3、5.1 mm,1例远端胰腺似萎缩。 PC组病变段胰管截断36例(图3D),2例胰管不规则狭窄,38例继发上游胰管扩张,扩张程度3~10 mm,平均5.9 mm,34例伴有胰腺萎缩,2例病变未累及胰管(表1)。两组病变段胰管是否穿通、远端胰腺萎缩等比较,差异有统计学意义(P<0.01)。 26例AIP组病灶DWI上均表现为高信号(图2B),ADC图呈低信号(图2C),病灶ADC值[(0.932±0.094)×10-3mm2/s)];PC组均表现为结节状稍高信号(图3b),ADC图呈稍低信号(图3C),病灶ADC值[(1.052±0.006)×10-3mm2/s)],高于AIP组病灶。对照组正常胰腺ADC值为[(1.244±0.037)×10-3mm2/s)],AIP病灶和PC病灶ADC值均低于正常胰腺组织(P<0.01),其中AIP病灶ADC值低于PC 病灶(P<0.01),ROC曲线下AUC为0.801,将1.021×10-3)mm2/s作为ADC临界值,诊断的敏感性为98.8%,特异性为87.4%(图4)。 图4 ROC曲线敏感性和特异性 AIP组3例出现胰周淋巴结肿大,2例脾动脉被包绕。PC组30例出现胰周、腹膜后淋巴结肿大,28例血管受累包括门静脉11例、脾静脉10例,脾动脉5例、肠系膜动脉2例。两组病灶淋巴结肿大、血管受累比较,差异均有统计学意义(P<0.05),见表2。AIP组双肾受累4例,肾内病灶呈长T1等、短T2楔形灶(图1A),1例以泪腺炎为首发症状,后被确诊为IgG4相关性胰腺炎。 AIP是一种由自身免疫机制异常导致的特殊类型的慢性胰腺炎,病理特点为胰管周围淋巴细胞、浆细胞浸润为主伴席纹样纤维化[6]。AIP诊断标准多次更新完善[3,7]也预示着对AIP认知的不断深入。AIP可发生于各个年龄段,以50岁以上中老年男性患者居多,临床表现多为无痛性梗阻性黄疸、轻度腹痛或不适,症状多不典型且缺乏特异性。有时血清IgG4水平正常,CA19-9水平升高,Kamisawa等[8]统计亚洲AIP发现,中国AIP常以局限性肿大为主,类似胰腺占位,极易被误诊为胰腺癌,因此影像学评价在两者鉴别诊断中一直扮演十分关键的角色。 AIP病变处大量淋巴、浆细胞浸润及纤维组织增生导致胰腺肿大、外观平直,失去正常的“羽毛状”结构呈腊肠样肿胀。胰周脂肪间隙有时可见假包膜征,MR上表现为部分或全部包绕胰腺的晕环状异常信号影,T2WI呈低信号,增强后轻中度强化,其病理成分为炎性渗液、蜂窝织炎、纤维组织,在假包膜显示上MRI检查优于CT检查。两者都是诊断AIP的1级证据,既往研究[9]发现其诊断特异性高达80%。 AIP胰腺实质信号均匀,在平扫时与正常胰腺信号接近,无一例出现出血坏死、囊变,动脉期轻度雪花样不均匀强化,略低于周围正常胰腺,静脉期、延迟期出现均匀性延迟强化,信号接近同层面正常胰腺实质,且比PC强化程度稍强,是由于AIP增生的纤维组织压迫胰腺内微血管并闭塞性静脉炎,导致动脉期对比剂先到达正常腺泡和导管,使其略早强化,后期周围纤维间质逐渐强化后,与腺泡和导管信号差异逐渐缩小,表现为缓慢渐进性强化。而PC作为乏血供恶性肿瘤,动脉期呈低强化,瘤体快速生长而血供缺乏,囊变、坏死几率明显增多。 腊肠样肿胀、假包膜、动脉期点片状强化、渐进性均匀延迟强化等征像都有利于AIP与胰腺的其它占位病变进行鉴别诊断,而出现远端胰腺萎缩、不均质低强化则应考虑胰腺癌的可能。 AIP主胰管常呈不规则狭窄、中断,范围与胰腺病变一致,狭窄常常大于主胰管总长1/3,不伴远端胰管扩张或轻度扩张(直径<4 mm)且没有远端胰腺萎缩,原因可能是病理上胰管周围淋巴、浆细胞浸润伴纤维化导致狭窄段管壁增厚、管腔光滑受压,上游胰管扩张较轻。而PC起源于导管上皮,肿瘤破坏胰管狭窄、中断范围较局限,多呈截断样闭塞,梗阻上游胰管显著扩张,多超过4 mm。国内外大量研究显示将胰管管径4 mm作为阈值,鉴别局限性AIP与PC的敏感性为94%,特异性为79%[10-12]。相对于ERCP,由于MRCP空间分辨率较低的原因,其显示的AIP胰管闭塞其实并非完全闭塞,而是穿过肿块,通过激素治疗原先不可见的胰管可以重新显现,又称“胰管穿通征”,是导管良性狭窄的一种特征,有报道其诊断AIP的特异性高达96%[13]。MRCP除可清晰显示胰管狭窄部位、程度、范围,还可显示狭窄数目,多发狭窄也可作为二者鉴别点之一,不仅是弥漫性AIP,局限性AIP都可表现为胰管多发跳跃式狭窄。 AIP与PC与正常胰腺组织的ADC值之间存在差异性,两者在DWI和ADC图像上表现也有所不同,不同文献ADC值存在一定的差异,可能与疾病进程、设备类型和场强、b值大小、DWI序列类型等因素有关。与以往研究一致[14-15],本研究中AIP组ADC值低于PC组,原因是胰腺组织被大量淋巴细胞、浆细胞浸润,病灶中富细胞成分增多,且淋巴细胞核大、染色质多,密度明显大于一般肿瘤细胞,加上纤维组织高度增生,使水分子扩散更加明显受限。尽管胰腺癌病理上表现为癌细胞浸润,刺激周围纤维间质增生,但组织密度还是低于AIP,导致AIP的ADC值相对更低。ADC值还可以半定量地反映疾病的活性,有研究证明当病灶DWI呈高信号时临床症状常较显著,提示有明确激素应用指征并可评估AIP患者疗效[13]。 AIP作为全身系统性自身免疫疾病可单独发生,还有许多胰腺外器官受累表现[16], 胆道最常受累,其次还有肾脏、腹膜后纤维化、涎腺炎,严重者可致胰周血管受累,但经激素治疗后可恢复。PC作为一种恶性肿瘤,对胰周血管神经、胰外邻近脏器十二指肠多为严重侵犯、破坏,血行转移至肝脏。 综上所述,腊肠样肿胀、假包膜、主胰管狭窄不伴上游胰管扩张(<4 mm),无胰腺萎缩,静脉期及延迟期均质等强化,ADC值显著降低等征象有助于鉴别AIP和胰腺癌。利用多模态MR技术正确认识AIP征象能进一步提高诊断水准,为临床采取正确的治疗方案提供更多依据,最大程度避免过度治疗或延误。需要注意的是,本研究还存在以下不足之处:①本研究是回顾性研究,病例选择和统计学存在偏倚,可能不能全面反映两组疾病影像学征象及概率;②本研究使用了两台MR机器,图像有所差别,但MR序列相似;③因AIP属于少见病,临床上难以有较大样本的研究,仍需积累更多样本量及多中心合作进行更深入的研究。2 结 果
2.1 胰腺病灶平扫及强化特点
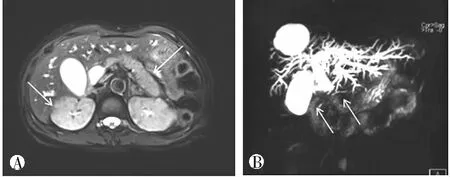
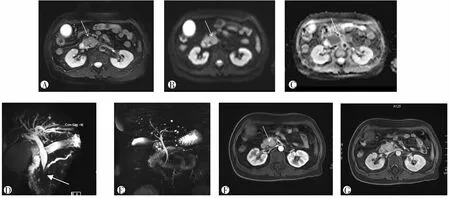
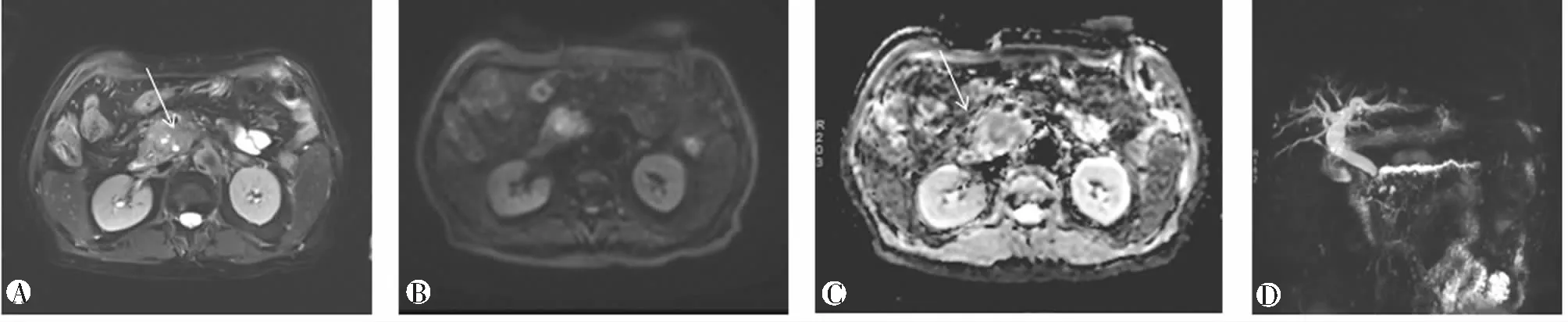
2.2 胰管表现
2.3 DWI表现
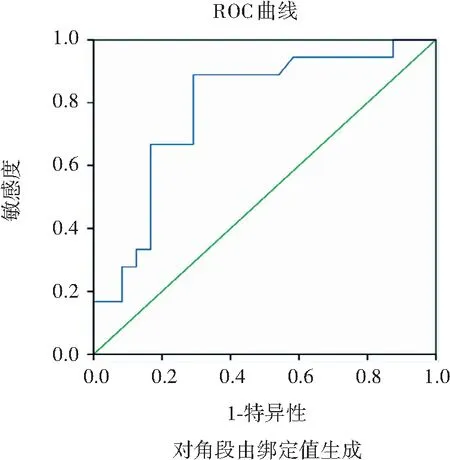
2.4 合并胰周、胰外器官病变
3 讨 论
3.1 临床病理特征
3.2 胰腺实质病变及动态强化特点
3.3 胰管改变
3.4 DWI表现
3.5 合并胰外其它脏器改变

