手性农药甲霜灵在土壤微生物中降解的研究*
石健 张奇 杨睿璐 李春建 范素素 张政
(1.南通大学分析测试中心,江苏 南通 226019;2.南通大学交通与土木工程学院 江苏 南通 226019;3.南通大学化学化工学院,江苏 南通 226019)
0 引言
在已商品化的化学农药中,手性农药占很大比率,且有应用越来越普遍的趋势。手性农药对映体具有相同的物理化学性质,但生物毒性、生物蓄积、生物降解等生物学效应不同[1]。然而,手性农药总是作为外消旋化合物销售和使用,这使得手性污染物往往被忽视。因此,我们有必要研究手性农药在土壤中的对映选择性作用。但是,由于手性对映体往往具有相同的物理化学性质,对它们的分离分析工作就变得十分困难。到目前为止,已经用高效液相色谱(HPLC)[2],气相色谱-质谱(GC-MS)[3]、液相色谱-质谱(LC-MS)[4]和核磁共振(NMR)[5]等方法对手性物质进行拆分。高效液相色谱法具有“三高一广”的特点:高压、高效、高灵敏度,应用范围广。CHEN S等[4]采用正相高效液相色谱法测定丙环唑对映体在水、土壤、葡萄中的立体选择性,该方法成功应用于实际样品的选择性分析。QIN F等[6]建立一种反相高效液相色谱法来分离丁烯氟虫腈对映体,采用纤维素类手型固定相分离和测定,讨论了不同流动相组成对分离的影响。LIU T等[1]利用高效液相色谱法实现了农利灵对映体的分离,并将该法运用于农利灵对映体在土壤中的降解研究,其研究发现,农利灵对映体降解符合一级动力学。
甲霜灵[N-(2,6-二甲基苯基)-N-(甲氧基乙酰基)-D,L-丙氨酸甲酯](图1)是用来控制各种农作物、蔬菜和水果中真菌病害的最常用的杀真菌剂之一,通过抑制体内菌丝体蛋白质的合成,使其生长异常而死亡。甲霜灵具有一对对映异构体,(+)-S-甲霜灵和(-)-R-甲霜灵,甲霜灵对映体在土壤、植物、动物等多种介质中的对映选择性降解[7]。

图1 甲霜灵结构式示意
因此,本工作拟建立一种简单高效的正相高效液相色谱法对甲霜灵两种对映异构体进行分离分析,同时研究甲霜灵对映体在土壤中的立体选择性降解,为甲霜灵对映体的科学使用提供依据。
1 实验方法
1.1 样品采集与前处理
1.2 高效液相色谱方法验证
为验证方法有效性、测定线性、基质效应、回收率、精密度、检出限(LOD)和定量限(LOQ)等参数,在正己烷中溶解甲霜灵标准品,得到对映体质量浓度为5、15、25、35、45 mg/L一系列标准溶液,以峰面积为坐标,标准样品浓度为横坐标,进行线性回归分析。
通过回收率研究来检查方法的准确性和精确性。在空白样品中加入不同浓度的标准溶液来测定回收率,确定3个水平和5个重复以计算相对标准偏差(RSD)。
LOD和LQD分别为3倍和10倍信噪比(S/N)。
手性分离评价参数采用分离度:

式中,t为对映体的保留时间,w1/2为半峰宽。Rs大于1.5时,认为达到基线分离。
通常分析土壤中有机物降解过程采用一级降解动力学模型,其方程与半衰期(t1/2)的计算如下[8]:

式中,Ct和C0分别为药物在时间t和初始时的浓度,k为降解速率常数。
药物的立体选择性一般采用对映体分数EF来表示[9]:

式中,[S]和[R]分别为手性农药对映体的峰面积。EF值的范围为[0,1],当不存在立体选择性时,EF值为0.5。
2 结果与讨论
2.1 甲霜灵分析方法的建立
2.1.1 手性柱的选择
手性固定相在与外消旋体相互作用时,各对映体与固定相生成稳定性不同的短暂的对映体复合物,造成在柱淋洗时保留时间不同,从而达到拆分的目的[10]。目前较为常见的手性固定相有纤维素衍生物涂敷型(Chiralcel OD柱)、直链淀粉衍生物涂敷型(Chiralpak AD柱)、直链淀粉衍生物键合型(Chiralpak IA柱)等,张美等[11]用这几种手性固定相对38种手性物质进行拆分,OD固定相的手性识别率最高,达到60%。纤维素衍生物类手性固定相具有优良的手性拆分能力,对各类化合物都表示出极高的手性识别能力,因此本研究中选用的手性柱Chiralcel ODH。
2.1.2 流动相的选择
正相流动相一般选用正己烷、无水乙醇、异丙醇进行配比,实现对化合物在正相柱上的拆分。本实验中选用正己烷与无水乙醇混合流动相,改变体积比,观察甲霜灵两对映体分离度,见表1。
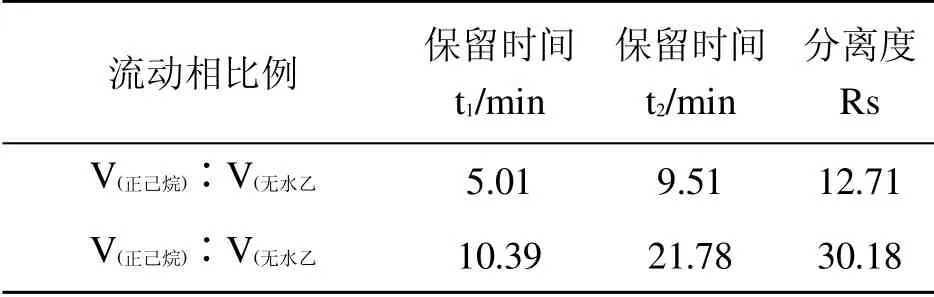
表1 不同流动相比例甲霜灵标准品溶解液的液相参数
2种流动相体积比下,甲霜灵对映体分离度均大于1.5,而在后续的土壤实验中发现,土壤样品在5 min左右会出现杂质峰,因此采用V(正己烷)∶V(无水乙醇)=75∶25有利于实验的后续进行。
波长、柱温、进样量、甲霜灵在紫外光区220 nm处有最大吸收,因此选择220 nm为检测波长[12]。并确定柱温为35℃,进样量为5L。
2.1.3 对映体流出顺序的确定
在上述优化条件的基础上,采用高效液相法(HPLC)分别检测甲霜灵和精甲霜灵标准品,确定甲霜灵对映体的流出顺序(如图2),(+)-S-甲霜灵先流出,(-)-R-甲霜灵后流出。保留时间分别为10.39 min和21.78 min。

图2 标准品液相图谱(A:甲霜灵;B:精甲霜灵)
2.1.4 方法线性、回收率和检测限、定量限
图3中,标准曲线范围为1~50 mg/L,(+)-S-甲霜灵的线性方程为y=10.738x+31.938,相关系数R2为0.994 4,(-)-R-甲霜灵的线性方程为y=11.05x-8.920 8,相关系数R2为0.999 1。表2中,甲霜灵在不同环境介质中的回收率为71%~107%,相对标准偏差RSD均小于6.6%。两种对映体的LOD和LOQ分别为0.011 mg/kg和0.015 mg/kg。

表2 不同添加量甲霜灵在不同介质中的回收率

图3 甲霜灵对映体标准曲线
2.2 甲霜灵对映体在土壤微生物中的立体选择性降解
由图4可知,在灭菌和未灭菌的土壤中加入甲霜灵甲醇溶液,经过42 d的培养,甲霜灵在灭菌土壤中降解较少,降解率仅有45%。前30天甲霜灵几乎不降解,而到第42天其含量有明显降低,可能是空气和环境中的微生物进入土壤而引起的降解。而在未灭菌土壤中,32 d时R-甲霜灵的含量已低于检测限,42 d的降解率达到89%。由此可见,微生物作用是引起甲霜灵降解的首要因素。
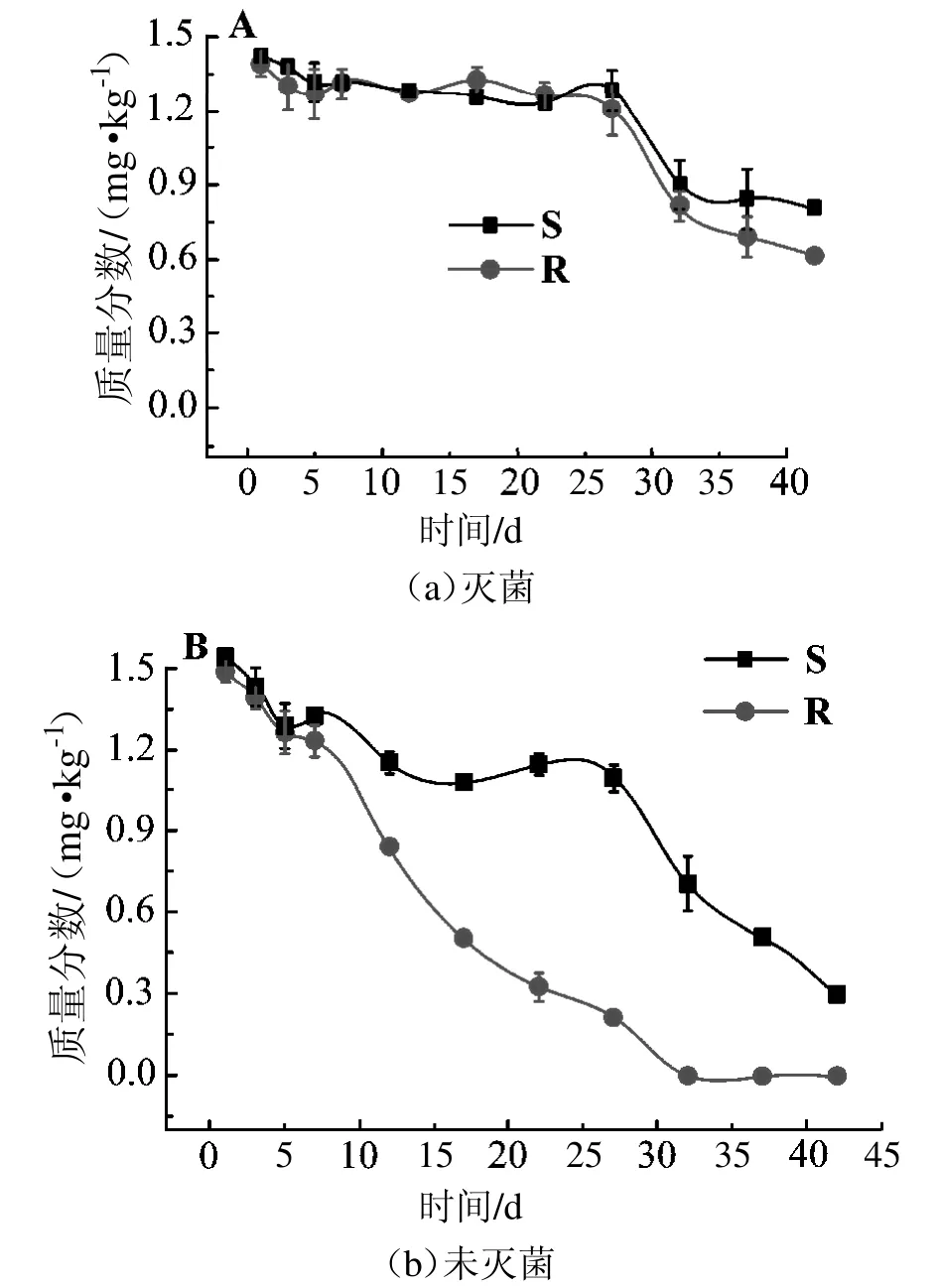
图4 甲霜灵对映体在土壤中降解曲线
通过拟合一级降解动力学方程,我们可以得到降解速率,并计算得到半衰期(t1/2=ln2/k),如表3所示:

表3 甲霜灵对映体在土壤中降解拟合方程参数
甲霜灵对映体在灭菌土壤中的半衰期相差不大,在75 d左右;而未灭菌土壤中,S-甲霜灵的降解半衰期为49.85 d,R-甲霜灵的半衰期为32.84 d,相差17 d。同时发现未灭菌土壤中甲霜灵降解速率更快,半衰期更短。进一步证明,微生物作用可以大大加快甲霜灵的降解。
如图5和表3所示,在未灭菌的土壤中,甲霜灵的两种对映体之间存在显著差异,EF从0.50增加到0.78,降解半衰期与降解速率相差较大,R-甲霜灵优先降解。已有研究表明,土壤中甲霜灵降解的立体选择性与土壤的氧含量和pH有关。在好氧土壤中,当pH值>5时,R-甲霜灵的降解速率要快于S-对映体;当pH值处于4~5时,两对映体降解速率几乎相同;而当pH值<4时,S-甲霜灵降解得更快.在厌氧土壤中,也是S-甲霜灵降解得更快[3]。在我们的研究中,土壤是pH值为7.45的表层土,属于好氧弱碱性土,而R-甲霜灵降解快于S体,这结果与以前的研究一致。

图5 甲霜灵在土壤中降解过程EF值
而在灭菌土壤中,两种对映异构体的降解曲线之间几乎没有差异,EF值接近于0.5,可见灭菌土壤中甲霜灵降解不具有立体选择性。与灭菌的土壤相比,未灭菌土壤含有更多的微生物,这可能是导致其产生立体选择性的主要原因。施药后约80%~90%的农药会进入土壤,而土壤中微生物的选择性降解是产生立体选择性的主要原因[13-15]。DIAO J等[24]发现无论是好氧还是厌氧土壤中,S-(+)-乳氟禾草灵比R体都降解得快,而在灭菌土壤中两对映体降解速率几乎相同,证实了微生物降解是引起立体选择性的主要原因[15]。
3 结论
1)本研究中,建立并优化了甲霜灵的分离分析方法。采用正相色谱法,利用手性柱Chiralcel ODH,在波长220 nm,进样量5L,柱温35℃,流动相V(正己烷)∶V(无水乙醇)=75∶25条件下检测甲霜灵对映体。该方法下,甲霜灵对映体完全分离,且方法准确度、精密度良好。
2)确定甲霜灵对映体线性方程为:(+)-S-甲霜灵的线性方程为y=10.738x+31.938,相关系数R2为0.9944,(-)-R-甲霜灵的线性方程为y=11.05x-8.9208,相关系数R2=为0.999 1。
3)在灭菌土壤中,甲霜灵42天降解率约为45%,且甲霜灵对映体降解过程中不具有立体选择性。在未灭菌土壤中,甲霜灵42天降解率达到89%,且甲霜灵对映体降解具有明显的立体选择性,R-甲霜灵比S-甲霜灵降解的更快。
4)通过比较甲霜灵在灭菌和未灭菌土壤中甲霜灵的降解行为,得到微生物作用是引起甲霜灵降解的主要因素,同时是导致甲霜灵降解立体选择性的最重要原因。

