对比人工与人工智能图像后处理冠状动脉CT血管造影显示冠状动脉解剖及其病变
赵福琳,陈澜菁,刘俊七,兰永树
(西南医科大学附属医院放射科,四川 泸州 646000)
冠状动脉CT血管造影(coronary CT angiography, CCTA)现已广泛用于临床[1]。近年人工智能(artificial intelligence, AI)技术不断发展,并已用于CCTA[2]。AI辅助诊断软件基于卷积神经网络进行后处理分析时,会自动应用较少的预处理程序,并删除部分CCTA重建步骤[3-4],有利于减轻影像科医师劳动强度、提高工作效率[5-6]。本研究对比观察人工与AI后处理CCTA图像显示冠状动脉解剖及病变的效能。
1 资料与方法
1.1 一般资料 回顾性收集2021年3月—10月158例于西南医科大学附属医院因临床疑诊冠心病接受CCTA患者,男94例、女64例,年龄22~88岁、平均(55.3±13.5)岁。排除冠状动脉搭桥术后、冠状动脉开口及引流异常、图像质量差等无法以AI软件行后处理者。
1.2 仪器与方法 采用Philips 256层iCT机。嘱患者平卧,采用回顾性心电门控法进行扫描,范围自气管隆嵴下1 cm至心脏膈面水平,管电压120 kV,自动管电流,探测器宽度128×0.625 mm,转速0.27 s/rot,FOV 165 mm×165 mm,层厚0.67 mm,层间距0.45 mm。之后经肘正中静脉以流率5 ml/s注射对比剂碘佛醇(350 mgI/ml)1.2 ml/kg体质量,以阈值追踪法行增强扫描,于主动脉根部设置检测点,触发阈值为250 HU。
1.3 图像后处理及分析 将CCTA原始图像导入Philips IntelliSpace Portal工作站行人工处理(人工组);采用深睿及数坤AI辅助诊断软件(AI软件)后处理,分别记为A1组及A2组。人工组由1名影像科主任医师选择最佳舒张期或最佳收缩期图像,A1及A2组采用卷积神经网络技术行后处理,包括容积再现(volume rendering, VR)、最大密度投影(maximum intensity projection, MIP)、多平面重组(multiplanar reconstruction, MPR)及曲面重组(curved planar reconstruction, CPR)[1]。人工组由2名主治医师以双盲法阅片,意见有分歧时经协商决定;A1及A2组由软件自动生成数据。将冠状动脉分为右冠状动脉(right coronary artery, RCA,近、中、远段)、右后降支、右后侧支、右圆锥支、锐缘支、窦房结支、房室结支、左室后支、左主干、左前降支(left anterior descending artery, LAD,近、中、远段)、第一对角支、第二对角支、左室前支、左圆锥支、左回旋支(left circumflex artery, LCX,近、中远段)、第一钝缘支、第二钝缘支、中间支、左后降支及左后侧支[7]。人工组记录VR图像中显示清楚的冠状动脉分支数目,于CPR图像上测量LCX(近、中远段)、RCA及LAD(近、中、远段)拉直后长度,观察LCX、RCA及LAD各节段有无狭窄及其程度、有无斑块及其性质,存在多处狭窄或斑块时,针对最严重处进行分析;测量狭窄处血管直径(D1)及其近心端正常血管直径(D0),计算血管狭窄率:血管狭窄率=(D0-D1)/D0×100%;根据狭窄率评估血管狭窄程度[2],分为轻度(狭窄率<50%)、中度(狭窄率50%~75%)及重度(狭窄率≥76%);测量斑块CT值,据以分为非钙化斑块(CT值≤130 HU)、钙化斑块(CT值>130 HU)及混合斑块(以上2种成分同时存在)[8-9]。
1.4 统计学分析 采用SPSS 28.0统计分析软件。以Kolmogorov-Smirnov法评估计量资料的正态性,以±s描述符合正态或近似正态分布者,组间采用单因素方差分析进行比较,以LSD-t法行两两比较。采用χ2检验比较计数资料。以Kappa检验观察3组评估冠状动脉狭窄程度及斑块性质结果及人工组内2名医师观察结果的一致性:Kappa<0.40为一致性较差,0.40~0.75为一致性一般,>0.75为一致性良好[10]。P<0.05为差异有统计学意义。
2 结果
2.1 冠状动脉分支数目 A1组(11.40±1.81)、A2组(12.08±8.25)及人工组(10.62±1.86)显示冠状动脉侧支数目总体差异有统计学意义(F=6.75,P<0.01)。A1组及A2组均可见部分细小分支,所示数目均多于人工组(P=0.04、<0.01),A1组与A2组间差异无统计学意义(P=0.10)。见图1。
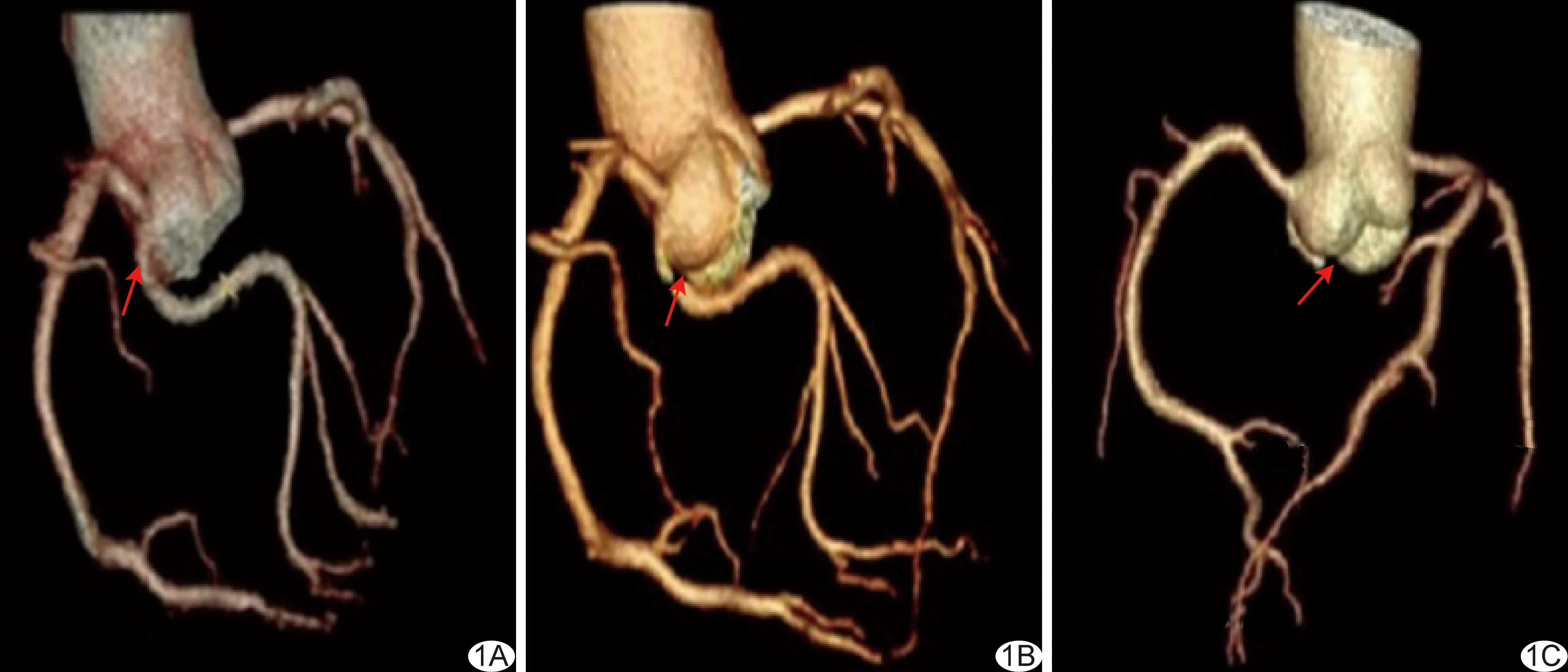
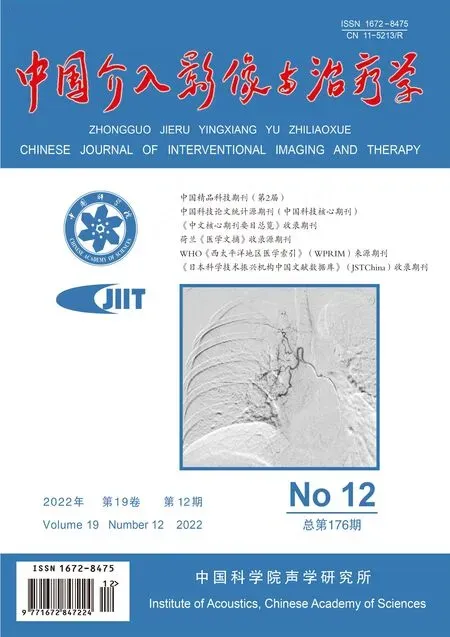
图1 患者男,48岁,冠心病 A.人工组VR图完整显示冠状动脉各分支,可准确识别LCX异常开口(箭); B.A1组VR图完整显示冠状动脉各分支,可识别LCX异常开口及近段血管缺如(箭); C.A2组VR图显示冠状动脉分支较多,认为LCX缺失而未能识别LCX异常开口(箭)
2.2 血管长度 3组所测LAD和RCA长度总体差异均有统计学意义(P均<0.01);A1组(P=0.04、0.03)及A2组(P均<0.01)LAD和RCA长度均大于人工组,其余组间差异均无统计学意义(P均>0.05)。3组LCX长度差异无统计学意义(P=0.18)。见表1。
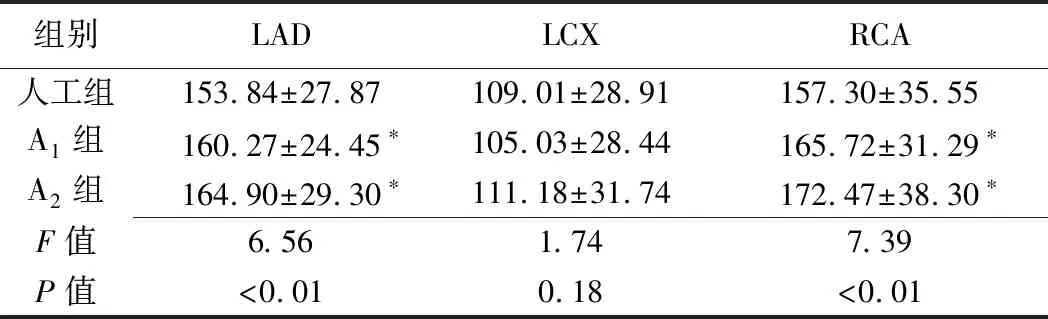
表1 经人工及AI软件后处理后CCTA显示LAD、LCX及RCA长度比较(mm,n=158)
2.3 血管狭窄程度 人工组内评估LAD、LCX及RCA狭窄程度的观察者间一致性良好(Kappa=0.87、0.87、0.89),故选其中1名医师的诊断结果进行分析。3组评估LAD、LCX及RCA狭窄程度差异均无统计学意义(P均>0.05,表2)。A1组、A2组评估LAD、LCX、RCA狭窄程度(Kappa=0.58、0.51、0.57),以及A1组(Kappa=0.55、0.57、0.62)、A2组(Kappa=0.56、0.58、0.67)与人工组评估结果的一致性均为一般。
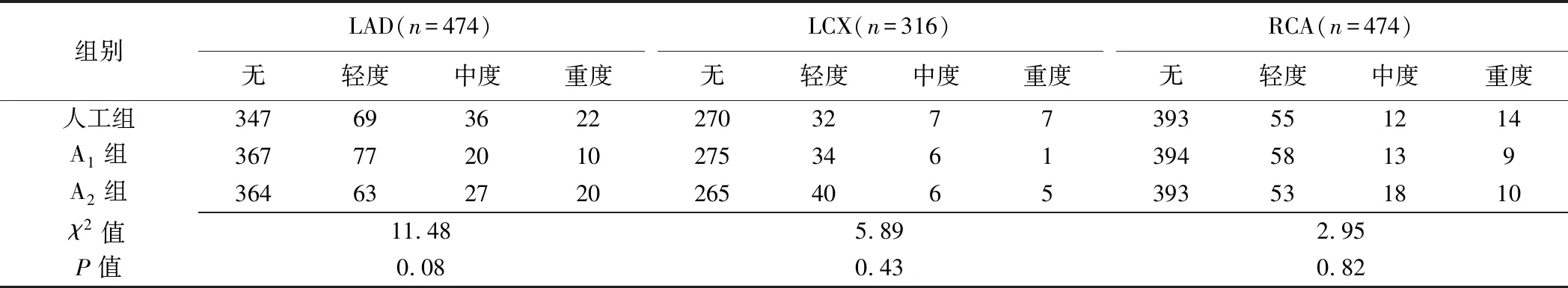
表2 人工与AI软件评估LAD、LCX及RCA狭窄程度比较(节段)
2.4 斑块性质 人工组内观察者间判断LAD、LCX及RCA斑块性质的一致性良好(Kappa=0.76、0.75、0.83)。3组评估LAD、LCX及RCA血管节段斑块性质差异均无统计学意义(P均>0.05,表3)。A1组与A2组判断LAD、LCX及RCA斑块性质的一致性差(Kappa=0.15、0.20、0.28);A1组(Kappa=0.56、0.55、0.58)、A2组(Kappa=0.64、0.54、0.65)与人工组判断LAD、LCX及RCA血管节段斑块性质的一致性均为一般。见图2。

表3 人工与AI软件判断LAD、LCX及RCA斑块性质比较(节段)
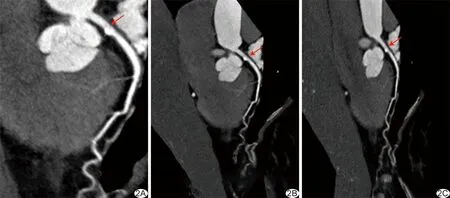
图2 患者女,65岁,冠心病,LAD狭窄 A.人工后处理CPR图示LAD近段管壁钙化斑块形成(箭),局部管腔轻度狭窄; B、C.A1(B)、A2组CPR图(C)示LAD近段管壁钙化斑块形成,局部轻度狭窄,显示斑块不完整(箭)
3 讨论
冠状动脉疾病是临床常见心血管疾病[10]。冠状动脉造影(coronary angiography, CAG)能准确评估冠状动脉狭窄程度,有助于临床治疗决策,但无法准确判断病变节段管腔重构及斑块性质[11-12]。近年来,CCTA已成为临床排除冠心病的首选无创性检查方法,对显示冠状动脉解剖、评估冠状动脉狭窄程度及斑块性质有较高价值[13]。随着深度学习算法的发展及临床影像学数据的积累,AI在冠心病影像学领域的应用日趋深入[2]。
本研究发现,经AI后处理后,CCTA图像显示冠状动脉主干及分支较人工后处理更为完整,且显示LAD和RCA长度更大,与既往研究[14]结果基本一致;但遇CCTA原始图像质量欠佳或冠状动脉本身结构异常时,AI仍有不足[14]。临床应灵活选择多时相、多种后处理方式,结合窗技术,尽可能降低CCTA检查失败风险。
本研究3组判断LAD、LCX、RCA狭窄程度及斑块性质结果差异均无统计学意义,分析原因,可能在于本研究将狭窄程度分为3个等级,而并非以狭窄率表示,即将计量资料改为计数资料,损失了部分信息,导致检验效能减低。A1组、A2组与人工组评估LAD、LCX、RCA血管狭窄程度及斑块性质的一致性均一般,A1组与A2组判断血管狭窄程度及斑块性质的一致性分别为一般及差,或因AI软件通常仅选择单个扫描时相,以固定旋转角度、方位及窗技术进行观察,可能遗漏部分病变而影响判定结果;另外,AI后处理具有美化血管功能,可致一定程度失真而影响检出病变[10],且易将管腔内的对比剂、伪影或血管分叉处误判为斑块。因此,目前临床实际工作中不宜仅依赖AI软件评估冠状动脉,而需与人工相结合。
综上所述,相比人工处理,经AI后处理后CCTA图像显示冠状动脉分支更为完整;人工与AI后处理评估冠状动脉狭窄程度及钙化的一致性均不高。本研究的主要不足:①单中心回顾性研究,且样本量有限;②仅涉及LAD、LCX及RCA支冠状动脉,有待进一步观察冠状动脉其他分支并加以深入研究。