CFH基因多态性与玻璃体液VEGF对年龄相关性黄斑变性患者抗VEGF疗效影响的交互作用△
赵 文 赵 斐 李 敏 叶慧芳
年龄相关性黄斑变性(AMD)是继青光眼、白内障后眼科常见的第三大类致盲性疾病,慢性进行性是AMD病情进展的重要特点,因此,及时有效治疗意义重大[1]。雷珠单抗能通过抗血管内皮生长因子(VEGF)机制,防治AMD造成的视力损害,但并非所有AMD患者均能视力获益,加之玻璃体内注射雷珠单抗为侵入性,且费用昂贵,存在眼内炎、外伤性白内障等并发症风险,故掌握AMD抗VEGF治疗无应答机制,明确其危险因素,对精准筛查抗VEGF治疗适宜人群至关重要[2]。补体因子H(CFH)基因定位于染色体1q32上,当前已证实CFH基因多态性与AMD易感性相关,是AMD的一个重要遗传学机制,但是否会影响抗VEGF应答性尚未完全明确[3]。黄斑区脉络膜新生血管是AMD主要病理特征之一,VEGF具有促血管新生作用,参与AMD发病与病情进展[4]。基于此,本研究尝试探讨CFH基因多态性与玻璃体液VEGF对AMD抗VEGF疗效影响的交互作用,期待为抗VEGF治疗应答结果异质性的阐明、合理使用抗VEGF药物等提供数据支持。
1 资料与方法
1.1 一般资料选取2020年5月~2022年1月广州医科大学附属第三医院眼科149例(149眼)AMD患者为研究对象。纳入标准:(1)符合AMD诊断标准[5],AMD分型为湿性;(2)既往无相关治疗史;(3)单侧发病;(4)自愿签署知情同意书。排除标准:(1)既往有眼部手术史者;(2)青光眼、葡萄膜炎;(3)视网膜脱离;(4)高度近视、遗传性疾病等其他原因造成的黄斑区脉络膜新生血管;(5)出现瘢痕化的AMD患者;(6)严重的心脑血管疾病者。全组患者均自愿签署知情同意书,本研究获本院伦理委员会批准同意。
1.2 方法
1.2.1 治疗方法与分组所有患者均给予雷珠单抗(Novartis Pharma Schweiz AG,批准文号S20181010)0.5 mg玻璃体内注射,治疗周期为3个月,之后根据病情需要进行注射。所有患者均完成3次注射。根据抗VEGF治疗是否有应答,分为应答组(111例111眼)、无应答组(38例38眼)。应答组:治疗后3个月,视力提高≥5个ETDRS字母数;无应答组:视力改善<5个ETDRS字母数。无应答组患者年龄、体重指数、性别比例、眼别、视网膜积液、椭圆体带完整性、眼压、最佳矫正视力与应答组比较,差异均无统计学意义(均为P>0.05)(表1)。
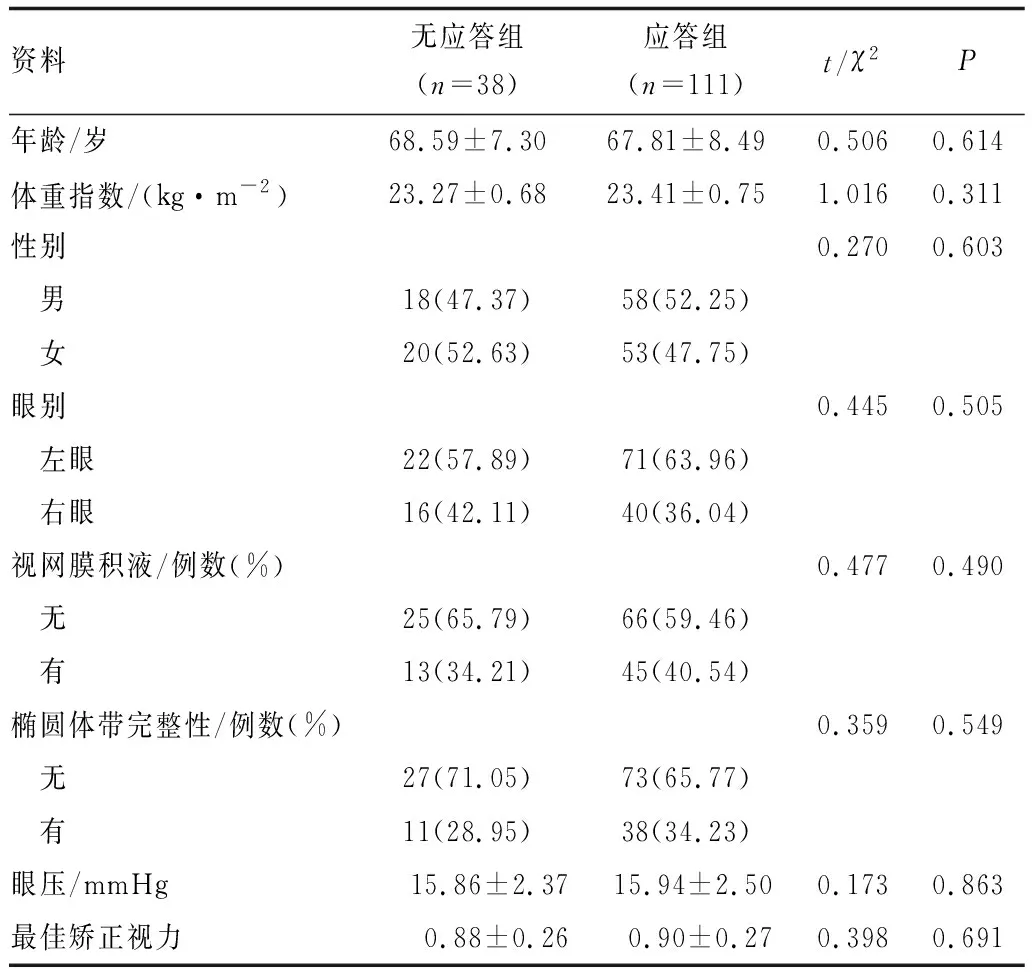
表1 两组患者一般资料比较
1.2.2 主要试剂与仪器PCR仪(75002型,美国ABI公司);分光光度计(AA-200型,美国PE公司);DNA提取试剂盒(山东博科生物);PCR反应试剂盒(美国Axygen公司);酶标仪(国产彩虹GF-M3000型);VEGF试剂盒(上海初态生物)。
1.2.3 检测CFH基因多态性检测方法:就诊时采集5 mL肝素抗凝空腹静脉血,DNA提取试剂盒提取DNA,分光光度计检测纯度,通过Sanger双脱氧终止测序法检测CFH位点rs800292、rs1061170、rs529825、rs1410996位点的基因型,以基因DNA为模板,进行PCR扩增,反应体系包括Taq DNA聚合酶、引物、4种dNTP、靶序列DNA和PCR反应缓冲液。反应条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃低温复性30 s,72 ℃退火延伸1 min,扩增40个循环。
1.2.4 检测玻璃体液VEGF三通道玻璃体切割法采集玻璃体液标本0.5 mL,将玻璃体切割头切割端断开,此断开口通过一个针头连接一无菌带盖密封的玻璃瓶,另一个针头通过无菌盖连接原玻璃体切割导管断开位置,接机器端,此时即可按常规方法切割玻璃体,可控地收集玻璃体液。采集后患者若有眼部出血,需根据出血量多少酌情处理,出血量较少时,保守治疗,避免剧烈运动,半卧位休息,出血量较多时,给予促进出血吸收的药物。所有患者术中与术后均无并发症发生。应用酶标仪和双抗体夹心酶联免疫吸附法检测玻璃体液VEGF水平,读取450 nm波长下的光密度值,绘制标准曲线,查出对应VEGF浓度。
1.3 观察指标(1)比较两组患者CFH位点rs800292、rs1061170、rs529825、rs1410996位点基因型分布;(2)比较两组患者玻璃体液VEGF水平;(3)比较玻璃体液VEGF不同水平患者CFH基因多态性;(4)分析抗VEGF疗效的影响因素;(5)分析CFH基因多态性与玻璃体液VEGF对抗VEGF疗效影响的交互作用。
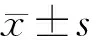
2 结果
2.1 两组患者CFH基因多态性比较无应答组患者CFH位点rs800292、rs529825、rs1410996各基因型分布与应答组比较,差异均无统计学意义(均为P>0.05);无应答组患者CFH位点rs1061170基因型分布与应答组比较,差异有统计学意义(P<0.05)(表2)。

表2 两组患者CFH基因多态性比较
2.2 两组患者玻璃体液VEGF比较全部患者玻璃体液VEGF为(632.37±189.03)×10-9g·L-1,根据VEGF水平分组,VEGF高水平患者42例,低水平患者107例。无应答组患者玻璃体液VEGF为(843.26±151.85)×10-9g·L-1,高于应答组(560.17±129.34)×10-9g·L-1,(t=11.128,P=0.000)。
2.3 玻璃体液VEGF不同水平患者CFH基因多态性比较玻璃体液VEGF高水平患者与低水平患者CFH位点rs800292、rs529825、rs1410996各基因型分布比较,差异均无统计学意义(均为P>0.05);玻璃体液VEGF高水平患者CFH位点rs1061170基因型分布与低水平患者比较,差异有统计学意义(P<0.05)(表3)。
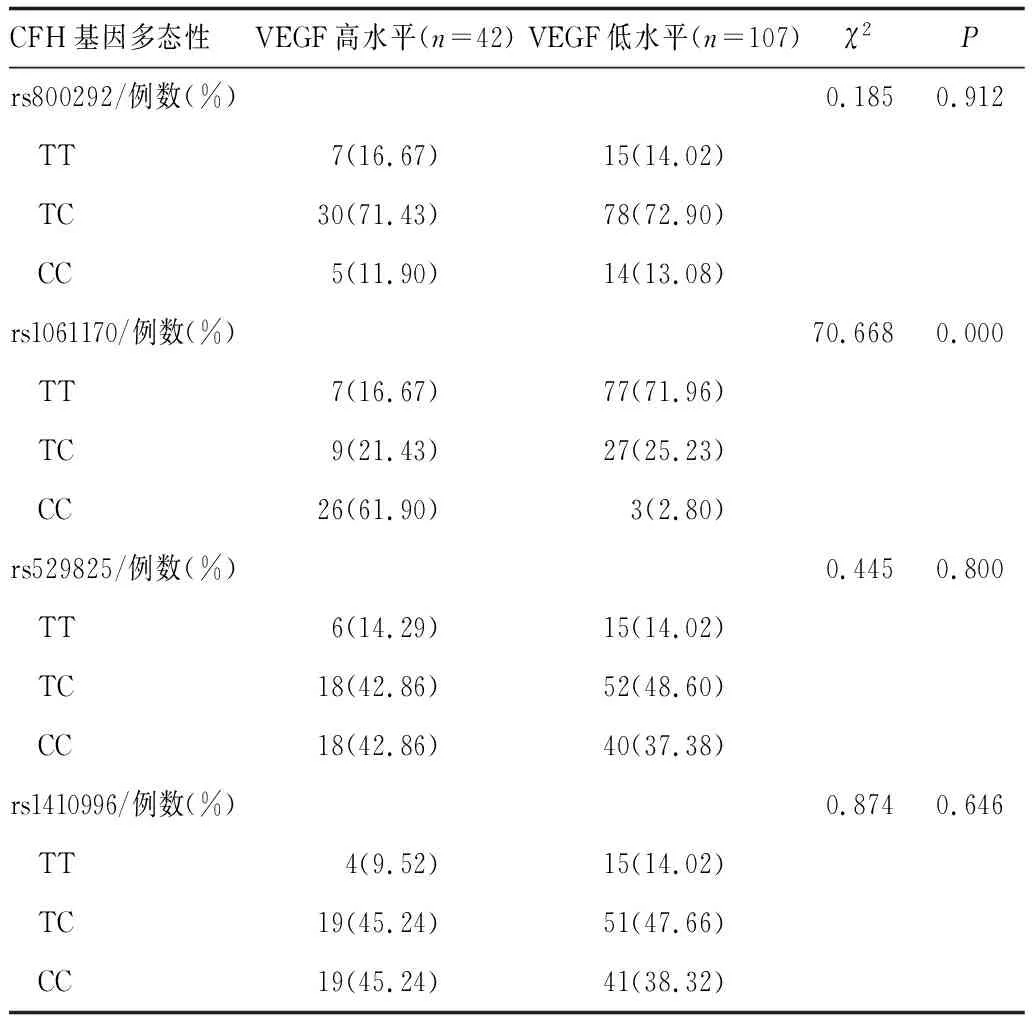
表3 玻璃体液VEGF不同水平患者CFH基因多态性比较
2.4 抗VEGF疗效的影响因素分析以抗VEGF治疗是否有应答为因变量(有=0,无=1)进行单因素和多因素Logistic回归分析,结果显示,在全部AMD患者中,玻璃体液VEGF、CFH位点rs1061170 CC基因型均是抗VEGF疗效的独立相关影响因素(均为P<0.05);CFH位点rs1061170 TC基因型与抗VEGF疗效无关(P>0.05)(表4)。
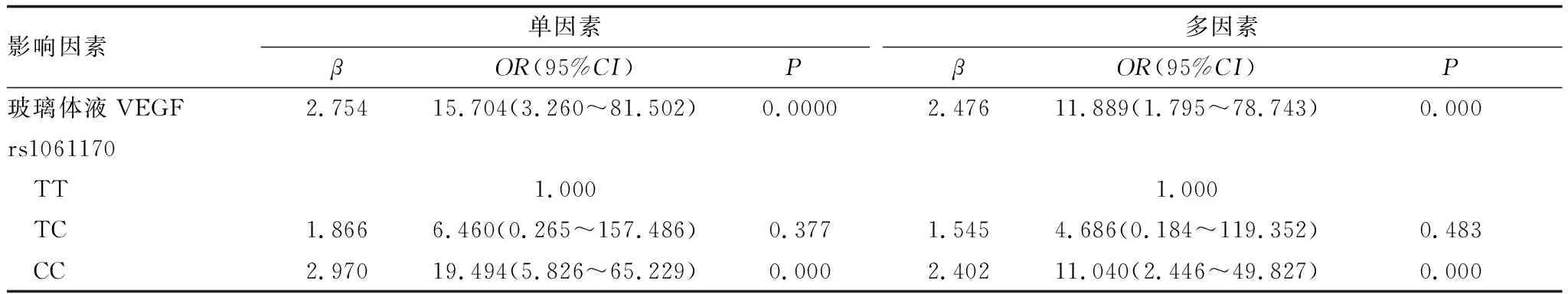
表4 抗VEGF疗效的影响因素分析
2.5 CFH基因多态性与患者玻璃体液VEGF对抗VEGF疗效影响的交互作用分析在全部AMD患者中,单独玻璃体液VEGF的OR值为41.250,单独rs1061170基因型CC的OR值为22.000,两者共存时的OR值为759.000,且γ为1.068,提示患者玻璃体液VEGF升高与CFH位点rs1061170 CC基因型在抗VEGF疗效中呈正向交互作用;同时交互作用<两单独因素OR值的乘积,则患者玻璃体液VEGF升高与CFH位点rs1061170 CC基因型交互作用符合次相乘模型(表5)。
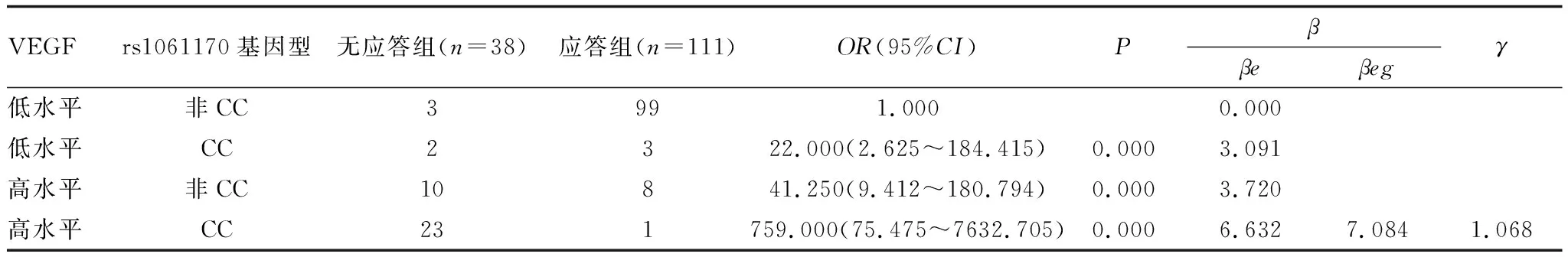
表5 CFH基因多态性与患者玻璃体液VEGF对抗VEGF疗效影响的交互作用分析
3 讨论
抗VEGF已成为现阶段AMD的一线治疗药物,多项随机临床试验亦证实抗VEGF治疗的有效性、可靠性,但仍存在部分患者在接受昂贵治疗后获益较小或无获益,表现出对抗VEGF治疗无应答,所以有必要对此进行深入研究[6]。
先天免疫系统中,补体系统能通过凝集素、旁路、经典途径矫正自身组织、防御入侵病原体,其中涉及多个相互关联的分子级联途径[7]。补体C3作为补体系统中含量最多、最重要的成分,是凝集素和经典途径的汇合点,也是旁路途径激活的关键因子,在补体激活途径中处于枢纽位置[8]。C3可在C3转化酶作用下,分解为C3a、C3b,其中C3a能结合自身受体刺激胶原蛋白在黄斑区视网膜色素上皮的沉积,在AMD发病早期起到重要作用;C3b过度沉积可激活补体旁路途径,造成AMD病情进一步进展[9-10]。CFH一方面能抑制C3转化酶形成,加速C3转化酶衰变,另一方面CFH对C3b具有较高亲和力,可竞争性结合C3b,促进C3b的裂解,保护宿主细胞免受攻击和损伤,从而防止C3a、C3b介导的AMD及其病情的进展[11-12]。
本研究结果表明,无应答组患者CFH位点rs800292、rs529825、rs1410996各基因型分布与应答组相似(均为P>0.05),无应答组患者CFH位点rs1061170基因型分布与应答组比较,差异有统计学意义(P<0.05),提示CFH位点rs800292、rs529825、rs1410996与AMD抗VEGF治疗应答无关,CFH位点rs1061170可能与AMD抗VEGF应答有关。为了揭示两者关系,本研究进一步进行了Logistic回归分析,结果表明,CFH位点rs1061170 CC基因型是抗VEGF疗效的独立相关影响因素。Blánquez-Martínez等[13]报道纳入了高度近视伴脉络膜新生血管患者,发现CFH位点rs1061170 TT基因型患者较CC基因型患者有更好的治疗效果。Medina等[14]对AMD患者注射抗VEGF药物后,发现CC基因型患者治疗后最佳矫正视力低于TT+TC基因型,与本研究结论相似。CFH位点rs1061170多态性位于第9外显子的1277位置上,T碱基突变为C可使CFH第402位酪氨酸变为组胺酸,减弱旁路途径活性,降低对C3a、C3b的转化作用,造成补体系统过度激活、脉络膜血管内皮损伤,以及新生血管持续形成,故会影响抗VEGF治疗反应性[15-16]。
VEGF可作用于视网膜,使视网膜长出新生血管[17]。有研究[18]发现,AMD患者外周循环中VEGF高于健康人群,且其表达水平与患者视力丧失密切相关。尽管目前关于AMD患者VEGF表达水平的研究较多,但致力于研究VEGF与治疗应答性关系的报道较少。本研究结果表明,与应答组比较,无应答组患者玻璃体液VEGF升高,是AMD抗VEGF疗效的独立影响因素。VEGF不仅能促进血管内皮细胞分裂、增殖,还能增加血管壁通透性[19]。高水平VEGF可介导大量新生血管,增加治疗难度,并能通过调节血管壁通透性,引起黄斑区炎症反应,损伤血管内皮细胞,形成恶性循环,从而影响抗VEGF疗效[20]。本研究结果表明,患者玻璃体液VEGF升高与CFH位点rs1061170 CC基因型在抗VEGF疗效中呈正向交互作用,且交互作用符合次相乘模型,提示CFH基因多态性与玻璃体液VEGF共存时,可进一步降低患者对抗VEGF治疗的应答。对VEGF高水平患者,或可通过增加抗VEGF药物剂量、次数等保证疗效,但对CFH位点rs1061170 CC基因型患者,经抗VEGF治疗后获益的可能性较小,尤其是当患者玻璃体液VEGF水平较高时,应酌情考虑选取其他治疗方法,以保证治疗方案的有效性,并减少盲目应用抗VEGF药物增加患者经济负担及潜在的并发症风险。另外,本研究因诊断需要,在患者充分知情前提下,采集眼局部玻璃体液VEGF,虽然保证能可靠地反映患者新生血管的生成潜能与病情进展可能性,但为侵入性操作,其临床推广应用情况受到患者接受度的影响,这是本研究一个局限之处,下一步需改进标本采集方法,以增加其临床大范围应用的可能性。
综上所述,患者玻璃体液VEGF升高与CFH位点rs1061170 CC基因型在AMD抗VEGF疗效中呈正向交互作用,且交互作用符合次相乘模型,这能为临床抗VEGF药物精准使用提供参考,一方面能保证治疗方案的有效性,另一方面能减少盲目应用抗VEGF药物增加患者经济负担及潜在的并发症风险。

