复合酶制剂和复合菌制剂对凡纳滨对虾生长、体生化组成及能量收支的影响
熊莹槐,罗晓春,钱雪桥,黄锦炉,刘绪博
(1. 广东海大集团股份有限公司畜牧水产研究中心,农业农村部微生态资源养殖利用重点实验室,广东 广州 511400;2. 华南理工大学生物科学与工程学院,广东 广州 510006)
引 言
凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,具有适温范围广(6~39 ℃),盐度适应能力强(0.5~50),生长速度快,抗病力强,肉质鲜美等特点,已成为中国和世界范围内的对虾三大养殖种类之一[1]。
在过去几十年间,随着水产养殖业的快速发展,全球鱼粉供应量开始出现短缺,鱼粉价格昂贵,因此在水生生物饲料中用植物蛋白替代鱼粉开始被广泛研究[2-3]。但是相对于动物蛋白,植物蛋白源存在诸多抗营养因子,诸如植酸盐、大豆抗原蛋白等,这会导致虾类消化酶活性下降,甚至导致养殖动物肠道组织结构产生病理性的损伤[4-6]。据报道,通过饲料添加复合酶制剂是提高水产动物对饲料消化吸收能力的一个有效的途径之一,甚至在一定程度上可以提高水生动物的免疫能力[7-8]。例如,Yildirim等[9]报道饲料中添加复合酶制剂(果胶酶、木聚糖酶等)可显著提高非洲鲶(Oreochromisniloticus×O.aureus)的饲料转化率和生长性能;王国霞等[4]报道饲料添加植酸酶和复合酶可以提高黄颡鱼(Pelteobagrusfulvidraco)抗氧化能力和肠道健康状况。
此外,随着全球市场对虾类的需求越来越大,虾养殖业迅猛发展[10],为提高虾养殖业的经济社会利益,高密度养殖模式开始在整个虾产业中流行[11-12],这使虾持续暴露在人工和次优的养殖条件下。在高密度养殖模式下,往往投入过多的饵料,从而导致残饵粪便在虾池的大量积累,使得对虾对饲料利用率下降,且水环境急剧恶化,有害微生物大量繁殖,进一步影响了对虾的生长、发育和产品质量[13]。饲料添加益生菌可以在一定程度上缓解养殖弊端,益生菌在肠道中的繁殖速度大于凋亡速度,并与宿主、环境形成动态平衡[14]。研究表明,益生菌可以在一定范围内形成占位效应,从而抑制致病菌过度生长,有助于调节肠道菌群的平衡,并可以提高宿主的免疫力;此外,益生菌还可以为宿主提供养分,增强宿主消化酶活性,提高饲料消化率[15]。目前,较少研究报道饲料中添加微生态制剂对凡纳滨对虾体生化组成、能量收支和能量平衡的影响。
本实验通过在饲料中添加复合酶制剂,复合菌制剂以及复合菌酶制剂来对比研究复合酶制剂和复合菌制剂对凡纳滨对虾生长、体生化组成、和能量平衡的影响,以期为凡纳滨对虾健康养殖提供理论依据。
1 材料与方法
1.1 实验设计
本实验于广州海鸥岛试验基地进行,所用系统为循环水系统。以初始体重(2.05±0.05)g凡纳滨对虾(Litopenaeusvannamei)为实验对象,分别设计了1个对照组和3个处理组,其中,A为对照组,投喂基础饲料(主要成分见表1);B为基础饲料+酶制剂(消化酶和非淀粉多糖酶等复合酶);C为基础饲料+复合菌制剂组(复合菌由嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母和粪链球菌构成);D为基础饲料+复合菌酶制剂(主要由嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母和粪链球菌复合菌与消化酶和非淀粉多糖酶等复合酶)。饲料制剂购于欧科拜克生物有限公司(洛阳,河南,中国)。菌酶制剂通过搅拌的方法与饲料均匀混合,B组酶制剂浓度为150 mg/kg,C组复合菌浓度为2×109cfu/g,D组菌、酶浓度分别为2×109cfu/g、150 mg/kg;饲料中添加的菌、酶剂量均为25 g/kg。每个处理组分别设4个重复,每个重复分别放养100尾虾。

表1 基础饲料的主要成分Table 1 composition of the basic feed
实验开始前,将对虾暂养于盐度17的半咸水中进行驯化,整个驯化期为10 d。期间保持合适充氧,定时测定水温,定时投喂适量基础饲料,并且将养殖用水的盐度每天提升2,逐渐驯化直到盐度升至养殖用水的自然盐度31。驯化暂养结束后稳定2 d,准备进行正式实验。
暂养驯化阶段结束后,将实验虾饥饿1 d,然后选取规格相近,无病无伤、健康活泼的凡纳滨对虾分轮次随机放入16个相同规格的400 L塑料桶中,每次放入对虾10尾,共放10轮即每个养殖桶中共放凡纳滨对虾100尾,在放虾过程中称量并记录每个重复中虾的总重量。然后进行45 d的养殖实验。养殖过程中,使水温保持27 ℃左右,溶氧高于5 mg/L,养殖用水盐度31,酸碱度8.0±0.1。养殖水质使用多功能YSI专业水质分析仪进行测定(Yellow Spring Instrument Co., Yellow Spring, Ohio, USA)。每天于上午8:30及下午5:00定时投喂,每天的投喂量以对虾体重3%~5%为准。每次投喂前分别收集养殖桶底部的残饵、粪便,同时换水1/3~2/3。每天检查并记录对虾的摄食和死亡情况。
1.2 样品采集与指标测定
1.2.1 粪便收集与肌肉采集
实验用饲料随机取样3份,用于饲料成分的分析。实验开始前对投喂时间内饲料的1.5 h溶失率进行测定,用于校正溶失造成的摄食量计算中的误差。残饵在投喂后1 h用虹吸法及时收集,每次在投喂前和投喂后1.5 h用虹吸法收集粪便和虾壳,再分别装入对应烧杯,在70 ℃下烘干至恒重后在-20 ℃下保存。实验结束时,对虾停食24 h,然后对每个桶的虾分别称重,样品在70 ℃下烘干至恒重后在-20 ℃下保存。
肌肉组织经液氮迅速冷冻后于-80 ℃超低温冰箱保存,用于肌肉组织腺苷酸的测定。
1.2.2 生长指标的计算
养殖实验开始前,测量记录实验用虾的初总体重、初均重、初均长、对虾的总数。45 d的养殖之后,将实验用虾进行24 h的饥饿处理,统计存活的数量,计算均增重、增重率、特定生长率等。
体重增长率=[均增重(g)/初均重(g)]×100%;
(1)
成活率=养殖结束后对虾总数/养殖开始前对虾总数×100%
(2)
特定生长率=(lnW2-lnW1)/t×100%;
(3)
W1表示初始体重,W2表示末体重,t表示养殖时间。
1.2.3 生化组成和能值的测定
将实验虾样品放入烘箱70 ℃下烘干至恒重,得到干物质含量;以马福炉(HRMF-7000,热博特有限公司,中国)550 ℃灼烧6 h灰化至恒重得到灰分含量;元素分析仪(Vario ELⅢ,元素分析系统公司,德国)测得N含量后,再计算得到蛋白质含量(6.25×N);以脂肪抽提仪(BUCHI36680,力辰仪器有限公司,中国)测定虾体脂肪含量(乙醚为抽提剂);虾体组织能值以氧弹热量仪(PARR6400,Parr仪器公司,美国)测得。
对虾的摄食(C)、生长(G)、呼吸(R)、粪便(F)、排泄(U)和蜕壳(E)的能量符合下列关系:
C=G+R+F+U+E
(4)
其中,C为摄入的饵料能量,G为生长能,R为代谢能,F为粪能,U为排泄能,E为蜕壳能。其中,C、G、F和E所含的能值用PARR 6400型氧弹热量仪测定,排泄能以下式计算:
U=(CN-GN-FN-EN)×24.83
(5)
式中,CN为摄食食物中所含的氮,GN为虾体中积累的氮,FN和EN为粪便和蜕壳损失的氮,24.83为每克氨氮的能值(KJ)。这里假定氨是唯一的氮排泄物。含氮量用VarioELⅢ型元素分析仪测定。呼吸耗能由能量收支式R=C-G-F-U-E求出。
1.2.4 腺苷酸含量的测定
腺苷酸含量采用Agilent 1100高效液相色谱仪(HPLC,Agilent Corp., USA)进行测定。适量冷冻肌肉组织样品加入9倍体积的冰冷高氯酸(0.9 mol·L-1)溶液进行匀浆。匀浆液于7 000 g、4 ℃下离心5 min,收集上清液并以3.75 mol·L-1K2CO3中和至pH6.5。中和后的溶液于7 000 g、4 ℃下离心10 min,收集上清液用于测定相应组织中腺苷酸含量。组织样品经0.45 μm微孔滤膜过滤后用于测定腺苷三磷酸(ATP)、腺苷二磷酸(ADP)和腺苷一磷酸(AMP)含量。以UltimateTM AQ-C18柱(4.6×250 mm),柱温为35 ℃,洗脱时间为24 min,流速为1.0 ml·min-1,检测波长为254 nm。以磷酸缓冲液(40 mmol·L-1KH2PO4和60 mmol·L-1K2HPO4,pH6.50)作为流动相。根据测得的峰面积和标准曲线计算腺苷酸含量(微摩尔每克组织,μmol·gww-1)。标准曲线由已知浓度的ATP(0-0.8 mmol·L-1)、ADP(0-1.2 mmol·L-1)和AMP(0-1.5 mmol·L-1)溶液制作而成[16]。回归曲线方程、总腺苷酸(TAN)含量计算公式如下:
ATP Y=14.045x+9.374,R2=1.000
(6)
ADP Y=18.11x-25.053,R2=0.9998
(7)
AMP Y=18.32x-31.33,R2=0.9998
(8)
TAN=[ATP]+[ADP]+[AMP]
(9)
上式中,Y表示腺苷酸峰面积,X表示腺苷酸浓度,[ATP]、[ADP]和[AMP]分别表示ATP、ADP和AMP浓度。
1.3 数据计算与统计分析
数据使用平均值±标准误(Mean±S.E.)表示。利用SPSS 22.0对凡纳滨对虾以上各指标的变化作单因子方差分析(One-Way ANOVA)和Duncan’s多重比较检验,并以P<0.05作为差异显著水平。
2 结果
2.1 不同处理组凡纳滨对虾的生长指标
由表2所示,养殖实验结果表明,饲料酶制剂和菌制剂均可以显著提高凡纳滨对虾的生长性能。投喂不同饲料45 d后,实验组(B、C、D组)凡纳滨对虾的末体重、均增重、增重率和特定生长率均显著高于对照组(A组),且D组生长指标显著高于其他组(P<0.05)。C组对虾的末体重、均增重和增重率显著高于B组,但显著低于D组(P<0.05)。
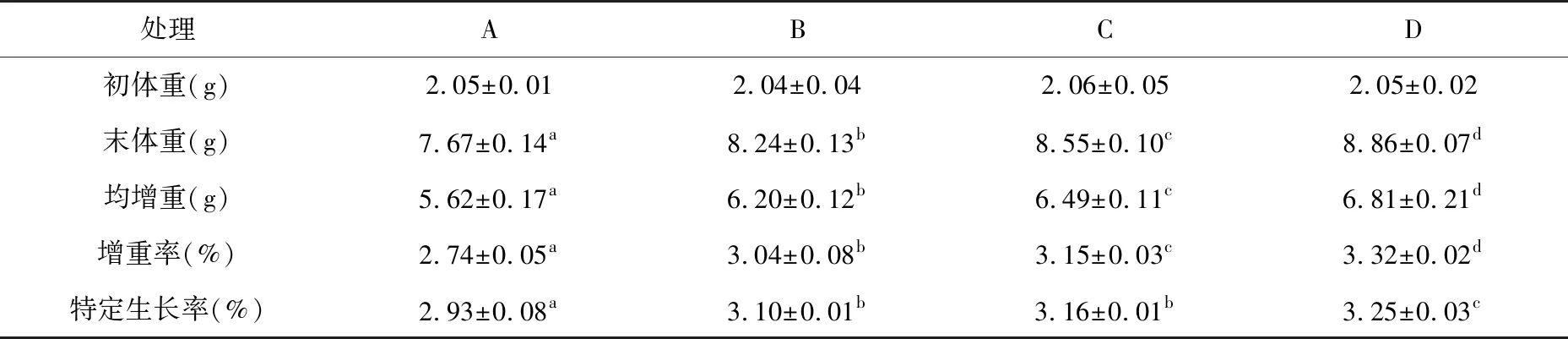
表2 不同处理凡纳滨对虾生长情况Table 2 Growth performance of Litopenaeus vannamei fed with different diets
2.2 不同处理组凡纳滨对虾的含能量及体生化组成
如表3所示,饲料酶制剂和菌制剂对凡纳滨对虾体脂肪和灰分影响不显著(P>0.05)。D组对虾体蛋白质含量显著高于A、B两组,且D组对虾体水分含量显著低于A、B和C组(P<0.05)。B组和C组对虾体水分和蛋白质差异不显著(P>0.05)。饲料添加复合菌制剂可以显著提高对虾体能量值,其中C组和D组对虾体能量显著高于A和B组(P<0.05)。
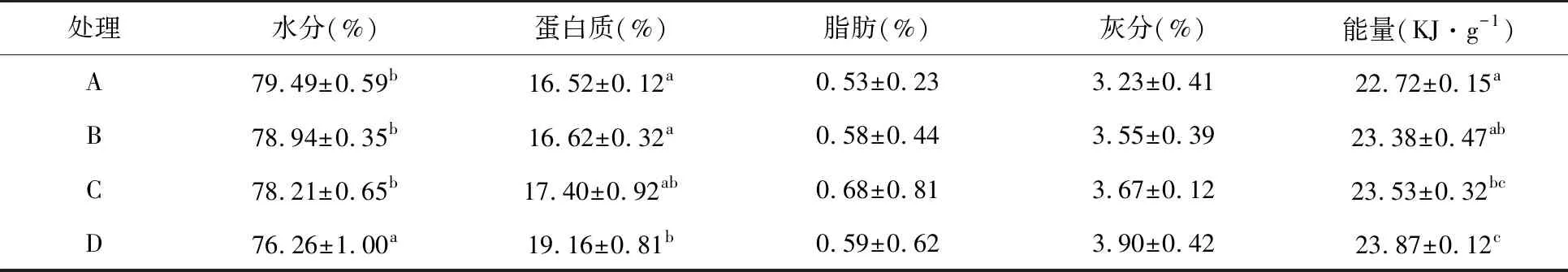
表3 不同处理凡纳滨对虾体成分组成和体能量Table 3 Body composition and energy content of Litopenaeus vannamei fed with different diets
2.3 不同处理组凡纳滨对虾的能量分配
由表4和表5可知,饲料添加酶制剂和菌制剂可以显著提高凡纳滨对虾的摄食能,生长能,呼吸能和蜕壳能,其中D组各能值含量最高(P<0.05)。相比于对照组(A组),B组对虾生长能占摄食能比例、蜕壳能占摄食能比例显著升高,且呼吸能占摄食能比例显著降低(P<0.05)。同样地,C组对虾生长能占摄食能比例、蜕壳能占摄食能比例也显著升高;呼吸能占摄食能比例和排泄能占摄食能比例均显著降低,且B、C两组间也存在显著性差异(P<0.05)。D组对虾生长能占摄食能比例、蜕壳能占摄食能比例显著高于其他三组,且呼吸能占摄食能比例和排泄能占摄食能比例显著低于其他三组(P<0.05)。
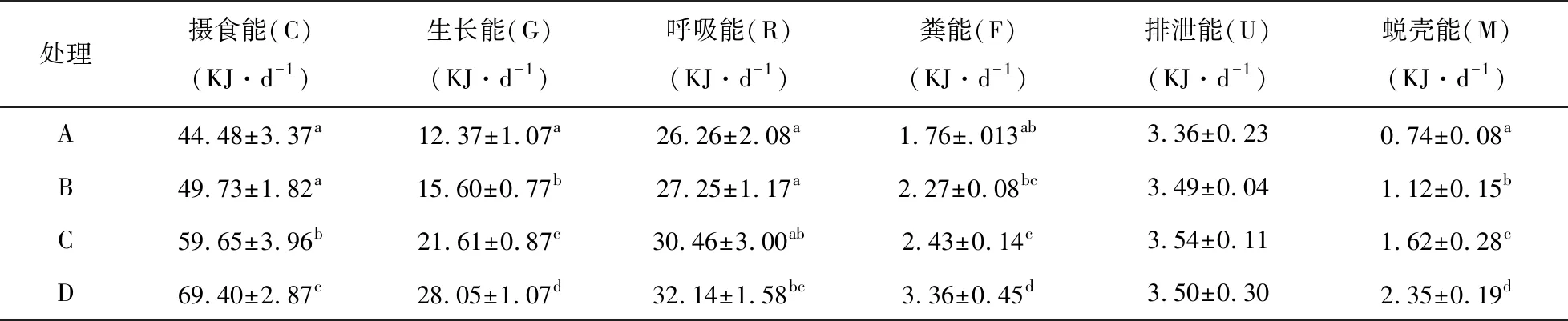
表4 不同处理凡纳滨对虾能量收支各组分能量值Table 4 Energy budget components of Litopenaeus vannamei fed with different diets
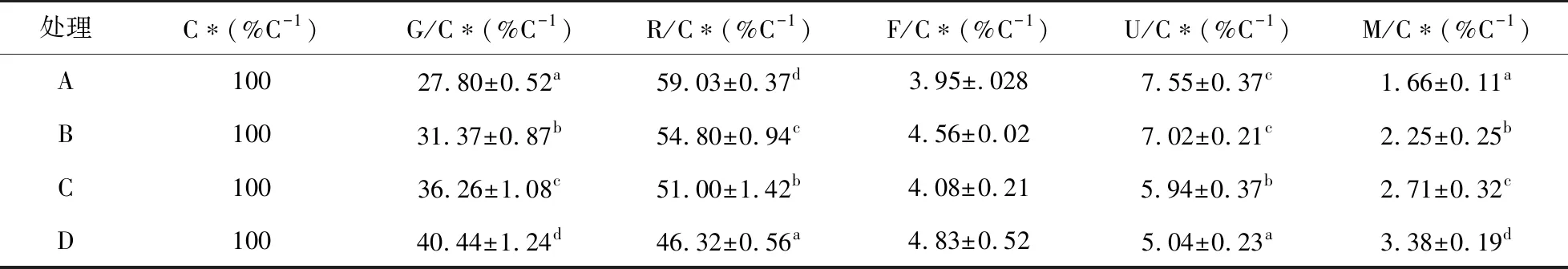
表5 不同处理凡纳滨对虾能量收支各组分能量分配Table 5 The ratio of the energy of each component to the energy of ingestion of Litopenaeus vannamei fed with different diets
2.4 不同处理组凡纳滨对虾肌肉的腺苷酸含量
由图1可知,不同处理对凡纳滨对虾肌肉的TAN无显著影响(图1a);饲料酶制剂(B组)和菌制剂(C组)显著提高了凡纳滨对虾肌肉ATP含量,且酶菌制剂(D组)肌肉ATP含量显著高于其他三组(P<0.05,图1b)。同时,饲料酶制剂组(B组)、菌制剂组(C组)和菌酶制剂组(D组)凡纳滨对虾肌肉AMP/ATP和ADP/ATP值显著低于对照组,且C组显著低于B组,D组显著低于其他三组(P<0.05,图1c,d)。

图1 不同处理凡纳滨对虾肌肉的腺苷酸含量注:ATP为腺苷三磷酸,ADP为腺苷二磷酸,AMP为腺苷一磷酸,TAN为三者之和。不同字母上标表示单因素分析Duncan’s检验差异性显著,下同。Fig.1 Adenine nucleotides in the muscles of Litopenaeus vannamei fed with different dietsNotes:ATP is adenosine triphosphate, ADP is adenosine diphosphate, AMP is adenosine monophosphate, TAN is the sum of the ATP, ADP and AMP. Means with different superscripts indicate significant differences (P<0.05) based on e-way ANOVA and the Duncan’s test.
3 讨论
通过添加酶制剂和菌制剂提高水产动物的生产性能已有大量成功的报道[13,15,17-18]。相似地,本实验也发现饲料中添加复合酶制剂(消化酶和非淀粉多糖酶)和复合菌制剂(嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母和粪链球菌)可显著提高凡纳滨对虾的生长性能。这可能因为,饲料中添加的消化酶增强了凡纳滨对虾对饲料的利用率,加大了营养物质的吸收,从而提高了生长性能。此外,酶制剂中的非淀粉多糖酶可降解可溶性非淀粉多糖,减少食糜粘性,也可以摧毁植物细胞壁,进一步释放饲料的营养成分[19]而被对虾所吸收利用。饲料中所添加的复合菌制剂本身可以作为营养物质被对虾利用,更可以改善肠道菌群结构,促进肠道成熟,增强肠道对营养物质的吸收能力[20-21]。其中,枯草芽孢杆菌自身可以合成α-淀粉酶、脂肪酶、纤维素酶、蛋白酶等,在消化道中与动物体内的消化酶类一同发挥作用[22]。此外,本实验表明,饲料中同时添加酶制剂和菌制剂效果比分别单独添加酶制剂或菌制剂效果好,表明凡纳滨饲料中复合酶和复合菌制剂可以起到协同作用。
本实验研究结果表明,饲料中复合菌酶制剂的添加会显著降低凡纳滨对虾体水分含量,并显著提高体蛋白质含量,从而提高凡纳滨对虾的品质。饲料中菌酶制剂的添加显著提高了凡纳滨对虾的摄食能,且菌酶制剂组凡纳滨对虾的(生长能/摄食能)和(蜕壳能/摄食能)显著高于其他组,而(呼吸能/摄食能)和(排泄能/摄食能)显著低于其他组,表明菌酶制剂组凡纳滨对虾更多的能量被用来生长和蜕壳。此外,相较于对照组,在饲料中单独添加酶制剂或菌制剂也可以显著提高凡纳滨对虾用于生长的能量,但该效果均不如菌酶制剂组好。
在生物体内,ATP是能量的储存形式,而ADP和AMP是能量被利用的形式,当机体的能量被大量储存时,生物体可以获得更好的生长性能[23]。本研究发现单独在饲料中添加复合酶制剂和复合菌制剂均可以显著提高凡纳滨对虾肌肉ATP含量,并降低ADP/ATP和AMP/ATP含量,表明酶制剂和菌制剂的添加可以促进对虾能量的保存率,从而提高其生长效率。此外,本实验进一步发现,在饲料中同时添加复合酶制剂和复合菌制剂效果比单独添加这两种制剂更好。这进一步解释了菌酶制剂组凡纳滨对虾具有最佳生长性能。
4 结论
本实验发现在饲料中添加复合酶制剂,复合菌制剂可以显著提高凡纳滨对虾能量收支状况和肌肉ATP含量,从而显著提高了凡纳滨对虾的生长性能。同时本研究结果表明,凡纳滨对虾饲料中酶制剂和菌制剂起到协同作用,同时添加效果最好。

