无机砷在海带中的富集及氧化胁迫效应
孙琰晴,徐 东,李 斌,陈丽竹,张明亮,叶乃好,胡顺鑫,李焕军,尼志杰,乔瑞光,相智巍
(1.上海海洋大学 国家海洋生物科学国际联合研究中心,水产科学国家级实验教学示范中心,上海 201306;2.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室,山东 烟台 264006;3.中国水产科学研究院黄海水产研究所,山东 青岛 266071)
引 言
在过去的几十年里,重金属及类金属物质在环境中的积累已逐渐成为影响动植物生长、代谢等生理生化功能的重要因素[1]。作为在自然界中广泛存在的类金属,砷及其化合物被世界卫生组织国际癌症研究机构列为一类致癌物,同时也被我国生态环境部列入有毒有害水污染物名录(第一批),对人类及动植物都具有很强的毒性作用。近年随着矿石的开采冶炼、含砷农药的使用等活动的加剧导致海洋中的砷污染愈发严重,对生态系统和人类的健康产生了巨大的威胁[2]。海洋植物是海洋生态系统的主要生产者,对海水中As浓度的变化具有敏感性[3],尤其是大型可食用藻类对砷的富集,已经引起人们的特别关注。
海带(Laminariajaponica)是一种含有多种矿物质的经济藻类,也是我国重要的养殖藻类之一。除食用功能外,海带还是一种重要的工业原料,可以用来生产褐藻胶、甘露醇、提取碘等,在化工、医药等方面都具有广泛应用,但由于其对重金属、矿物质等具有强烈的富集作用[4],亦被称为海洋中的“砷库”[5]。作为一种砷超积累的物种,它被认为是研究可食用海藻中砷潜在风险的理想材料[6]。目前对海带的相关研究主要集中在海带中生物活性物质的提取、分离及功能性研究、海带养殖模式的探索等方面,而环境因子尤其是重金属胁迫对海带的生理影响及其在海带中的富集研究较少。砷作为一种有毒类金属,会导致海带细胞大量活性氧的积累[7],而抗氧化防御系统则可以有效清除活性氧(ROS)[8],缓解超氧自由基、过氧化氢等造成的损伤。为探讨砷对海带抗氧化防御系统的影响及其在海带中的富集作用,本研究以海带孢子体为实验对象,测定不同暴露时间海带组织氧化损伤及抗氧化活性变化,同时利用电感耦合等离子质谱(ICP-MS)检测海带中总砷含量,从而揭示砷富集对海带孢子体抗氧化防御系统的影响,同时可为海带健康养殖提供一定的支持和依据。
1 材料与方法
1.1 实验材料及培养方法
海带孢子体从荣成东楮岛采集后,于自然海水中清洗两遍后暂养1~2 d,选取10 cm左右生长良好、藻体完整的海带于f/2培养基中进行循环水养殖和暴露实验,培养温度10±1 ℃,光照强度3 000~4 000 lx,光暗周期比12 L:12 D。实验所用消解管、玻璃容器提前经15%硝酸浸泡24 h以上。
1.2 实验设计
取藻体完整、生长情况较好的海带孢子体进行实验,根据预实验结果分别配制0.2、0.4、0.8、1.6 μmol/L的NaAsO2和Na2HAsO4海水进行暴露实验,分别标为Ⅲ-a、Ⅲ-b、Ⅲ-c、Ⅲ-d和Ⅴ-a、Ⅴ-b、Ⅴ-c、Ⅴ-d,每个处理三个平行,以不加砷的培养液作为空白对照Ctr,循环水养殖,分别在0、7、14、28 d时取样测定海带中总砷含量,并测定1、2、4、7、28 d时海带中H2O2、MDA含量和SOD、CAT酶活性。
1.3 实验方法
1.3.1 海带中总砷含量的测定
海带孢子体样品取样后用清水洗涤3次,吸水纸擦干表面水分,称取0.1 g海带样品于消解管中,加入8 mL硝酸溶液和2 mL过氧化氢溶液,拧紧消解管盖,放入微波消解仪中进行消解(消解条件:120 ℃ 10 min—150 ℃ 10 min—180 ℃ 20 min)。消解完成后180 ℃赶酸至近干,转移到25 mL比色管中定容,用ICP-MS进行总砷含量测定[9]。
1.3.2 样品提取和酶测定
海带孢子体取样后用清水洗净擦干,分别称取0.1 g左右样品加入9倍体积的生理盐水冰浴匀浆,4 ℃,12 000 r/min离心10 min,取上清待测。使用南京建成生物工程研究所有限公司试剂盒对CAT、SOD活性和MDA、H2O2含量进行测定。
1.3.3 统计与分析
用SPSS 20分析软件对实验数据进行单因子方差分析(One-way ANOVA)和多重比较(Duncan),P<0.05时具有显著性差异,所有数据为3个平行实验结果的平均值,并用origin 9作图。
2 结果与分析
2.1 海带中总砷含量变化
表1为无机砷暴露不同时间时海带中总砷含量。经测定,实验初始时海带中总砷含量为1.683 mg/kg(鲜重),与各取样时间对照组中总砷含量没有显著差异(P>0.05),但显著低于无机砷暴露后海带中总砷含量(P<0.05)。由表中可以看出,亚砷酸盐处理组海带中总砷含量随暴露浓度的升高呈逐渐升高的趋势,各取样时间内两个高浓度处理组海带中总砷含量无显著差异(P>0.05),但均显著高于较低浓度处理组(P<0.05),实验进行至28 d时Ⅲ-d组海带中总砷含量达到最大值,为4.869 mg/kg。除28 d外砷酸盐处理组海带中总砷含量随浓度的变化趋势同亚砷酸盐处理组,28 d时海带中总砷含量最大值在V-c处取得,为4.257 mg/kg,显著高于其他浓度处理组(P<0.05)。海带在相同浓度的两种无机砷暴露环境中的砷积累量不同,亚砷酸盐暴露下海带中总砷含量高于砷酸盐暴露。结果表明,海带对环境中无机砷具有富集作用,对亚砷酸盐的积累能力大于砷酸盐。

表1 无机砷暴露下海带中总砷含量Table 1 Total arsenic content in L. japonica exposed to inorganic arsenic 单位:mg/kg
2.2 As(Ⅲ)与As(V)对海带氧化-抗氧化生理生化指标的影响
2.2.1 无机砷砷影响下海带中MDA及H2O2含量
图1(a)为无机砷暴露后不同时间海带孢子体幼苗中H2O2含量,随着时间的增加,两种无机砷形态暴露下海带在4 d内H2O2含量变化趋势不同。As(Ⅲ)处理组中,H2O2含量在4 d内呈上下波动趋势,除Ⅲ-c在第2天时取得最小值外,其他处理组均在第4天时取得最小值。As(V)处理组中H2O2含量除V-d组外呈降低趋势,其中V-d组在第2天时取得最小值,其他处理组在第4天时含量最低。4 d后H2O2含量逐渐增加,实验28 d时结果显示,随着砷暴露浓度增加,各处理组中H2O2含量增加,且显著高于对照(P<0.05)。结果表明,无机砷暴露对海带中H2O2含量的增加起到促进作用,且随浓度的升高促进作用增强。

图1 无机砷暴露后海带组中H2O2及MDA含量Fig.1 The content of H2O2 and MDA in L. japonica after inorganic arsenic exposure
从图1(b)中可以看出,无机砷处理下海带孢子体幼苗MDA含量随时间呈现先降低后升高再降低的趋势。第2天时MDA含量较第1天时显著下降(P<0.05),随后在第4天时显著升高并达到最大值(除V-c组外)。实验28 d时,所有砷处理组海带中MDA含量较7 d时均显著降低(P<0.05)。随着砷暴露浓度的增加,As(Ⅲ)和As(V)处理组海带中MDA含量均呈现逐渐升高的趋势,除最高浓度处理组外,As(Ⅲ)暴露下海带中MDA含量高于As(V)暴露。实验期间,所有实验组海带中MDA含量均显著高于对照组(P<0.05)。结果表明,无机砷暴露会使海带中MDA含量的显著升高,且浓度越高越易造成藻细胞过氧化损伤。
2.2.2 无机砷对海带中CAT及SOD酶活的影响
无机砷暴露下海带孢子体幼苗中过氧化氢酶(CAT)活性随时间的变化如图2(a)所示,随时间的增加,海带中CAT活性呈现上下波动的变化趋势。实验第2天时,所有处理组CAT活性较第1天时均显著升高(P<0.05),并达到最大值,Ⅲ-b、V-b处理组CAT活性分别为As(Ⅲ)与As(V)处理组中的最大值,分别达90.48 U/mg和72.05 U/mg。4 d时各处理组CAT活性均显著降低(P<0.05),随后在7 d时上升。28 d时海带CAT活性较1 d时升高,其中As(Ⅲ)处理组活性随浓度的升高而升高,As(V)最高浓度处理组CAT活性高于其他浓度处理组。结果表明,无机砷暴露会使海带中CAT活性短暂升高以缓解氧化损伤,暴露一段时间后海带CAT能力达到饱和,并开始降低,长期砷暴露下海带CAT活性达到相对稳定状态。
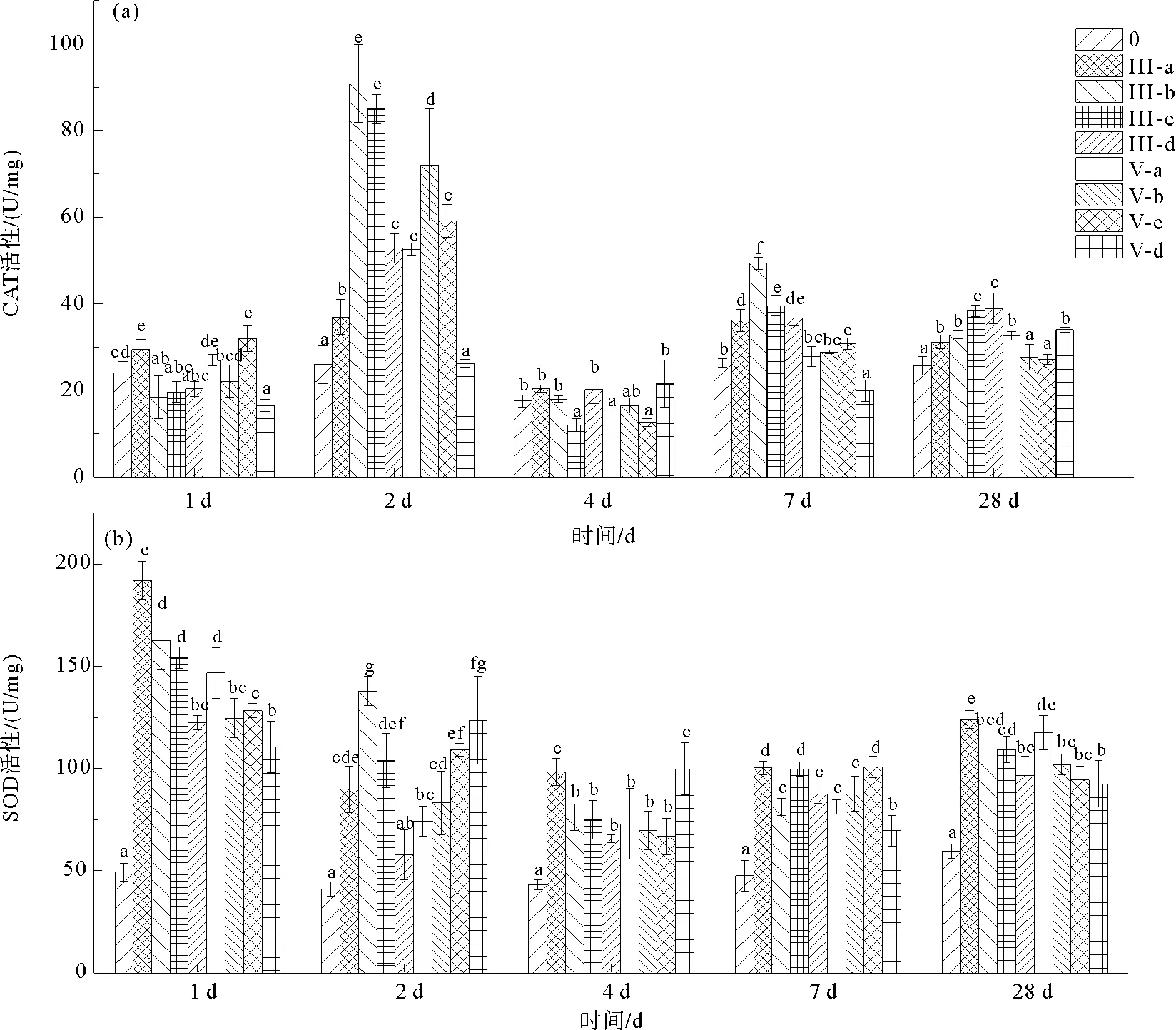
图2 无机砷暴露后海带中CAT及SOD活性Fig.2 The activities of CAT and SOD in L. japonica after inorganic arsenic exposure
图2(b)中可以看出,所有砷处理组海带孢子体幼苗中超氧化物歧化酶(SOD)活性在第1天时最大。第2天时所有处理组都显著下降(P<0.05),4 d时除Ⅲ-a、Ⅲ-d外各处理组中SOD活性仍继续下降。之后,随着暴露时间的延长,各处理组海带中SOD活性逐渐升高,对照组海带中SOD活性在整个实验期间处于较低水平,显著低于实验组(P<0.05)。实验28 d时,海带中SOD活性仍低于1 d时水平,两种无机砷暴露下最低浓度处理组SOD活性最高,除Ⅲ-b组外,随暴露浓度升高而降低。结果表明,砷暴露诱导了海带中SOD活性的升高,但随暴露时间增加对其影响减弱,低浓度无机砷暴露下海带SOD活性更高。
3 讨论
3.1 海带对无机砷的积累
研究海带中砷的积累,有助于了解全球砷污染环境下海水中砷浓度的升高对海带中砷含量的影响,从而有助于降低其对人类产生的健康问题[10-11]。虽然有研究表明海带不同部位中砷的富集量有所不同,如刘天红等[9]认为,海带假根部总砷含量最高,其次是叶片中部、边稍部,其叶尖处的砷含量最低,与聂新华[12]、姜桥[13]等的研究结果一致。这是因为海带主要靠叶片吸收营养物质及微量元素,再运输到各个部位,根部生长期长,因此砷的富集量明显高于柄部和叶片。但由于本实验所用海带孢子体幼苗较小,不易分别对不同部位砷含量进行准确测定,因此本实验中砷的测定值为整株海带孢子体幼苗的整体砷含量。在砷酸盐暴露下,海带对砷富集量较小,这可能是由于养殖水中存在的磷与砷共处同一主族,具有相似的化学性质,而海带都是通过磷酸转运蛋白吸收As(V)和无机磷酸盐,存在一定的竞争关系[14-15],而As(Ⅲ)进入藻细胞的通道不受养殖水中磷的影响[16],另外由无机砷暴露下海带对砷的富集系数(BCF)结果显示,28 d时As(Ⅲ)最高浓度处理组BCF值为46.44,远大于相同浓度处理下As(V)组中BCF值22.33。因此本研究中磷充足的条件下,海带对As(V)的富集能力弱于As(Ⅲ),但磷限制条件下海带对As(V)富集转化及其机制有待进行深入研究。
3.2 无机砷暴露对海带氧化损伤及抗氧化防御酶系的影响
所有需氧生物体都拥有一套比较完整的抗氧化防御体系[17],在干旱、寒冷、高盐及重金属等逆境胁迫中对生物健康起到了至关重要的作用。研究表明,砷酸盐可以解除氧化磷酸化和光合磷酸化,对氨基酸中的巯基基团具有较高的亲和力,从而抑制了某些含有巯基基团的酶的表达并使蛋白质变性,通过阻止蛋白质之间的相互作用而损害细胞新陈代谢[8-9]。植物体内丙二醛(MDA)和过氧化氢(H2O2)含量高低能够反映出植物细胞膜受到伤害程度的大小。实验初期海带孢子体幼苗中过高的MDA和H2O2含量说明砷暴露引起了海带的氧化应激,且较高浓度砷处理下过氧化作用更强。有证据表明,无机砷的暴露会导致大量活性氧的产生及脂质过氧化作用的发生,对细胞产生损害[18]。而连续的无机砷暴露带来的氧化应激激活了抗氧化酶防御系统,本研究中MDA和H2O2含量在第2天时的降低证实了这一点(图1),但由于海带自身抗氧化能力的有限性,随着暴露实验的进行,其含量仍显著高于对照组。抗氧化酶防御系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等,其中SOD构成了对抗活性氧(ROS)的第一道防线[19]。植物可以通过SOD发挥作用,将砷胁迫诱导的超氧自由基转化为H2O2,并通过CAT阻止H2O2积累,使其分解或还原为H2O和O2,达到降低植物体内活性氧含量的效果[20]。
CAT活性在实验第2天时达到最大值,表明海带可以通过提高CAT活性来缓解过氧化损伤,第4天时活性的显著降低可能是一段时间的砷胁迫抑制了过氧化氢酶分子的活性或抑制了相关酶基因的表达,其具体机理有待进一步研究。长期砷暴露下海带CAT活性达到相对稳定状态。从砷浓度对CAT活性的影响看,第28天时CAT活性均高于对照组,其中As(Ⅲ)处理组浓度越高CAT活性越强,As(V)处理组高浓度下CAT活性高于其他浓度处理组,与H2O2含量测定结果基本一致,说明长期砷暴露下海带仍会通过提高酶活性来帮助细胞清除过多的H2O2,但砷暴露下其能力是有一定限度的。海带中SOD活性在实验1 d时,而后逐渐降低并趋于稳定,但实验期间SOD活性始终显著高于对照组(图2),可能是砷胁迫破坏了原有的活性氧产生消除平衡,在短暂SOD活性升高后逐渐达到新的平衡,在砷胁迫对美人蕉[20]、水稻幼苗[21]等植物中也发现了SOD增强的现象。因此,在海带养殖过程中,海带虽然能够对砷胁迫做出一定程度的响应,但仍要对海水中砷含量进行监测,以防止砷富集对海带生长、品质和产品安全带来不利影响。
4 结论
(1)研究结果表明,不同价态无机砷在海带中的积累不同,海带对五价砷的积累能力弱于三价砷。
(2)类金属砷的存在对海带细胞产生了一定程度的氧化损伤,使海带中过氧化氢和丙二醛含量升高,但随砷暴露时间的增加,海带中抗氧化防御系统通过一定的自我调节,从而降低了砷胁迫的毒害作用。

