Bcl-2抑制剂维奈克拉联合去甲基化药物治疗老年急性髓系白血病8例效果观察*
颜春霞,王信峰,杨 力,钱 娟
(南通大学附属医院血液科,江苏 226001)
急性髓系白血病(acute myeloid leukemia,AML)是一组造血干细胞恶性克隆性疾病,具有高度异质性,是成人急性白血病中最常见的类型。AML 中位诊断年龄约67 岁,54%患者诊断年龄为65 岁或以上[1]。2021年版NCCN 指南对≥60 岁适合强诱导化疗的AML 患者,仍推荐经典的“3+7”方案作为一线诱导治疗方案,然而实际上老年患者常合并心、肺等重要器官疾病,部分患者无法耐受标准“3+7”方案,容易发生感染、出血、心功能不全、肝肾功能异常等,且恢复慢,导致下一疗程的化疗无法正常进行,影响疗效。本研究选取2019年8月—2021年9月我院诊治的8 例老年AML 患者,观察维奈克拉联合去甲基化方案的疗效及安全性。
1 资料与方法
1.1 一般资料 老年AML 患者8 例,均进行完整的细胞形态学、细胞免疫学、细胞遗传学、分子生物学分型。男性6 例,女性2 例;急性单核细胞白血病(M5)6 例,急性粒细胞白血病部分分化型(M2)1 例,急性粒-单核细胞白血病(M4)1 例;初治2 例,复发4 例,难治2 例;复杂核型2 例,FLT-3 高表达2 例;美国东部肿瘤协作组(ECOG)评分1~3 分。所有患者心肺及肝肾功能无明显异常。见表1。
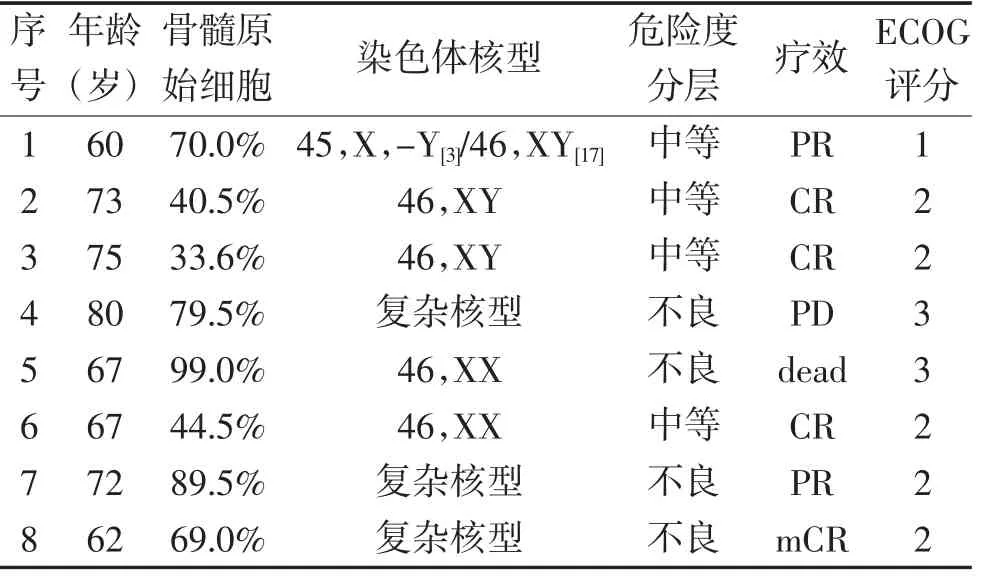
表1 AML 患者8 例临床资料
1.2 治疗方案 8 例患者均采用维奈克拉联合去甲基化治疗,维奈克拉片口服,第1 天100 mg,第二天200 mg,第3 天400 mg,达到目标剂量后维持,连服21 天;去甲基化药物4 例选用地西他滨,4 例选用阿扎胞苷,地西他滨20 mg/m2,连用5 天,阿扎胞苷75 mg/m2,连用7 天。治疗28 天为1 疗程。若治疗过程中出现感染、Ⅲ~Ⅳ级骨髓抑制、出血等并发症,予以积极抗感染、升白细胞、止血、输注成分血等治疗。待并发症控制、骨髓恢复造血、血细胞基本正常、病情稳定后行下一疗程治疗。
1.3 观察指标及疗效判断 治疗2 个疗程后行疗效判断,观察客观缓解率(ORR)和缓解率。疗效判定标准参照《成人急性髓系白血病(非急性早幼粒细胞白血病)2017 版》,分为完全缓解(CR)、部分缓解(PR)、骨髓完全缓解(mCR)、稳定(SD)、疾病进展(PD)和死亡(Dead)。ORR=(CR 例数+PR 例数+mCR例数)/总例数×100%,缓解率=(CR 例数+mCR 例数)/总例数×100%。不良反应根据美国国立癌症研究院通用的CTCAE v3.0 标准判定。
2 结果
2.1 临床疗效 8 例患者中CR 3 例,mCR 1 例,PR 2 例,PD 1 例(后改用其他方法治疗),死亡1 例。ORR 为75.0%,缓解率为50.0%。
2.2 不良反应 (1)骨髓抑制:8 例患者均出现骨髓抑制,白细胞、红细胞、血小板不同程度下降,其中Ⅱ度骨髓抑制3 例,Ⅲ度骨髓抑制2 例,Ⅳ度骨髓抑制1 例,Ⅲ~Ⅳ度骨髓抑制发生率为37.5%。经积极输注成分血、预防感染、升血细胞等处理后,外周血三系细胞逐渐上升,骨髓抑制改善。(2)感染:出现感染4 例,其中肺部感染2 例,尿路感染1 例,败血症1例,感染发生率为50.0%,经积极抗感染等治疗后好转。(3)胃肠道反应:出现Ⅱ度恶心、呕吐反应3 例,发生率为37.5%,Ⅲ~Ⅳ度胃肠道反应1 例,发生率为12.5%,予以积极对症处理后好转。(4)其他不良反应:肝功能损害2 例,护肝治疗后好转;皮疹1 例,抗过敏治疗后好转;乏力3 例;口腔溃疡1 例,对症处理后好转。
3 讨论
2018年11月美国食品药品监督管理局(FDA)批准Bcl-2 抑制剂维奈克拉联合去甲基化药物或低剂量阿糖胞苷(LDAC)治疗方案,主要用于>75 岁的老年初治AML 患者或不适合强化疗患者。2020年12月维奈克拉在我国获批[2]。维奈克拉可特异性结合抗凋亡蛋白BCL-2 BH3 结构域,解除BCL-2 对促凋亡蛋白的抑制作用,调控线粒体凋亡通路,导致白血病细胞凋亡[3]。去甲基化药物可通过整合应激反应途径诱导Noxa,启动维奈克拉诱导细胞凋亡[4]。两药联合可影响三羧酸循环,破坏能量代谢,导致干细胞/祖细胞死亡,协同诱导线粒体凋亡通路。
DINARDO 等[5]研究显示,对于不适合强化疗的AML 患者,接受维奈克拉联合阿扎胞苷治疗方案患者的总生存(OS)(14.7月vs 9.6月,P<0.001)及CR率(36.7% vs 17.9%,P<0.001)优于阿扎胞苷单药治疗。一项回顾性分析纳入去甲基化治疗失败的23 例复发/难治AML 患者,包括曾接受过异基因造血干细胞移植患者,采用维奈克拉联合去甲基化药物,CR/骨髓完全缓解(CRi)率43%,6 个月生存率74%,中位总生存期10.8 个月[6]。综合考虑患者年龄、基础疾病及对药物的耐受性等因素,本组患者应用维奈克拉联合去甲基化药物方案,2 个疗程后ORR 为75.0%,缓解率为50.0%。治疗期间主要不良反应为骨髓抑制、胃肠道反应、感染等,Ⅲ~Ⅳ度血液学不良反应发生率为37.5%,感染发生率为50.0%,Ⅲ~Ⅳ度胃肠道反应发生率为12.5%,经积极对症支持处理后均获得改善。

