Lrrc15在斑马鱼胚胎血管发育中的作用*
刘 伟,葛晓娟,刘 东,陈昌盛
(南通大学生命科学学院,江苏 226019)
Lrrc15(leucine-rich repeat-containing 15)属于富亮氨酸重复蛋白(LRR)超家族成员[1],该超家族蛋白在进化上高度保守,其功能与动植物固有免疫相关,参与组成生物体免疫的第一道防线[2]。该家族成员还参与调控多种生物学过程,包括细胞侵染、细胞黏附、细胞凋亡、细胞外基质装配以及RNA 加工等[3-4]。人类Lrrc15 蛋白含有581 个氨基酸残基,属于I 型膜蛋白,但胞内结构域较小[5]。Lrrc15 通常在肿瘤组织以及肿瘤相关成纤维细胞中高表达,促进肿瘤发展和转移[4]。肿瘤发展和转移高度依赖血管系统,发达的血管系统为肿瘤组织提供增殖所需的营养物质,同时也为肿瘤细胞浸润和转移提供通道。尽管Lrrc15 在肿瘤细胞中高表达,但在肿瘤发生发展中的作用,尤其是在血管发育中的作用仍不清楚。
本研究选择斑马鱼作为模式生物,具有体型小、发育快、成本低、产卵量大、易于体外受精和胚胎体外发育等优势。斑马鱼基因组与人类高度同源,约70%人类蛋白编码基因和84%人类疾病相关基因可以在斑马鱼中找到同源基因[6]。斑马鱼胚胎通体透明,通过将血管特异标记的转基因斑马鱼系和荧光显微成像技术结合,可实现对胚胎发育过程中整个血管系统高分辨率成像,实时观察血管发育。斑马鱼胚胎在心血管系统功能严重缺陷的情况下依靠皮肤渗透作用摄取氧气和营养存活1 周左右,非常适合心血管发育相关疾病发生机制的研究[7-8]。本研究首先采用全胚胎原位杂交技术检测在斑马鱼早期胚胎发育过程中Lrrc15 基因表达时间和位置,然后通过Morpholino 基因敲降技术下调Lrrc15 基因表达,分析Lrrc15 对血管发育的影响和作用。
1 材料与方法
1.1 实验动物 斑马鱼由南通大学实验动物中心提供[SCXK(苏)2019-0001/SYXK(苏)2017-0045],包括野生型斑马鱼AB 系和转基因斑马鱼Tg(fli1:EGFP)系。饲养条件:水温28.5 ℃,模拟昼夜节律光照(8:00~22:00,14 h)/黑暗(22:00~08:00,10 h),每日喂食丰年虫2 次。斑马鱼管理方式参考文献[9]。动物实验实施严格按照NIH 管理办法(http://oacu.od.nih.gov/regs/index.htm)。实验符合江苏省实验动物管理委员会伦理规范,伦理审批号为20200711-001。
1.2 主要试剂 4%多聚甲醛(PFA),PBST 磷酸缓冲液,甲醇,蛋白酶K(Roche),anti-Digoxigenin-AP Fab fragments(Roche),低融点琼脂糖(Thermo Fisher Scientific),PTU(Sigma)。
1.3 实验方法
1.3.1 斑马鱼胚胎获取:收胚胎前一晚将斑马鱼成鱼按雌雄1∶1 放入杂交缸,次日早晨亮灯后拔去挡板,交配后收集胚胎加入E3 培养液,在28.5 ℃培养箱中培养。分别于受精后19、24、36 和48 h 收集胚胎,于4 ℃下以4%多聚甲醛固定。过夜处理后用PBST 洗脱,甲醇梯度脱水,-20 ℃存储备用。
1.3.2 原位杂交探针制备:针对斑马鱼Lrrc15 CDS序列设计上下游引物,上游引物F:5’-GCTCAGTCATCTCAGGTCCC-3’;下游引物R:5’-TGGTGTGAAGGGAAACCTCC-3’;产物长度为464 bp。PCR扩增目的片段,利用T4 连接酶将PCR 产物插入pGEM-T-easy 载体。使用Sal I 内切酶线性化重组质粒,DIG RNA Labeling Kit(Roche)体外转录地高辛标记的Lrrc15 RNA 探针。
1.3.3 胚胎原位杂交:原位杂交具体操作参考文献[10]。选取19 hpf、24 hpf、36 hpf 和48 hpf 时间点的胚胎,经梯度甲醇进行复水处理,PBST 多次清洗后使用100 ng/mL 蛋白酶K 消化处理,然后加入Lrrc15 RNA 探针于70 ℃水浴锅杂交过夜。第2 天使用梯度杂交液和梯度柠檬酸钠缓冲液(SSC)进行孵育,洗去未结合和非特异结合的探针,然后经Anti-Digxigenin-AP Fab fragment 抗体避光4 ℃过夜处理。第3天使用1%MABT 和NTMT 溶液洗去未结合的抗体,加入底物BM Purple AP Substrate,显色,最后将染色的胚胎于显微镜(Olympus stereomicroscope MVX10)下拍照观察。
1.3.4 斑马鱼胚胎的显微注射:根据Lrrc15 基因序列信息设计并订购特异Lrrc15 MO(GENETOOLS,LLC),MO 序列:5’-TCACAAACAACGCCAGGTCCATTGA-3’。在斑马鱼1 细胞期显微注射Lrrc15 MO 1 ng,下调Lrrc15 基因表达,将注射后的胚胎置于28.5 ℃条件下培养。
1.3.5 显微成像:将转基因斑马鱼Tg(fli1:EGFP)胚胎麻醉后,固定在1%低融点琼脂糖中,使用尼康A1R 激光共聚焦显微境进行荧光成像,观察斑马鱼血管表型变化。
1.3.6 血管表型分析:使用Image J 软件对图像进行分析,测量背主动脉(DA)和后主静脉(PCV)直径、节间血管(ISV)长度和直径、腹侧静脉(VV)直径、尾静脉丛(CVP)宽度和面积以及尾静脉丛孔洞数量等参数。背主动脉和后主静脉直径测量:取5 条鱼,每条鱼选取5 个位置进行测量;节间血管长度测量:取5 条鱼,测量每条鱼尾静脉丛正上方5 根节间血管的长度;节间血管直径测量:取5 条鱼,每条鱼选取尾静脉丛正上方3 根节间血管,每根节间血管随机取3 个位置,测量其直径;腹侧静脉血管直径测量:取5 条鱼,每条鱼选取5 个位置进行测量;尾静脉丛宽度和面积以及尾静脉丛孔洞数量测量:共取9 条鱼进行测量。
1.4 统计学处理 所有实验重复3 次以上,样本量n>5。应用SPSS 13.0 统计学软件进行数据分析。计量数据以均值±标准差表示,组间比较采用t 检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 Lrrc15 基因在斑马鱼胚胎发育中的时空表达 利用斑马鱼胚胎原位杂交技术在转录水平检测Lrrc15 基因的表达,发现在胚胎多个发育时间点,包括血管新生发生前(19 hpf)、血管新生发生阶段(24~36 hpf)以及血管新生完成后血管结构重塑阶段(48 hpf),Lrrc15 表达于血管系统中,并在尾静脉丛位置高表达(图1)。在血管新生初期阶段(24 hpf)Lrrc15 基因表达最高(图1),在血管新生末期仍能在尾静脉丛检测到微弱表达。虽然Lrrc15 主要在血管新生阶段表达,但并未在节间血管中表达(图1),提示其可能对动脉起源的血管新生不起作用,仅与静脉起源的血管新生相关。
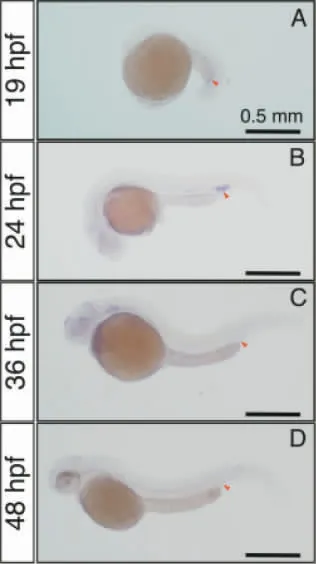
图1 原位杂交检测Lrrc15 基因在斑马鱼胚胎发育中的表达
2.2 下调Lrrc15 表达导致斑马鱼尾静脉丛发育缺陷 在转基因斑马鱼Tg(fli1:EGFP)胚胎1 细胞期显微注射Lrrc15 MO,培养至36 hpf 和48 hpf 进行共聚焦显微成像,每组分别取5 条斑马鱼。结果显示Lrrc15 基因下调后,整个血管系统的发育正常,并未表现出肉眼可见的明显差异。由于Lrrc15 可能在尾静脉丛发育中起重要作用,因此我们重点关注尾静脉丛的变化。从共聚焦成像结果来看,Lrrc15 基因下调后,尾静脉丛的表型并未表现出明显差异(图2)。
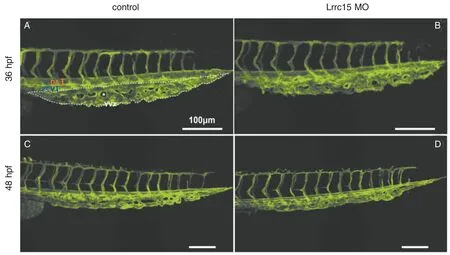
图2 下调Lrrc15 基因表达导致斑马鱼尾静脉丛发育异常
为了进一步验证Lrrc15 基因下调是否影响血管系统发育,我们对多个血管相关指标进行分析。结果显示,Lrrc15 下调后36 hpf DA 和PCV 直径明显变细,而在48 hpf Lrrc15-MO 组与对照组(control组)无显著差异(图3A、3B);ISV 长度在Lrrc15 下调后无明显改变,只在48 hpf 节间血管直径变细(图3C、3D);在Lrrc15 下调后36 hpf 及48 hpf,尾静脉丛宽度、面积、孔洞数量以及VV 直径均出现降低或减少(图3E-3H)。

图3 对照组与Lrrc15-MO 组血管指标分析
3 讨论
富亮氨酸重复序列是一类广泛存在于多种蛋白中的模体(motif),含有20~29 个氨基酸残基,主要功能是协助蛋白相互作用[11]。从细菌到高等动物均已发现此类蛋白,它们最广为人知的作用是参与生物体内的固有免疫[12]。Lrrc 蛋白是Lrr 蛋白超家族的一个亚家族,通常包含2~45 个Lrr 模体,在进化上高度保守[13]。据报道,至少有34 种人类疾病与LRRC蛋白有关,迄今为止仍有上百个LRRC 蛋白的功能不明确[13]。Lrrc15 通常在肿瘤组织中高表达,其表达水平与预后相关。Lrrc15 是一种可被肿瘤生长因子调控的结构蛋白,在实体肿瘤相关成纤维细胞(CAF)中高表达[14-15]。目前已发现高表达Lrrc15 的实体瘤主要有肺癌、胰腺癌和乳腺癌。此外,Lrrc15 在间叶细胞来源的肿瘤,如恶性胶质细胞瘤和黑色素瘤中高表达[15]。然而,Lrrc15 在肿瘤发生发展中的作用及其机制仍不清楚。有研究指出,Lrrc15 参与招募肿瘤微环境中巨噬细胞或小胶质细胞聚集,从而引起肿瘤复发和治疗抗性,导致预后不良。另外,高表达Lrrc15 促进肿瘤细胞增殖,加速肿瘤发展[16]。最新一项研究探讨Lrrc15 促进肿瘤细胞迁移和侵袭的分子机制,认为Lrrc15 可通过调控经典的Wnt/nt 信号通路促进三阴性乳腺肿瘤的发生和发展[14]。另外,Lrrc15 不仅促进肿瘤细胞迁移和增殖,还可通过调控肿瘤抑制因子p53 而抑制肿瘤细胞凋亡,延长肿瘤细胞存活时间并产生治疗抗性[17]。肿瘤发生和发展与血管新生息息相关,发达的血管系统为肿瘤生长及转移提供有利条件。
为了探索Lrrc15 在血管发育尤其是血管新生中的作用,本研究利用斑马鱼作为模式生物,探究Lrrc15 在胚胎血管发育中的功能。斑马鱼血管系统的建立分为两个阶段,第一阶段为血管发生(vasculogenesis),此过程始于中胚层血管母细胞分化形成内皮细胞,内皮细胞通过增殖、迁移以及管腔化形成初级血管,如背主动脉和后主静脉[18]。我们的研究发现,在36 hpf Lrrc15 敲降组背主动脉和后主静脉直径明显变细,48 hpf 时恢复至与对照组同一水平。这种现象可能由于注射MO 导致胚胎发育延迟,而Lrrc15 本身对血管发生的作用很小。血管发育第二阶段称为血管新生(angiogenesis),在此阶段中初级血管通过芽生(sprouting)和分枝(branching)产生新的毛细血管,新产生的血管相互连接,经过选择性融合和退化等重塑过程形成功能性血管网[19]。在斑马鱼血管系统的建立过程中存在两种形式的血管新生,即依赖于背主动脉向上出芽形成节间血管和后主静脉向下出芽形成尾静脉丛。本研究发现,抑制Lrrc15表达可引起尾静脉丛的发育异常,包括尾静脉丛宽度变窄、面积变小、空洞数量减少以及腹侧静脉变细,说明Lrrc15 具有调控尾静脉丛血管新生的作用。但是,节间血管的发育并未受到Lrrc15 下调的影响,只是在48 hpf 节间血管直径表现出变细的表型,推断这与尾静脉丛的发育异常有关。由于尾静脉丛功能类似于哺乳动物胚胎肝脏器官,参与造血及血流的形成[20]。尾静脉丛发育异常会引起血流变慢,而血管管腔化需要血流推动。因此,尾静脉丛发育后期的异常可能通过减少血流而减弱节间血管的管腔化。由于节间血管和尾静脉丛的形成分别依赖于VEGF/VEGFR2 和BMP2/BMPR2 两种不同的信号通路[21],我们推断Lrrc15 通过调控斑马鱼BMP2 信号通路参与血管新生,关于此方面的分子机制仍有待研究。
综上所述,Lrrc15 基因在斑马鱼胚胎发育中主要参与调控尾静脉丛形成,该基因的缺陷可导致尾静脉丛发育异常,提示Lrrc15 基因在血管发育尤其是血管新生中的重要性。

