蒙药槟榔十三味丸(高尤-13)止痛作用网络药理学机制研究
徐秀娟,董 悦,刘苏槿,黄先菊,杨 桢,张小敏,崔竞文,佟海英*
(1.包头医学院 药学院,内蒙古 包头 014040;2.中南民族大学 药学院,湖北 武汉 430074;3.北京中医药大学 中医学院,北京 100029)
槟榔十三味丸(又名:高尤-13)为治疗命脉赫依病之首选方,由槟榔、肉豆蔻、广枣、当归、葶苈子、丁香、沉香、干姜、荜茇、胡椒、草乌(制)、木香、紫硇砂等13味药材组成,有调节赫依、安神止痛之效,用于心悸、失眠、精神失常、游走刺痛等症[1]。本团队前期研究发现,该方具有调节慢性应激抑郁模型大鼠行为学、单胺递质、HPA轴及cAMP-PKA-BDNF-CREB信号通路的作用,部分阐释了其调节赫依、安神的作用机制[2-5],但其发挥止痛作用的机制尚不明确。因此,本研究拟通过网络药理学方法对槟榔十三味丸的组成药物进行分析,从系统、整体的角度将药物与疾病相关联,预测其成分作用于此类疾病的成分靶点,进一步预测其潜在的止痛机制,并在细胞层面进行部分机制的验证。
1 方法
1.1 槟榔十三味丸成分靶点收集
通过中药系统药理学平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)、Pubmed (https://www.ncbi.nlm.nih.gov/pmc/)、中药综合数据库(TCMID,http://183.129.215.33/tcmid/)及相关文献报道补充,整合收集槟榔十三味丸复方中各味药材的化学成分。通过SwissTargetPrediction(http://www.swisstargetprediction.ch/)及Uniprot(https://www.uniprot.org/)在线数据库预测化学成分的作用靶点。
1.2 槟榔十三味丸治疗相关疼痛疾病靶点收集
分别在OMIM(https://omim.org/)、GeneCards(https://www.genecards.org/)及PHARMGKB(https://www.pharmgkb.org/)疾病数据库,以“Pain”“Depression pain”“Nerve pain”及“Inflammation pain”为关键词,整合收集疼痛、炎症疼痛、抑郁疼痛及神经疼痛的相关靶点。使用Cytoscape 3.6.1软件,分别对成分靶点与疾病靶点进行相交,得出其交集靶点,即复方治疗相关疼痛的靶点。
1.3 槟榔十三味丸止痛的蛋白相互作用(PPI)网络构建
登录STRING数据库(https://string-db.org/),输入各交集靶点,设置物种为“人类”,选取最高等置信度(0.9,其余参数保持默认),获取靶蛋白相互作用数据,构建PPI网络。
1.4 GO功能富集与KEGG通路富集分析
将所得成分与疾病共同的靶基因通过DAVID数据库(https://david.ncifcrf.gov/)进行基因本体论(Gene ontology,GO)功能注释与京都基因、基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,通过GO富集提取靶标基因或蛋白质的分子功能(Molecular function,MF)、细胞组分(Cellular component,CC),及其所参与的生物过程(Biological process,BP),通过这三类功能,对一个基因的功能进行多方面的限定和描述。通过KEGG通路(Pathway)富集靶点所涉及的信号通路,以P<0.05为条件进行靶基因筛选,分析槟榔十三味丸发挥止痛作用的主要信号通路及生物过程。利用Omicshare Tools平台,对GO富集与KEGG富集结果进行可视化。
1.5 膜片钳实验
1.5.1 药品与试剂 药品槟榔十三味丸(内蒙古蒙药股份有限公司采购,国药准字Z15020412)。HEK-293系细胞、辣椒素(Selleck,批号:S199002)、辣椒平(Selleck,批号:S813701)、肉桂醛(Solarbio,批号:924E021)、Ruthenium Red(Simga,批号:BCCB3092)、DMSO(Sigma-Aldrich,批号:BCCD7238)、EGTA(Sigma,批号:SLCB4238)、NaCl(Sigma,批号:SLCC5939)、KCl(Sigma,批号:SLBW2757)、EGTA(Sigma,批号:SLCB4238)、HEPES(Sigma,批号:A0720)、D-Glucose(Sigma,批号:SLBT7079)等。
1.5.2 实验仪器 研钵、超声仪(昆山市超声仪器有限公司,型号KQ2200DE)、离心机(长沙易达仪器有限公司,型号TDZ5M)、膜片钳放大器(HEKA Electronics,型号EPC10)、数据获取和分析软件(HEKA,型号PatchMaster & IGOR)、微电极拉制仪(Sutter Instruments,型号P97)等。
1.5.3 化合物制备 取槟榔十三味丸,将水丸研成粉末,称量出321.6 mg粉末加入50 mL细胞外液,震荡溶解,40 ℃超声后过滤,配制成10 mg/mL,目测待测样品的溶解性,至槟榔十三味丸全部溶解没有肉眼可见的沉淀。将50 mg辣椒素利用1 637.14 μL二甲基亚砜(DMSO)配制成100 mmol/L的储液,后用DMSO将储液稀释成为10 mmol/L的稀释液,最后用细胞外液将稀释液配成10 μmol/L的液体。将10 mg辣椒平利用263.47 μL DMSO配制成100 mmol/L的储液,后用DMSO将储液稀释成为10 mmol/L的稀释液,最后用细胞外液将稀释液配成10 μmol/L的液体。将20 mg肉桂醛用593.22 μL无水乙醇配制成250 mmol/L的储液,后用10 mL的细胞外液将供试品储液,配成250 μmol/L液体。将11.86 mg Ruthenium Red用502.74 μL超纯水配制成30 mmol/L的储液,用10 mL的细胞外液将供试品储液,配成100 μmol/L液体,后用10 mL的细胞外液将供试品储液,配成100 μmol/L液体。
1.5.4 细胞培养和传代 TRPV1、TRPA1稳定表达的HEK-293细胞系在含有10%胎牛血清及100 μg/mL Zeocin、10 μg/mL Blastincidin的Dulbecco’s Modified Eagle’s medium(DMEM)培养基中培养,培养温度为37 ℃,二氧化碳浓度为5%。传代时,除去旧培养基并用PBS洗一次,然后加入1 mL 0.25%-Trypsin-EDTA溶液,37 ℃ 孵育0.5 min左右。当细胞从皿底脱离,加入约5 mL 37 ℃预热的完全培养基。将细胞悬液用吸管轻轻吹打使聚集的细胞分离。将细胞悬液转移至无菌的离心管中,1 000 pm离心5 min收集细胞。扩增或维持培养,将细胞接种于6 cm细胞培养皿,每个细胞培养皿接种细胞量为2.5×105Cells(最终体积:5 mL)。细胞用0.25%-Trypsin-EDTA分离,将8×103或3×103细胞铺到盖玻片上,在24孔板中培养(最终体积:500 μL),并加入四环素诱导,18 h后,进行试验检测。
1.5.5 全细胞膜片钳实验 电生理试验在室温下进行,全细胞膜片钳记录全细胞TRPV1电流的电压刺激方案如下:当形成全细胞封接后细胞膜电压钳制于0 mV。记录电压由0 mV阶跃至-100 mV维持1 ms,然后给予300 ms Ramp刺激至100 mV。全细胞TRPA1电流的电压刺激方案如下:当形成全细胞封接后细胞膜电压钳制于-80 mV。记录电压由0 mV阶跃至-100 mV维持1 ms,然后给予300 ms Ramp刺激至100 mV。两种方案均每隔5 s重复采集数据,观察药物对TRPV1/TRPV1电流的作用。试验数据由EPC-10放大器(HEKA Electronics)进行采集并储存于PatchMaster(HEKA Electronics)软件中。
用微电极拉制仪将毛细玻璃管拉制成记录电极。在倒置显微镜下操纵微电极操纵仪将记录电极接触到细胞上,给予负压抽吸,形成GΩ封接。形成GΩ封接后进行快速电容补偿,然后继续给予负压,吸破细胞膜,形成全细胞记录模式。然后进行慢速电容的补偿并记录膜电容及串联电阻,不给予漏电补偿。
TRPV1所用的细胞外液为140 mmol/L NaCl,5 mmol/L KCl,2 mmol/L MgCl2·6H2O,2 mmol/L CaCl2·2H2O,5 mmol/L D-Glucose,10 mmol/L HEPES,NaOH调节pH=7.4。细胞内液为140 mmol/L CsCl,2 mmol/L MgCl2·6H2O,5 mmol/L CaCl2·2H2O,10 mmol/L EGTA,10 mmol/L HEPES,1 mmol/L Mg-ATP,CsOH调节pH=7.2。TRPA1所用的细胞外液为140 mmol/L CsCl,2 mmol/L MgCl2·6H2O,5 mmol/L CaCl2·2H2O,10 mmol/L EGTA,1 mmol/L Mg-ATP,10 mmol/L HEPES,CsOH调节pH=7.4。细胞内液为120 mmol/L CsCl,10 mmol/L EGTA,1 mmol/L MgCl2·6H2O, 10 mmol/L HEPES,0.3 mmol/L Na2-GTP,4 mmol/L Mg-ATP,CsOH调节pH=7.2。以上所有细胞外液保存时间为2周,细胞内液配好后分装为每管1 mL,冻存于-20 ℃冰箱。
2 结果
2.1 复方成分靶点收集
以口服生物利用度(Oral bioavailability,OB)>30%及药物相似度(Drug likeness,DL)>0.18为筛选条件,收集成分。整合所有成分预测靶点,删除重复成分及靶点,共得86个成分及920个靶点,其中,紫硇砂药材涉及的成分多为矿物质,各数据库尚未收录相关靶点,相关成分信息见表1。
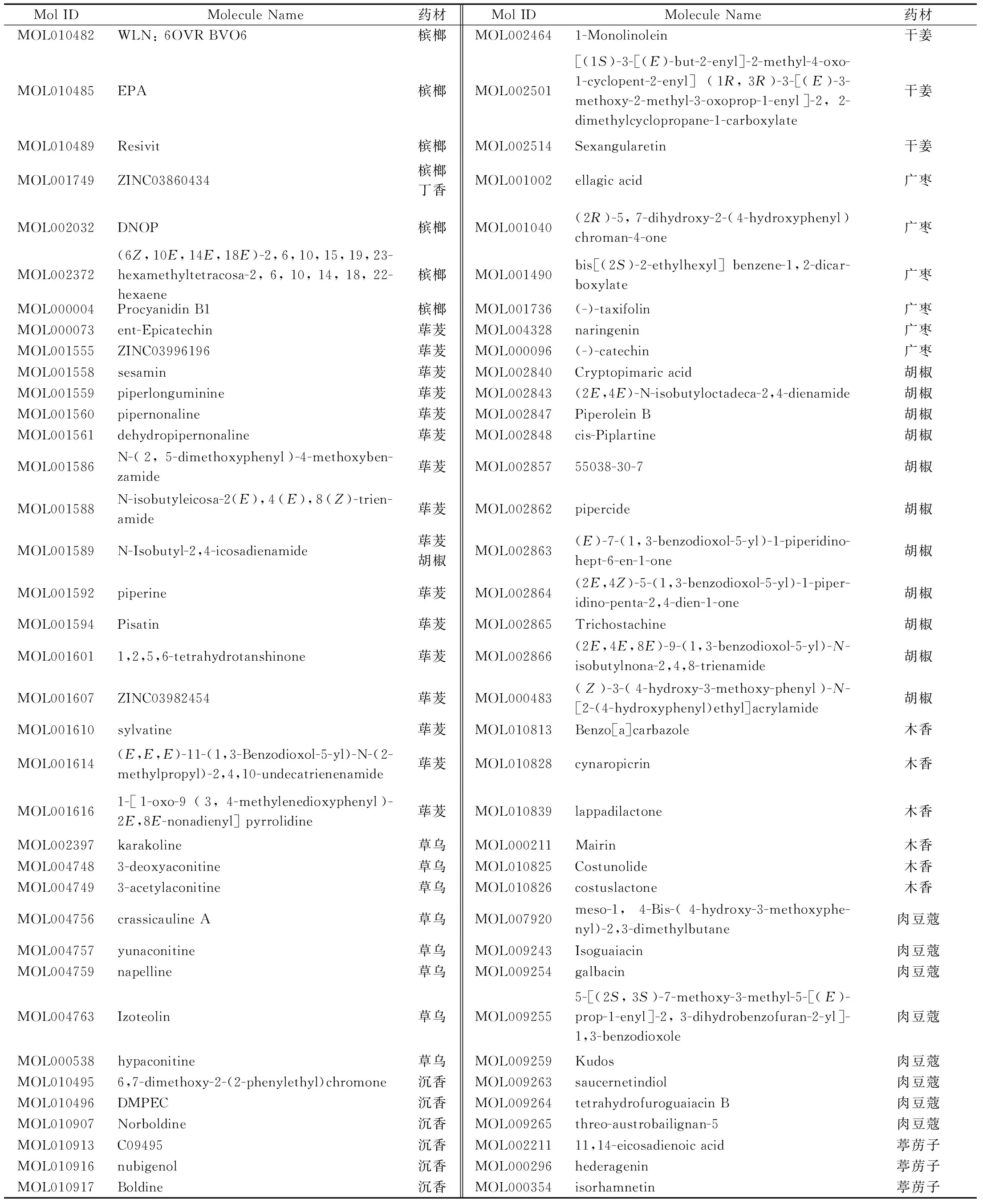
表1 复方成分信息
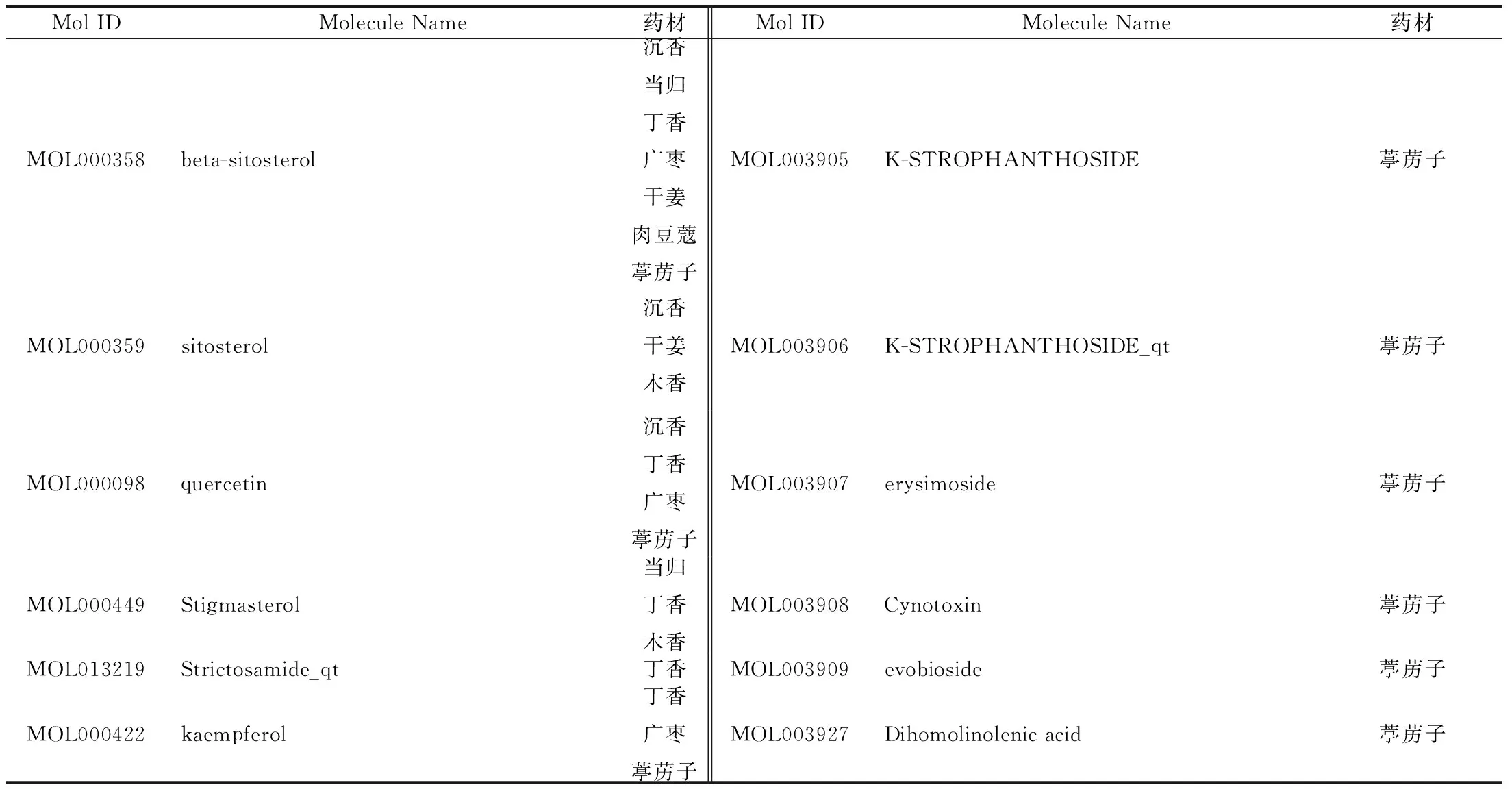
续表1
2.2 复方治疗相关疼痛疾病靶点
整合3个疾病数据库,删除重复靶点,共得疼痛靶点12 171个、炎症疼痛靶点7 497个、抑郁疼痛疾病靶点7 508个及神经疼痛靶点9 840个。将920个成分靶点与疾病靶点分别进行相交,得出805个复方治疗疼痛靶点、732个治疗炎症疼痛靶点、713个治疗抑郁疼痛靶点及793个治疗神经疼痛靶点。通过整理对比数据发现,治疗炎症/抑郁/神经疼痛的靶点均包含在复方治疗疼痛靶点中,相关信息如图1所示。同时,在治疗疾病的靶点中,发现多个与热敏通路相关的靶点:TRPA1、TRPV1、TRPV2、TRPV3、TRPV4、TRPM8[6]。对于这几种热敏通路靶点,通过整理得出了靶点主要分布的化学成分,并通过Cytoscape 3.6.1 软件构建“药材-成分-热敏”靶点,如图2。
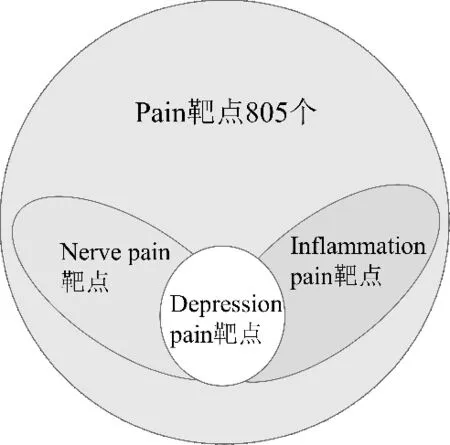
图1 疾病靶点相关性
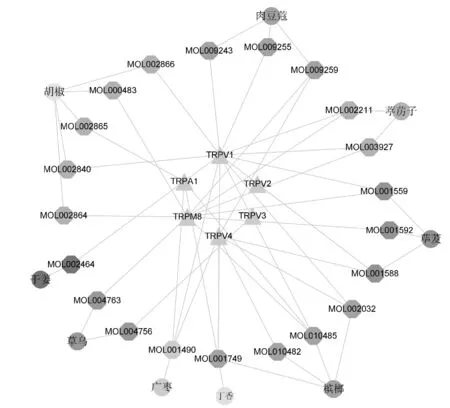
图2 “药材-成分-热敏”靶点
2.3 PPI网络构建
将交集靶点输入STRING数据库,分别得出本方治疗疼痛靶点的相互作用网络,如图3。
图3 复方止痛的PPI网络
2.4 富集分析
对“2.2”中的疼痛交集靶点分别进行GO富集与KEGG富集分析,其富集基本信息见表2。根据所含靶点量排序,选取排名前20个条目进行可视化,发现所占条目一致。故选取一种结果进行显示,结果如图4、图5。

表2 疾病富集信息
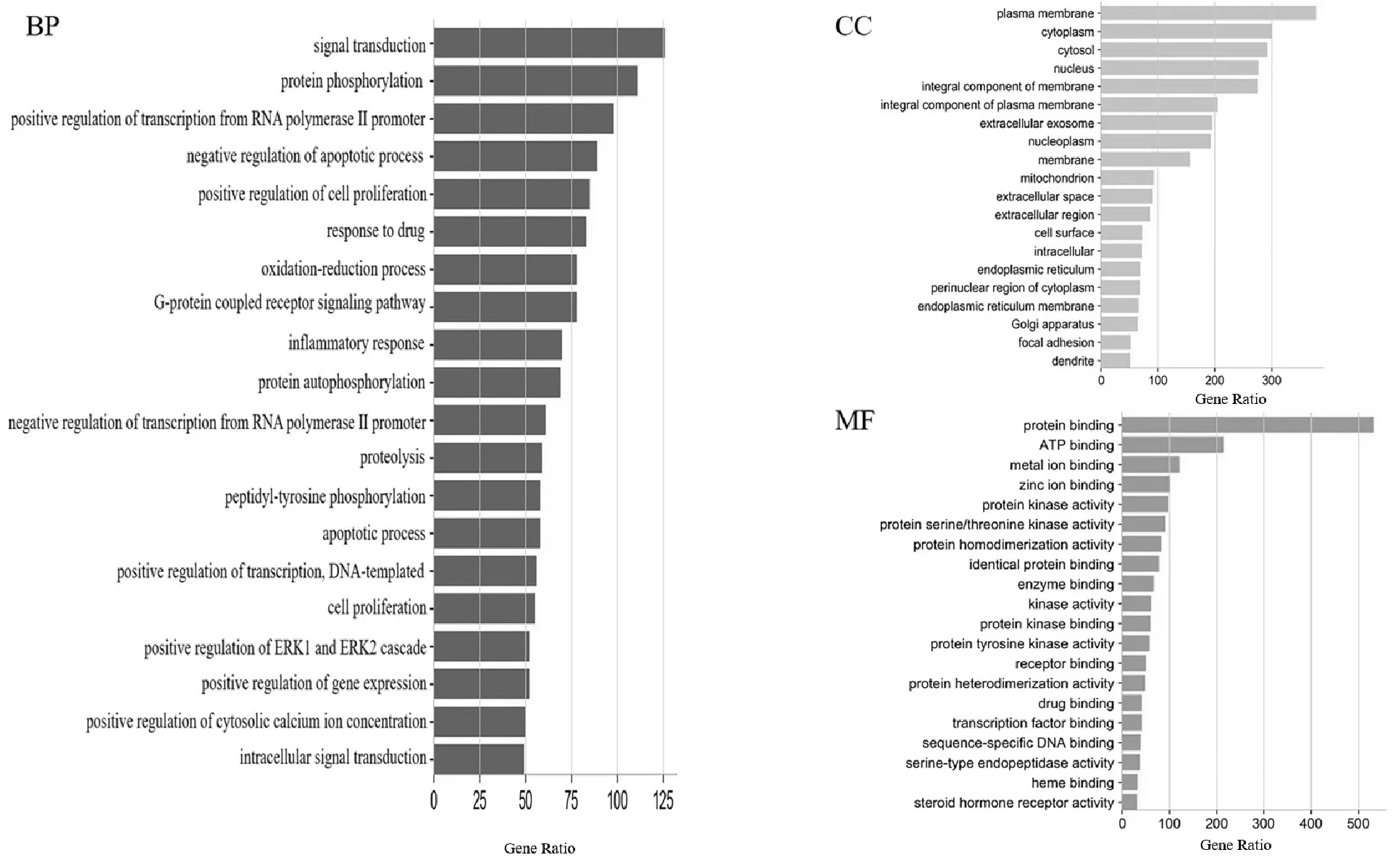
图4 GO功能富集分析
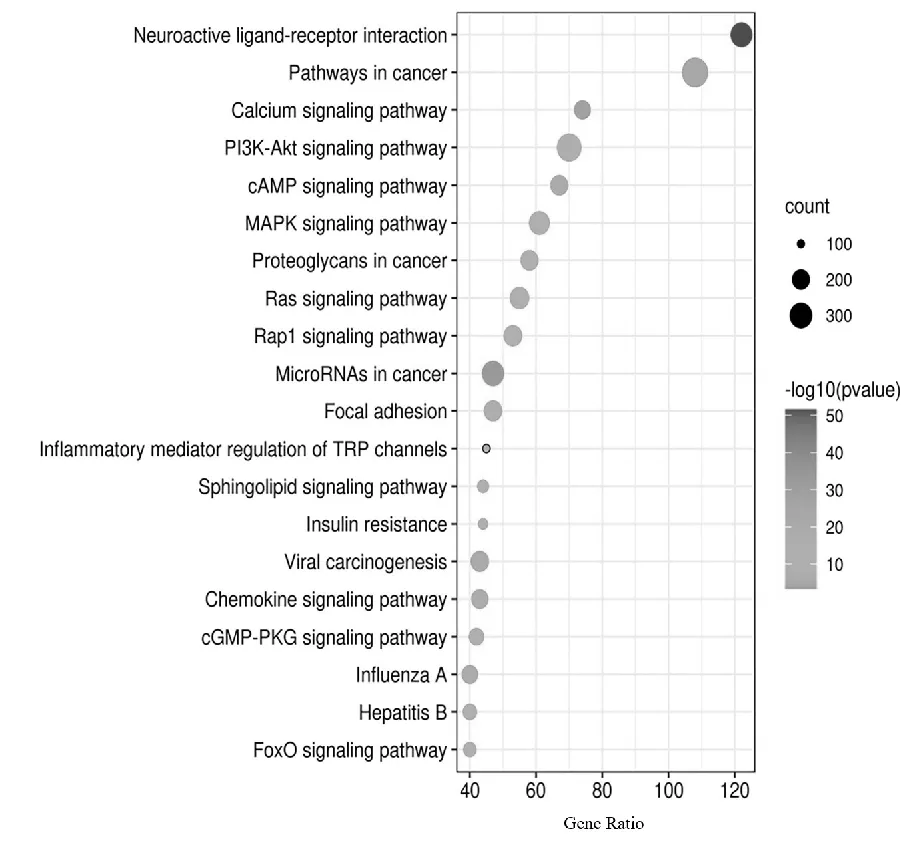
图5 KEGG通路富集分析
结果显示,在生物过程中生物调节与代谢过程相关性较高,主要涉及药物反应、RNA聚合酶II启动子转录的负调控、ERK1和ERK2级联阳性调节、基因表达的正调控、胞质钙离子浓度的正调控;在细胞组成中等离子体膜、细胞质、膜的积分分量、质膜、细胞表面、细胞内空间、内质网膜、黏着斑和树突所占比例较大;在分子功能中蛋白结合、ATP结合、金属离子结合、蛋白质同源二聚化、相同蛋白质结合和蛋白质激酶结合所占比例较大。而KEGG所富集的调控因子中涉及到对热敏通路的多环节影响,主要包括神经组织受体的刺激、炎症介质调控以及通路信号的调节等方面。
3 槟榔十三味丸水提物对热敏通道TRPV1/TRPVA1的影响
在膜片钳上测试槟榔十三味丸水提取物(10 mg/mL)对稳定表达TRPV1的HEK293细胞跨膜电流的影响,细胞外液为阴性对照,10 μmol/L辣椒素作为阳性对照。实验时先加细胞外液,观察电流的基线水平,稳定后滴加槟榔十三味丸水提物观察电流变化,最后滴加10 μmol/L辣椒素对比其诱导的跨膜电流,见图6。实验结果显示,与细胞外液相比,槟榔十三味丸水提取物能够诱导转染TRPV1的HEK293细胞产生明显的跨膜电流,而TRPV1的竞争性拮抗剂辣椒平(10 mmol/L)可完全抑制该电流。
在膜片钳上测试槟榔十三味丸水提取物(10 mg/mL)对稳定表达TRPA1的HEK293细胞跨膜电流的影响,细胞外液为阴性对照,250 μmol/L肉桂醛为阳性对照。实验时先加细胞外液,观察电流的基线水平,稳定后滴加槟榔十三味丸水提物观察电流变化,最后滴加肉桂醛见图7。实验结果显示,与细胞外液相比,槟榔十三味丸水提取物能够诱导转染了TRPA1的HEK293细胞产生明显的跨膜电流,而TRPA1的竞争性拮抗剂Ruthenium Red可完全抑制该电流。

注:A:细胞外液,B:槟榔十三味丸水提取物10 mg/mL,C:辣椒素10 μmol/L,D:辣椒平10 μmol/L。
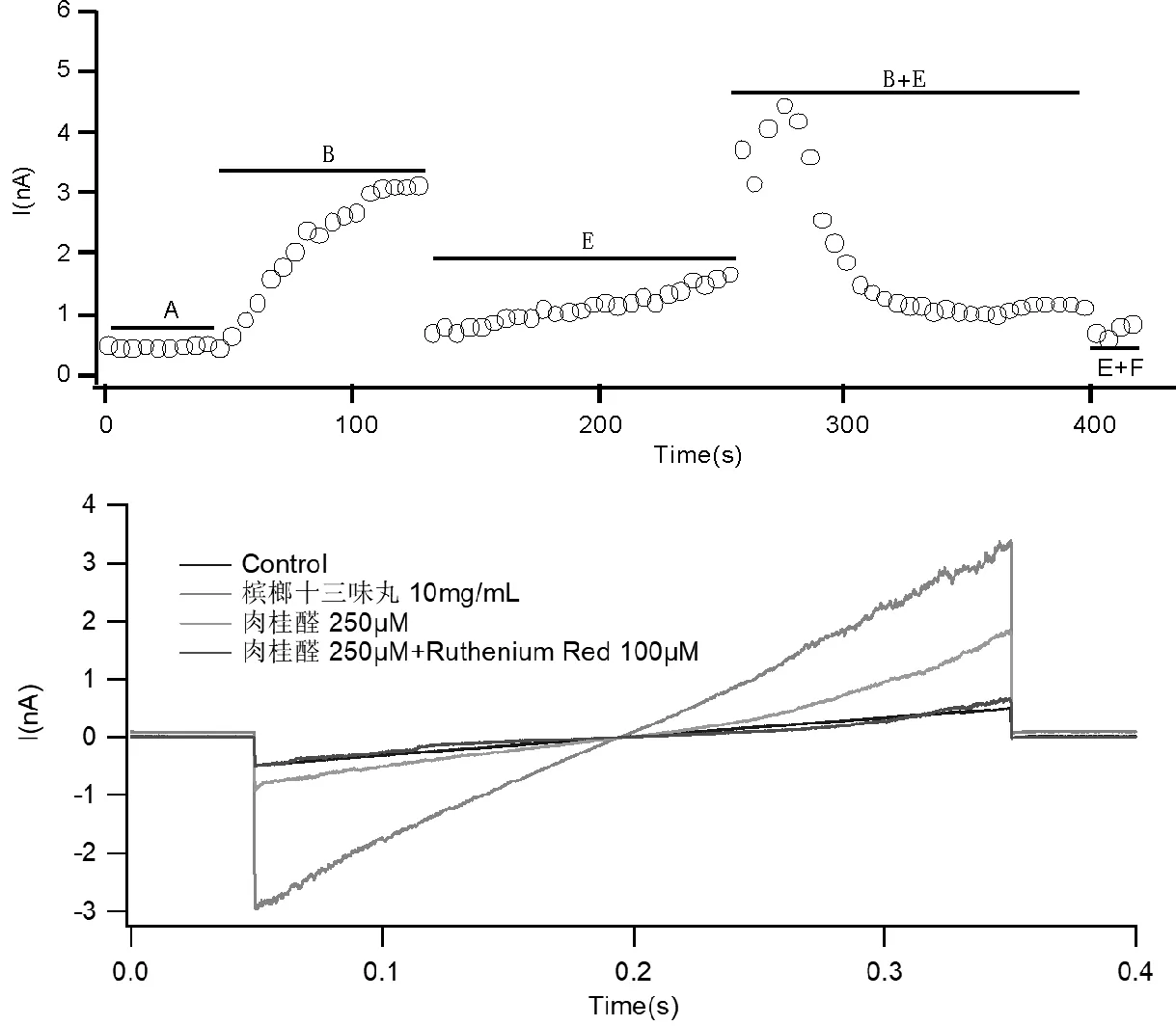
注:A:细胞外液,B:槟榔十三味丸水提取物10 mg/mL,E:肉桂醛250 μmol/L,F:Ruthenium Red 100 μmol/L。
对槟榔十三味丸进行的全细胞膜片钳实验显示,其水提取物在体外细胞模型上可以激活TRPA1/TRPV1。
4 讨论
本研究应用网络药理学的技术与方法,探究槟榔十三味丸发挥止痛作用的化学成分、活性靶点以及作用通路。研究共从槟榔十三味丸的13味药材中筛选出86个化学成分及920个靶点,复方治疗疼痛靶点805个,包含732个治疗炎症疼痛靶点、713个治疗抑郁疼痛靶点及793个治疗神经疼痛靶点。同时发现筛选出的86个化学成分中与热敏通道(TRPA1、TRPV1、TRPV2、TRPV3、TRPV4、TRPM8)相关的化合物共21个。其中二十碳五烯酸(EPA)、酞酸双(2-乙基己基)酯能够同时作用于TRPA1、TRPV1、TRPV4通道。荜茇宁(Piperlonguminine)和N-异丁基十八碳-2,4,8-三烯酰胺(N-isobutyleicosa-2(E),4(E),8(Z)-trienamide)能同时激活TRPV1、TRPV2及TRPV4通道。11,14-二十碳二烯酸(11,14-eicosadienoic acid)、11,14,17-二十碳三烯酸(11,14,17-Eicosatrienoic acid)能够激活TRPV1、TRPM8通道。
现代药理研究表明,槟榔十三味丸的多种化学成分具有抗炎、止痛的药理活性。二十碳五烯酸具有抗炎[7]、抗氧化、调解血脂[8]、保护心血管[9]的作用,在慢性疼痛与抑郁共病的小鼠模型中,能显著增加抗炎细胞因子表达,调节小鼠内侧前额叶皮层、海马、中脑导水管周围灰质、杏仁核中的TRPV1、pERK和pNKκB等免疫反应信号活性,发挥治疗痛觉过敏和抑郁行为的作用[10]。荜茇宁和N-异丁基十八碳-2,4,8-三烯酰胺是荜茇酰胺类化合物,荜茇宁具有保护心脏缺血性损伤、保护神经[11-12]、抗炎[13]、抗肿瘤[14]、调节血脂、镇痛[15]等药理作用,可抑制脂多糖诱导肿瘤坏死因子-α(TNF-α)或白细胞介素-6(IL-6)的产生,抑制核因子-jB(NF-jB)或细胞外调节激酶(ERK) 1/2的激活[16]。11,14-二十碳二烯酸是omega-6多不饱和脂肪酸类化合物,与PKC-ε的活化相关,能够下调iNOS的表达,显著降低脂多糖诱导的NO水平,发挥抗炎作用[17]。11,14,17-顺-二十碳三烯酸甲酯,研究表明可以抑制人星形细胞瘤D384匀浆中SNP刺激鸟苷酸环化酶,阻碍cGMP形成[18]。
对交集靶点PPI网络进行网络拓朴学分析,显示从槟榔十三味丸的13味药材中筛选出的多个炎症疼痛、抑郁疼痛及神经疼痛的靶点,与热敏通道(TRPA1、TRPV1、TRPV2、TRPV3、TRPV4、TRPM8)有关。因此,为进一步探究槟榔十三味丸对热敏通道作用,本课题组在HEK29细胞[19]上,运用全细胞膜片钳技术探究槟榔十三味丸水提物对转染TRPV1/TRPA1的影响。结果发现槟榔十三味丸水提取物能够激活TRPA1和TRPV1通道。提示槟榔十三味丸发挥止痛、抗炎作用的分子机制可能与活化热敏通道TRPV1/TRPA1有关。
近年来热敏通路属于瞬时受体电位(TRPs)[20]得到重视,被认为是下一代镇痛药的潜在靶点。既能感受特定的温度刺激,又是伤害性感受器,还是机械刺激和渗透压感受器,外周感觉神经的多重信号在此汇聚,是调控外周神经疼痛的关键[21-22]。TRPV1、TRPA1作为细胞传感器,两者在背根神经节和三叉神经节的神经元中共同表达,在传递有害刺激以及神经源性炎症和痛觉过敏的产生中发挥关键作用[23]。以TRPV1为例,酸(pH<5.0)、辣椒素、温度>43 ℃等均能够激活,产生酸、热、灼、痛的混合感觉[24-26]。当TRPV1、TRPA1通道被激活,细胞中游离的钙离子浓度增高[27],诱导痛觉过敏中枢敏化过程中起关键作用的细胞外信号调节蛋白激酶1/2(ERK1/2)快速磷酸化进而活化[28-29]。同时,Ca2+内流导致神经肽和炎性介质的释放及表达,如SP、CGRP、ATP等,他们可诱导或增强外周炎性反应及免疫反应,进而产生超敏和痛觉过敏等临床症状,而对TRPV1、TRPA1持续活化之后的脱敏发挥了止痛效果[30-32]。
综上所述,本研究基于网络药理学分析法[33]与体外验证得出,激活TRPs通路是蒙药槟榔十三味丸抗炎止痛的关键。这为蒙医临床治疗赫依类相关疾病提供了现代用药依据,亦为蒙药单味药药效及经典制剂(如安神补心六味丸治疗冠心病机制)的研究提供研究思路,但槟榔十三味丸调节TRPs热敏通路的细节尚待阐明。

