基于外观特征量化结合内在质量指标的玄参药材综合质量评价
梁丽金,邱彩月,邓怡芳,徐 杰,钟文峰,孙冬梅,黄 瑶,莫秋怡
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东 佛山 528244)
玄参为玄参科植物玄参ScrophularianingpoensisHemsl的干燥根,是著名的“浙八味”之一,主要分布于浙江、湖北、湖南、安徽、四川、云南等地,其中浙江为玄参的道地产区[1]。玄参产地加工过程中涉及反复干燥、堆积发汗等复杂工序,与其疗效及颜色有关的环烯醚萜苷类成分(桃叶珊瑚苷等)的含量受产地加工的影响较大,因而导致市场上流通的玄参药材良莠不齐、质量不均,影响临床用药的安全性和有效性[2-3]。目前,对于玄参药材质量的划分,多以传统外观性状(如粗细、大小、断面颜色等)鉴别或化学成分含量(哈巴苷、哈巴俄苷等)等指标作为评判标准[4-6]。基于中医用药整体性和玄参成分复杂性的特点,仅靠单一类型指标评价并不能全面客观评价中药质量,此外对性状相似玄参药材质量也难以准确评价。因此,有必要建立一种科学、合理的实现多种不同类型指标的综合质量评价方法,以规范市场玄参药材的质量控制。灰色关联度法、逼近理想解排序法(TOPSIS法)均可以将多维问题转化为一维问题,降低不同类型指标对决策的干扰,实现多指标综合决策分析,评价结果更为客观、合理,近年来在中药材质量评价领域应用广泛[7-10]。本研究拟采用MatLab图像处理技术对玄参大小、颜色等外观性状进行量化,以性状量化值及特征图谱作为评价指标,并采用灰色关联度法和熵权TOPSIS法对不同批次玄参药材进行综合评价,判断不同批次玄参药材质量情况,为玄参药材质量评价与控制提供参考。
1 仪器与材料
1.1 仪器
Thermo Vanquish型超高效液相色谱仪(美国Thermo公司);MiliQ Direct 8型超纯水机(默克密理博公司);ME204E型万分之一天平(Mettler Toledo公司);KQ-500DE型数控超声清洗器(昆山市超声仪器有限公司);111B型二两装高速中药粉碎机(浙江瑞安市永历制药机械有限公司)。
1.2 材料
哈巴苷(批号:111729-201707,纯度96.8%)、毛蕊花糖苷(批号:111530-201914,纯度95.2%)、哈巴俄苷(批号:111730-201508,纯度96.0%)、桃叶珊瑚苷(批号:111761-200601,纯度100%)、肉桂酸(批号:1110786-201604,纯度98.8%)对照品均购自中国食品药品检定研究院;色谱纯磷酸(天津市科密欧化学试剂有限公司),色谱纯乙腈(默克公司),水为超纯水,其他试剂均为分析纯。11批玄参药材经广东一方制药有限公司魏梅主任药师鉴定为玄参科植物玄参ScrophularianingpoensisHemsl的干燥根。来源信息见表1。

表1 玄参样品来源信息
2 方法与结果
2.1 特征图谱建立
2.1.1 供试品溶液的制备 取样品粉末(过三号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入25 mL50%甲醇,称重,超声处理(功率300 W,频率45 kHz)30 min,冷却补重,摇匀,滤过,取续滤液,即得。
2.1.2 对照品溶液制备 取桃叶珊瑚苷、毛蕊花糖苷、哈巴苷、哈巴俄苷、肉桂酸对照品适量,精密称定,加50%甲醇制成每1 mL含桃叶珊瑚苷20 μg、毛蕊花糖苷20 μg、哈巴苷60 μg、哈巴俄苷60 μg、肉桂酸20 μg的溶液,作为混合对照品参照物溶液。
2.1.3 色谱条件 采用YMC Triart C18(2.1 mm×100 mm,1.9 μm)色谱柱;以乙腈(A)-0.1%磷酸溶液(B)为流动相,梯度洗脱(0~5 min,0%~10% A;5~7 min;10%~20% A;7~9 min,20%~33% A;9~12 min,33% A;12~16 min,33%~60% A;16~24 min;60%~95% A;柱温30 ℃;检测波长:0~13.5 min为210 nm,13.5 min后改为278 nm;流速0.3 mL/min,进样量1 μL。
2.1.4 方法学考察 (1)精密度考察。取玄参样品,按“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件,连续进样6次,以哈巴俄苷色谱峰为参照峰(S),计算得到各特征峰的相对保留时间与相对峰面积的RSD值均小于3%,表明仪器精密度良好。
(2)重复性考察。取玄参样品,按“2.1.1”项下方法制备供试品溶液,平行6份,按“2.1.3”项下色谱条件进样测定,以哈巴俄苷色谱峰为参照峰(S),计算得到各特征峰的相对保留时间与相对峰面积的RSD值均小于3%,表明该方法重复性良好。
(3)稳定性考察。取玄参样品,按“2.1.1”项下色谱条件,分别在样品制备后的0、3、7、12、18、24 h进样检测,以哈巴俄苷色谱峰为参照峰(S),计算得到各特征峰的相对保留时间与相对峰面积的RSD均小于3%,表明供试品溶液在24 h内稳定性良好。
2.1.5 特征图谱建立及共有峰确定 取11批玄参样品,按照“2.1.1”项下方法制备供试品溶液,按照“2.1.3”项下色谱条件进行测定,记录各特征峰的峰面积,并进行峰面积的归一化处理,结果见表2。将各批次玄参特征图谱数据导入“中药色谱指纹图谱相似度评价系统(2012版)”软件进行处理,建立玄参对照特征图谱,计算相似度结果见图1和表3,发现不同批次样品相似度均较高。11批玄参与对照指纹图谱的相似度均大于0.90,表明建立特征图谱检测方法适应性良好,符合研究要求。建立特征图谱标定11个共有峰,通过对照品比对,对桃叶珊瑚苷、哈巴苷、毛蕊花糖苷、哈巴俄苷、肉桂酸色谱峰进行指认,结果见图2。

表2 各批次的特征图谱共有峰的峰面积归一化处理结果

表3 相似度评价
2.2 外观图像采集与药材大小、颜色特征提取
每批药材随机抽取各11根,置白色纸上,相机与药材保持15 cm距离,采集图像。采用MatLab软件自带函数gb2gray、im2bw、bwlabel、regionprops等将药材图像转化成二值图像,提取并计算直径、长短轴比、矩形度等形状参数,并称定每根玄参的质量。对预处理后玄参药材图像提取R(红色)、G(绿色)、B(蓝色)的均值,并将药材图像分别转至HSV空间、Lab空间,提取H(色调)、S(饱和度)、V(亮度)、L*(明亮度)、a*(红色到绿色范围中位置)、b*(黄色到蓝色范围中位置)的均值。采用SPSS 20软件对数据进行Kruskal -Wallis法检验,结果见表4、5。结果显示S1~S6批次的玄参在外观性状特征和外部颜色色度值(H、V、L*、a*、b*、R、G、B)指标上两两之间均没有差异,而只有S4、S5、S6、S7、S8、S9、S10、S11批次样品主要分别在直径、矩形度、圆形度、质量、色度值(H、S、V、L*、a*、b*、R、G、B)等单个或多个指标上与某些批次之间存在差异。

图1 11批玄参UPLC特征图谱

注:5:桃叶珊瑚苷;6:哈巴苷;7:毛蕊花糖苷;10:哈巴俄苷;11:肉桂酸。

表4 各批次玄参的外观性状特征测定结果

表5 各批次玄参的外部颜色色度值测定结果
2.3 熵权TOPSIS法分析
2.3.1 建立标准化决策矩阵 根据公式(1),对原始数据进行高优同向化处理,建立标准化决策矩阵,并进行数据归一化处理,其中m代表样品,n代表指标,xij代表测量值。
(1)
2.3.2 各指标成分权重确定 根据公式(2)和(3)计算各指标的熵值和权重。得到熵值Ej=(0.903 1、0.887 3、0.925 4、0.869 0、0.914 7、0.907 3、0.926 4、0.928 3、0.939 2、0.931 3、0.921 4、0.903 5、0.863 5、0.858 0、0.826 2、0.902 7、0.848 5、0.840 0、0.829 1、0.925 1、0.920 9、0.911 8、0.920 7、0.923 1、0.942 9、0.885 5);权重wj=(0.036 6、0.042 6、0.028 2、0.049 5、0.032 3、0.035 0、0.027 8、0.027 1、0.023 0、0.026 0、0.029 7、0.036 5、0.051 6、0.053 7、0.065 7、0.0368、0.057 3、0.060 5、0.064 6、0.028 3、0.029 9、0.033 4、0.030 0、0.029 1、0.021 6、0.043 3)。

(2)
(3)

Z=(Rij×wj)m×n
(4)
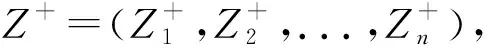
(5)

(6)
2.3.4 贴近度计算及评价 根据公式(7),分别计算各评价对象与最优向量Z+和最劣向量Z-的距离D,根据公式(8),计算各评价对象与最优方案的接近程度Ci,并进行排序,Ci越大表明越接近最佳方案。11批玄参质量评价排序结果见表6。熵权TOPSIS排序:S3>S4>S1>S11>S9>S6>S2>S5>S8>S7>S10。11批玄参综合质量排名前3的为S1、S3、S4,说明S1、S3、S4的综合质量较优;排名倒数3的为S7、S8、S10,说明S7、S8、S10的综合质量较劣。同时,S1、S7的产地均为浙江,但S7的综合质量排名为第10,说明相同产地的玄参综合质量也存在较大的差异。
(7)
(8)

表6 熵权TOPSIS质量评价排序
2.4 灰色关联度法分析
以各指标最大值建立理想参照材料;采用每列原始数据/列项均值进行无量纲化处理;计算均值化后各指标分别与对应的理想参照材料各指标的绝对差;并根据公式(9)计算关联系数。关联系数反映了待评指标与该指标理想值的吻合程度。关联系数越大说明越接近该指标的理想值。其中i为待评样本数(i= 0,1,2,…,m;m=11),k为评价指标数(k= 0,1,2,…,n;n=26)。
(9)
根据公式(10)计算关联度,并进行归一化处理得各指标权重。得r(k)=(0.849 4、0.987 7、0.853 1、0.946 1、0.946 2、0.880 0、0.870 3、0.854 4、0.906 8、0.901 2、0.864 7、0.822 7、0.809 6、0.748 1、0.600 3、0.635 2、0.506 3、0.598 4、0.546 8、0.586 6、0.574 2、0.839 7、0.748 9、0.711 2、0.818 4、0.636 1);ω(k)=(0.042 4、0.049 3、0.042 6、0.047 2、0.047 2、0.043 9、0.043 4、0.042 6、0.045 2、0.045 0、0.043 1、0.041 0、0.040 4、0.037 3、0.029 9、0.031 7、0.025 3、0.029 9、0.027 3、0.029 3、0.028 6、0.041 9、0.037 4、0.035 5、0.040 8、0.031 7)。
(10)
根据公式(11)计算灰色关联度,并进行排序。结果见表7。灰色关联度法综合排序:S4>S1>S3>S9>S6>S11>S5>S2>S8>S7>S10;11批玄参综合质量排名前3的为S1、S3、S4,说明S1、S3、S4的综合质量较优;排名倒数3的为S7、S8、S10,说明S7、S8、S10的综合质量较劣。这与熵权TOPSIS法分析结果一致。
(11)

表7 灰色关联度法质量评价排序
3 讨论
本研究采用灰色关联度法和熵权TOPSIS法构建玄参两种质量综合评价模型,11批玄参药材质量评价最优的均为S1、S3、S4,最劣的均为S7、S8、S10。采用灰色关联度法与熵权TOPSIS法对11批玄参药材进行综合质量评价的排序结果基本一致,说明构建的灰色关联度和熵权TOPSIS模型可以相互印证,可用于玄参药材的综合质量评价。古籍文献均以浙江的玄参质量为最佳,本研究S1和S7均产自道地产区浙江,但综合质量差别较大。由此可见,仅以传统的眼观、口尝、鼻闻等鉴别手段或唯化学成分论评价,难以很好地区分玄参质量的优劣。
本研究建立玄参UPLC特征图谱,与现有文献报道的方法相比,制样方法简便、分析速度较快、分离效果较佳。共标定11个特征峰,并对桃叶珊瑚苷、哈巴苷、哈巴俄苷、毛蕊花糖苷、肉桂酸色谱峰进行了指认。其中桃叶珊瑚苷是玄参主要药效成分,具有抗病毒、抗炎的药理作用[11];同时桃叶珊瑚苷为环烯醚萜苷类成分,在玄参加工炮制过程中,其结构的改变与玄参药材颜色加深直接相关[12]。此外,哈巴苷、哈巴俄苷是《中国药典》2020年版一部玄参含量测定项下的质量控制指标[13]。由此可知,本研究建立的UPLC特征图谱所表征的化学成分,作为玄参内在质量指标具有显著代表性。
目前,中药质量评价模式主要有传统经验评价、单一指标或多指标成分评价、指纹图谱或者特征图谱评价等。本文在继承传统鉴定基础上对外观性状大小和颜色进行定量表征,解决了传统经验存在主观性强的问题,并结合能反映中药材整体化学成分的特征图谱作为评价指标,通过灰色关联度法和熵权TOPSIS法进行质量综合评价,可以解决中药质量评价时多指标评价标准不统一的问题和排除主观赋权对结果的影响,从而更加全面地从外在性状到内在质量层面上客观反映玄参质量,这与中药多指标质量综合评价思路相吻合。本方法分析科学、合理、可靠,可为玄参的质量评价及全面质量控制提供参考。

