蒙药古日古木-13对CCl4诱导的大鼠肝纤维化的改善作用及其机制研究
道力格玛,邓乌力吉,萨础拉,萨日呼,陈圆圆,宝特力格尔,包套格申
(1.内蒙古医科大学,内蒙古 呼和浩特 010110;2.内蒙古医科大学附属人民医院,内蒙古 呼和浩特010020)
肝纤维化 (Hepatic fibrosis,HF)是以细胞外基质(Extracellular matrix,ECM)过度堆积和结蹄组织异常增生为主要特征的肝脏病理过程[1],通常由慢性炎症损伤愈合反应引起。如果治疗不及时,肝纤维化的持续发展将诱使肝硬化,最终导致肝功能衰竭甚至死亡,故应注重抗肝纤维化的治疗。研究发现肝纤维化过程具有可逆性,在早期阶段进行有效治疗对防止肝病发展至关重要[2]。近年来很多学者致力于天然药物抗肝纤维化的研究,发现中医药在肝纤维化的治疗中具有多途径、多靶向、多层次的治疗优势[3]。
蒙药古日古木-13始载于蒙医《四部医典》,是蒙医临床治疗肝病的经典药方[4],由红花、麦冬、木香、丁香、莲子、诃子、川楝子、栀子、紫檀香、麝香、人工牛黄、人工水牛角浓缩粉、银朱等13味蒙药组成。以红花为主药,具有清肝热、解毒、杀黏作用,主治肝功衰退、腰肾损伤及眼病。郭跃东等[5]发现古日古木-13对酒精性肝损伤大鼠Bax蛋白的表达有抑制作用,而增强Bcl-2蛋白表达,可减少肝细胞凋亡,从而抑制酒精性肝损伤大鼠的肝纤维化。叶超凡等[6]发现古日古木-13能明显减轻CCl4所致肝损伤小鼠的肝组织坏死浸润灶、肝细胞变性、坏死及炎细胞浸润等病变,促进肝脏组织ALR蛋白表达,进而维持肝细胞膜的稳定性。但现有文献关于古日古木-13对肝纤维化的重要因子TGF-β1和α-SMA的作用机制的研究较少。本实验拟复制CCl4诱导的大鼠肝纤维化模型,通过观察蒙药古日古木-13对肝纤维化的改善作用,探究其潜在作用机制。
1 实验动物及材料
1.1 实验动物
SD雄性大鼠60只,体质量(180±20)g,购自北京海淀区兴隆实验动物养殖厂(合格证编号:SCXK(京)2019-00010)。实验大鼠在温度(20±2)℃、湿度(55±5)℃、12 h明暗循环环境的条件下,适应性喂养1周。
1.2 仪器
RM2235病理切片机(德国徕卡);MULTISKAN MK3全自动多功能酶标仪(塞默飞世尔科技公司);AU480全自动生化仪(美国贝克曼库尔特有限公司);JY300C电泳仪(北京君意东方电泳设备有限公司);StepOne Plus实时定量PCR仪(美国应用生物系统公司)。
1.3 药材与试剂
古日古木-13(批号:2005007)购自内蒙古蒙药股份有限公司,秋水仙碱(批号:CC30152550)购自武汉丰泰威远科技有限公司;四氯化碳(批号:20180218)天津永晟精细化工有限公司;ALT、AST试剂盒,英科新创(厦门)科技有限公司;HA试剂盒(批号:CGEKR91LVA)、LN试剂盒(批号:8C2MD5XJHJ)、PⅢNP试剂盒(批号:TKDCTVDZVV),武汉华美生物工程有限公司;qPCR试剂盒(批号:KK4601),默瑞(上海)生物科技有限公司;兔抗大鼠α-sma多克隆抗体(批号:bs-10196R),北京博奥森生物技术有限公司。
2 方法
2.1 分组与造模
将60只雄性SD大鼠随机分为空白对照组,模型对照组,阳性对照组和古日古木-13低、中、高剂量组,每组10只。除空白对照组给予生理盐水外,其他各组腹腔注射60%CCl4橄榄油溶液,2 mL/kg,每周2次,共 7周。
2.2 给药
自第4周起,在继续造模的同时,古日古木-13低、中、高剂量组大鼠分别给予128 mg/kg、256 mg/kg和512 mg/kg剂量药物灌胃,药物浓度及等效剂量通过体表面积折算。阳性组大鼠以秋水仙碱0.2 mg/kg为剂量灌胃给药[7]。空白组和模型组根据大鼠体质量灌胃相同剂量的生理盐水,各组大鼠灌胃量为10 mL/kg,1次/d,持续4 周。末次给药后,禁食过夜,次日采血并收集肝脏组织。
2.3 检测指标与方法
2.3.1 检测肝功能及纤维化指标 末次给药后禁食12 h,腹腔注射10%水合氯醛予以麻醉,腹主动脉取血,血液以3 000 r·min-1、15 min离心,分离血清,置于-80 ℃冰箱保存以备检测;依照试剂盒说明书的操作方法,采用生化检测法测定血清 ALT和AST水平,ELISA法检测血清HA、LN和PⅢNP表达。
2.3.2 组织病理学检查 采用10%中性福尔马林固定肝脏组织,经乙醇脱水及石蜡包埋等步骤后,采用常规方法进行HE染色,封片,生物显微镜下观察肝组织病理变化。
2.3.3 实时荧光定量PCR检测 切取大鼠同一部位肝组织,置于冷凝管迅速放入液氮速冻,待充分冷冻后储存于-80 ℃冰箱。PCR反应采用2×SYBR Master Mix Universal 10 μL反应体系,总体积:20 μL,Forward Primer 1.5 μL(10 μm),Reverse Primer 1.5 μL(10 μm),template 3 μL,ROX校正染料0.5 μL,H2O 补齐至20 μL,用 SYBR PCR Mixture进行扩增,95 ℃ 10 min、95 ℃ 10 s、59 ℃ 60 s、95 ℃ 15 s、72 ℃ 15 s、95 ℃ 15 s。引物序列,见表1。
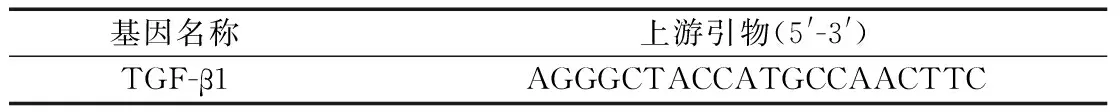
表1 PCR引物序列
2.3.4 免疫组化检测 大鼠肝组织常规包埋切片,置于 EDTA8.0修复液中,微波炉内修复,冲洗后室温下放入3%双氧水孵育30 min,PBS冲洗3次,滴加牛血清白蛋白V工作液孵育30 min,滴加一抗(α-SMA 1∶500)4 ℃孵育过夜,PBS冲洗3次,滴加相应二抗,PBS冲洗3次,DAB染色,蒸馏水充分冲洗后,苏木素复染,用梯度乙醇脱水,二甲苯透明,采用中性树胶封片。采用Image-Pro Plus 6.0图像分析软件,分析每个组织片上α-SMA平均光密度值,并在200倍下拍照观察,再进行定性分析。
2.4 数据处理
3 结果与分析
3.1 大鼠行为学特征及组织变化
实验期间,空白组大鼠情况良好,各造模组自造模第2周起出现毛色发黄、失光泽,精神状态差,甚至出现腹水等变化。给药期间阳性组,古日古木-13各剂量组大鼠毛色、活跃度等情况有所改善。采集肝脏组织样本时观察到空白组大鼠肝脏组织与其他各组有明显区别,主要体现在颜色鲜红、表面光滑细腻、无结节、质嫩、边缘锐利。模型组大鼠肝脏颜色呈褐色,表层粗糙欠光滑,质硬,肝脏边缘钝厚,部分肝脏有花斑样改变,肝叶体积增大,个别大鼠肝脏颗粒样变化严重,甚至肝脏分叶不明显;给药组肝组织与模型组相比,变化不大。
3.2 对肝功能指标的影响
与空白组比较,模型组血清ALT、AST水平显著提高(P<0.05)。与模型组比较,阳性组相较古日古木-13各剂量组,ALT、AST水平有降低趋势,但不明显。见图1。
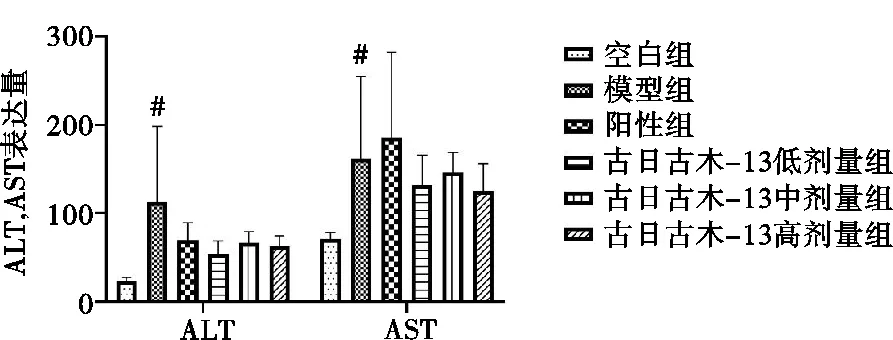
注:与空白组比较,#P<0.05。
3.3 对肝纤维化指标的影响
与空白组比较,模型组大鼠血清HA、LN、PⅢNP水平显著升高(P<0.01);与模型组比较,阳性组较古日古木-13低、高剂量组,血清HA含量显著降低(P<0.01);阳性组较古日古木-13低、中剂量组,大鼠血清LN含量显著降低(P<0.05);阳性组、古日古木-13各剂量组大鼠血清中PⅢNP含量显著降低(P<0.05)。见图2。

注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。
3.4 对大鼠肝脏组织形态的影响
HE染色镜下观察,空白组肝组织具有完整的肝小叶结构,中央静脉清晰,肝索呈放射状,中央静脉周围未见坏死、炎症或纤维化迹象。模型组大鼠肝组织严重损伤,肝小叶结构被破坏,有明显的脂肪变性,肝脏有胶原纤维沉积。与模型组相比,阳性组和古日古木-13各剂量组部分区域胶原沉积明显改善,肝细胞脂肪变性减少,汇管区内仍可见炎细胞浸润,细胞炎症明显减轻,肝细胞坏死显著减少,见图3。
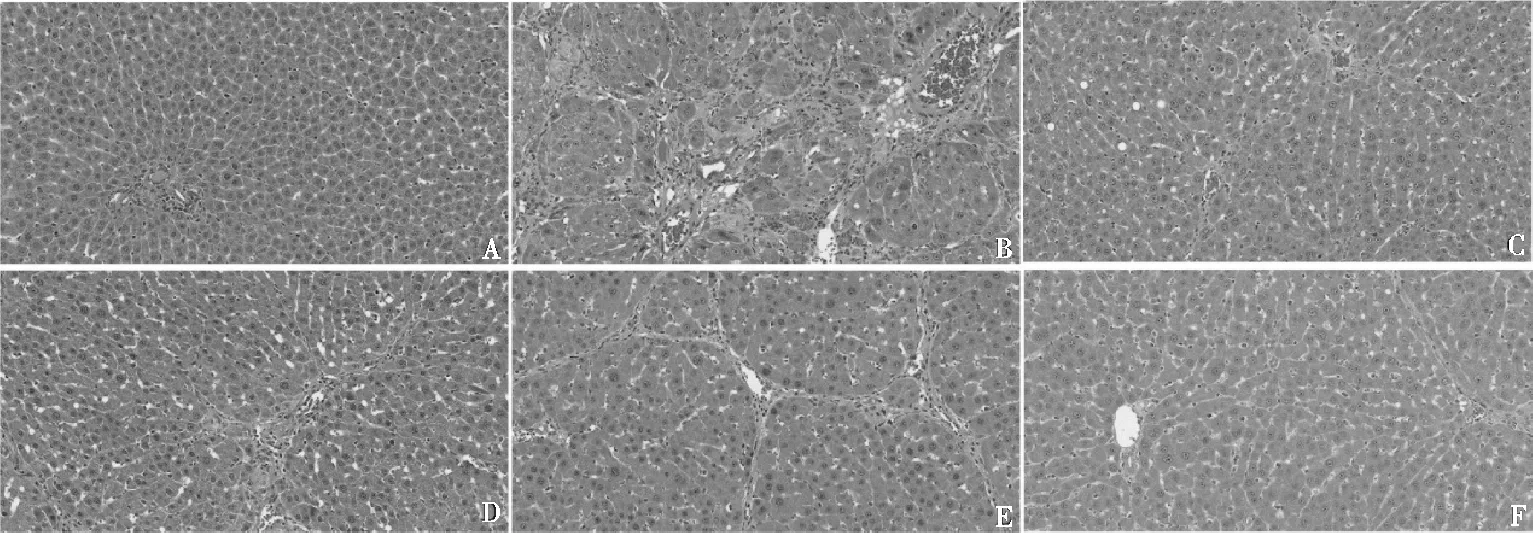
注:A 空白组;B 模型组;C 阳性组;D古日古木-13低剂量组;E古日古木-13中剂量组;F古日古木-13高剂量组。
3.5 对大鼠肝组织TGF-β1的影响
与空白组比较,模型组大鼠肝组织TGF-β1表达显著升高(P<0.05)。与模型组比较,古日古木-13高剂量组大鼠肝组织TGF-β1表达量明显下降,差异有显著统计学意义(P<0.01),见图4。

注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。
3.6 对CCL4诱导大鼠HSCs活化的抑制作用
与空白组比较,模型组大鼠肝组织α-SMA表达显著升高(P<0.05)。与模型组比较,阳性组、古日古木-13各剂量组大鼠肝组织α-SMA表达均显著下降(P<0.05);抗原阳性表达为棕黄色,细胞核为蓝色。见图5、图6。
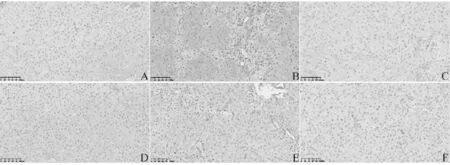
注:A 空白组;B 模型组;C 阳性组;D古日古木-13低剂量组;E古日古木-13中剂量组;F古日古木-13高剂量组

注:与空白组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01。
4 结语
肝纤维化在人群中较为多发,也是肝细胞癌(HCC) 衍变的关键环节,是不可轻视的健康问题。现阶段暂无肝纤维化的特异性检测方法,血清学指标仍是临床上运用较广泛的无创性诊断手段。HA是ECM的重要组成部分,当肝纤维化时HA合成增加,同时,肝细胞摄取和分解HA的能力也因肝功能受损降低,从而显著增加血清HA水平[9]。LN是一种非胶原性糖蛋白,是基底膜的主要成分,在肝纤维化时聚集沉积,血清值升高反映基底膜更新率的增加[10]。血清PⅢNP是完整的Ⅲ型前胶原分子,直接反映了Ⅲ型胶原的合成情况[11]。CCl4诱导的肝纤维化大鼠血清HA、LN及PⅢNP水平显著升高,提示肝纤维化模型建立成功。本研究中,经过蒙药古日古木-13的干预,肝纤维化大鼠血清中HA、LN和PⅢNP表达显著降低。通过组织病理学和血液生化检测发现肝纤维化大鼠肝脏组织形态变化明显,同时肝纤维化大鼠血清中AST、ALT水平有下降趋势。这些均表明蒙药古日古木-13对CCl4诱导的实验性肝纤维化具有积极改善作用,提示显著降低胶原纤维的合成与沉积是改善肝纤维化的可能机制之一。本实验采用60%CCl4橄榄油溶液进行造模,结果显示实验后期大鼠有精神不振、腹部胀气,甚至腹水等症状,这可能与四氯化碳浓度较高有关。
活化的肝星状细胞(Hepatic stellate cell,HSC)将分化为成纤维母细胞,产生大量的ECM,是肝纤维化过程中负责胶原蛋白合成的主要细胞类型。在HSC增生和激活过程中诸多细胞因子起调控作用。越来越多的证据表明,TGF-β1在肝纤维化中扮演着重要角色[12-13]。TGF-β1经库普弗细胞分泌产生,它能激活HSC,同时促使HSC自分泌TGF-β1[14]。蒙药古日古木-13高剂量能显著降低肝组织中TGF-β1的表达,表明蒙药古日古木-13抑制肝纤维化的机制可能与TGF-β1细胞因子有关。然而,由于本实验给药周期较短,蒙药古日古木-13低、中剂量和阳性组与模型组相比无明显差异,但均对肝纤维化大鼠TGF-β1水平有下调作用。α-SMA的异常表达已被认为是肝星状细胞活化的可靠标志物[15],蒙药古日古木-13可显著降低大鼠肝纤维化肝组织α-SMA的表达,提示蒙药古日古木-13可能通过抑制肝星状细胞的活化,进而降低ECM的合成。
综上所述,本研究认为蒙药古日古木-13改善肝纤维化的主要作用机理可能是阻止星状细胞活化,抑制星状细胞自分泌的TGF-β1肝纤维化促进因子,进而减少ECM的过度增生、沉积,从而发挥了改善肝纤维化的作用。

