基于基因数据集和分子对接技术的非小细胞肺癌EGFR-TKIs耐药/敏感相关核心基因筛选
汪坤,潘浩,罗正春,江万里
1黄冈市中心医院心胸血管外科,湖北黄冈 438000;2黄冈市中心医院护理部;3武汉大学人民医院胸外科
最新国家癌症中心统计数据分析显示,到2022年中国和美国将分别有大约482万和237万例癌症新发病例,以及321万例和64万例癌症死亡病例,而肺癌在人类癌症中发病率和病死率最高[1]。在肺癌不同分型中,非小细胞肺癌(NSCLC)约占85%,腺癌是最常见的病理类型,约占NSCLC的50%以上。表皮生长因子受体(EGFR)基因突变是腺癌最常见的驱动基因突变,靶向EGFR的酪氨酸激酶抑制剂(TKIs)已成为进展期EGFR突变NSCLC患者的一线治疗方案。由于受到原发性耐药和获得性耐药的影响,导致在第一代或第二代EGFR-TKIs治疗10~14个月后,肺癌患者不可避免地发生疾病进展[2]。2022年1月—6月,本研究通过数据库分析比较了EGFR-TKIs耐药和敏感细胞之间的差异表达基因,基于美国国家癌症研究所癌症研究中心所列出的用于抗癌药物测试的60种癌细胞系数据以及分子对接技术,识别并鉴定出NSCLC的EGFR-TKIs耐药核心基因,旨在为进一步探索EGFR-TKIs耐药机制提供新思路。
1 材料与方法
1.1 基因数据集及NSCLC细胞系信息采集使用基因表达综合数据库(GEO;www.ncbi.nlm.nih.gov/geo)[2]搜索检测阿法替尼(Afatinib)、奥斯替尼(AZD-9291)、厄洛替尼(Erlotinib)、吉非替尼(Gefi⁃tinib)等EGFR-TKIs敏感的非小细胞肺癌细胞系测序或芯片数据集,共纳入4个基因数据集及其EG⁃FR-TKIs耐药细胞系(EGFR-TKIs耐药组)、敏感细胞系(EGFR-TKIs敏感组),见表1。

表1 本研究纳入的4个基因数据集及相关NSCLC细胞系
1.2 EGFR-TKIs相关基因的筛选及功能分析使用GEO2R(GEO在线工具)搜索EGFR-TKIs耐药组和敏感组之间的差异表达基因(DEGs),识别DEGs的阈值标准为adj.P<0.05。使用韦恩图确定4个基因数据集的共同DEGs,并进行基因本体(GO)功能富集分析。使用R语言里的“clusterProfiler”包进行富集分析,FDR<0.05为差异有统计学意义。
1.3 基因—药物对的初步筛选采用R-3.6.2进行CellMiner数据分析,使用Pearson相关分析法分析共同DEGs与FDA认证/临床试验的EGFR-TKIs半数抑制浓度(IC50)之间的相关性,初步筛选基因—药物对。基因—药物对的筛选标准:①在EGFRTKIs敏感组上调的基因,且在CellMiner分析中相关性系数<0.25、P<0.05;②在EGFR-TKIs敏感组下调的基因,且在CellMiner分析中相关性系数>0.25、P<0.05。
1.4 基因—药物对的验证将1.3中初步识别的EGFR-TKIs耐药/敏感相关基因的编码蛋白与对应EGFR-TKIs的主要成分进行分子对接,以验证成分—靶点之间的可能性。检索RCSB PDB数据库和Pub Chem数据库,得到基因编码蛋白与药物成分的三维结构和化学结构,使用Pymol软件对蛋白质分子进行去水去磷酸根等操作,利用Auto Dock1.5.6软件将化合物与核心蛋白pdb格式转为pdbqt格式,并寻找活性口袋,最后运行Auto Dock Tools进行分子对接以验证基因—药物对,结合能<-7.0 kcal/mol提示配体与受体具有较好的结合活性。
2 结果
2.1 EGFR-TKIs相关基因的筛选及功能分析结果EGFR-TKIs敏感组与耐药组差异基因表达分析的火山图见OSID码图1。在GSE31625数据集中,EGFR-TKIs敏感组上调基因2 339个,下调基因2 048个;在GSE38310数据集中,EGFR-TKIs敏感组上调基因1 772个,下调基因1 672个;在GSE62504数据集中,EGFR-TKIs敏感组上调基因566个,下调基因453个;在GSE122005数据集中,EGFR-TKIs敏感组上调基因2 666个,下调基因2 877个。韦恩图结果显示,4个基因数据集共同的上调基因42个、共同的下调基因14个;见OSID码图2。
2.2 56个共同DEGs的GO功能富集分析结果在生物过程方面,DEGs主要富集于Rab蛋白信号转导、上皮细胞形态发生等;在细胞成分方面,DEGs主要富集于核内体膜、顶端质膜、基底外侧质膜、细胞顶端、髓鞘中。见表2。
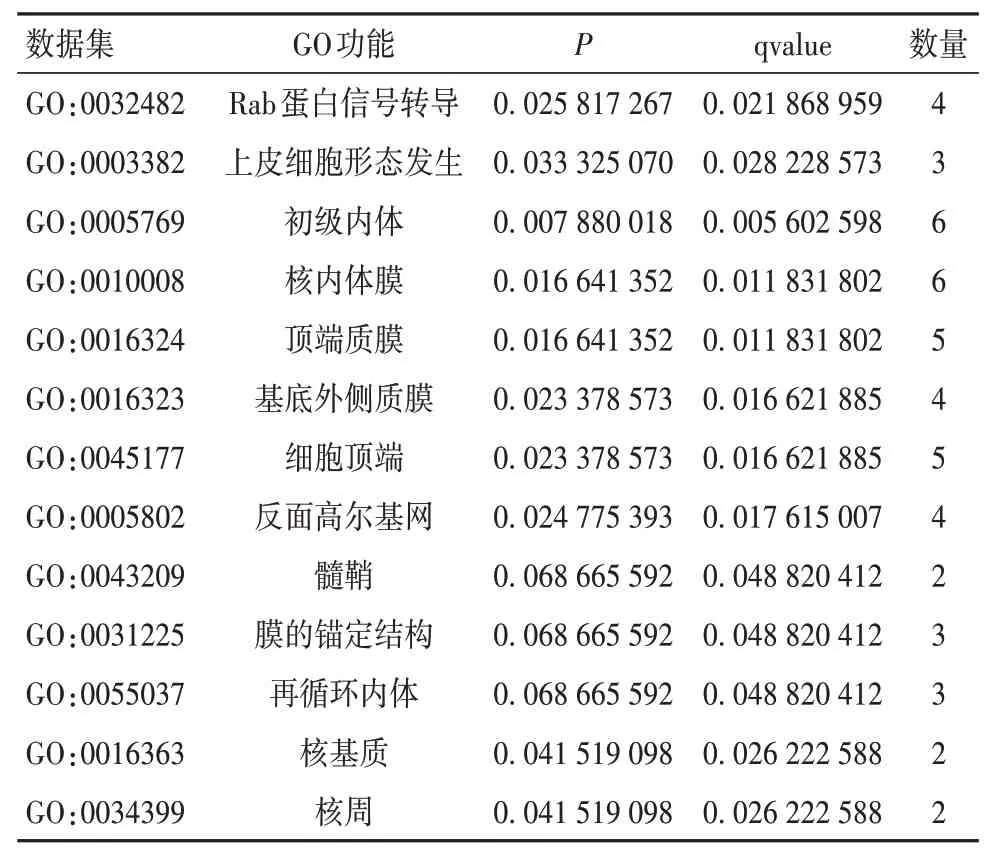
表2 56个共同DEGs的GO功能富集分析结果
2.3 基因—药物对的初步筛选结果Pearson相关分析结果显示,初步筛选出符合标准的基因—药物对共16对,其中包含7个EGFR-TKIs相关基因,分别为脂多糖诱导肿瘤坏死因子(LITAF)、黏蛋白16(MUC16)、酪氨酸激酶受体2(ERBB2)、特异性雄激素调控基因116(C1orf116)、肌盲样蛋白3(MBNL3)、脾酪氨酸激酶(SYK)、四跨膜蛋白基因(TSPAN4),见表3;其中,LITAF、MUC16、ERBB2、C1orf116、MBNL3、SYK表达与EGFR-TKIs的IC50呈负相关关系,TSPAN4表达与EGFR-TKIs的IC50呈正相关关系(P均<0.05)。
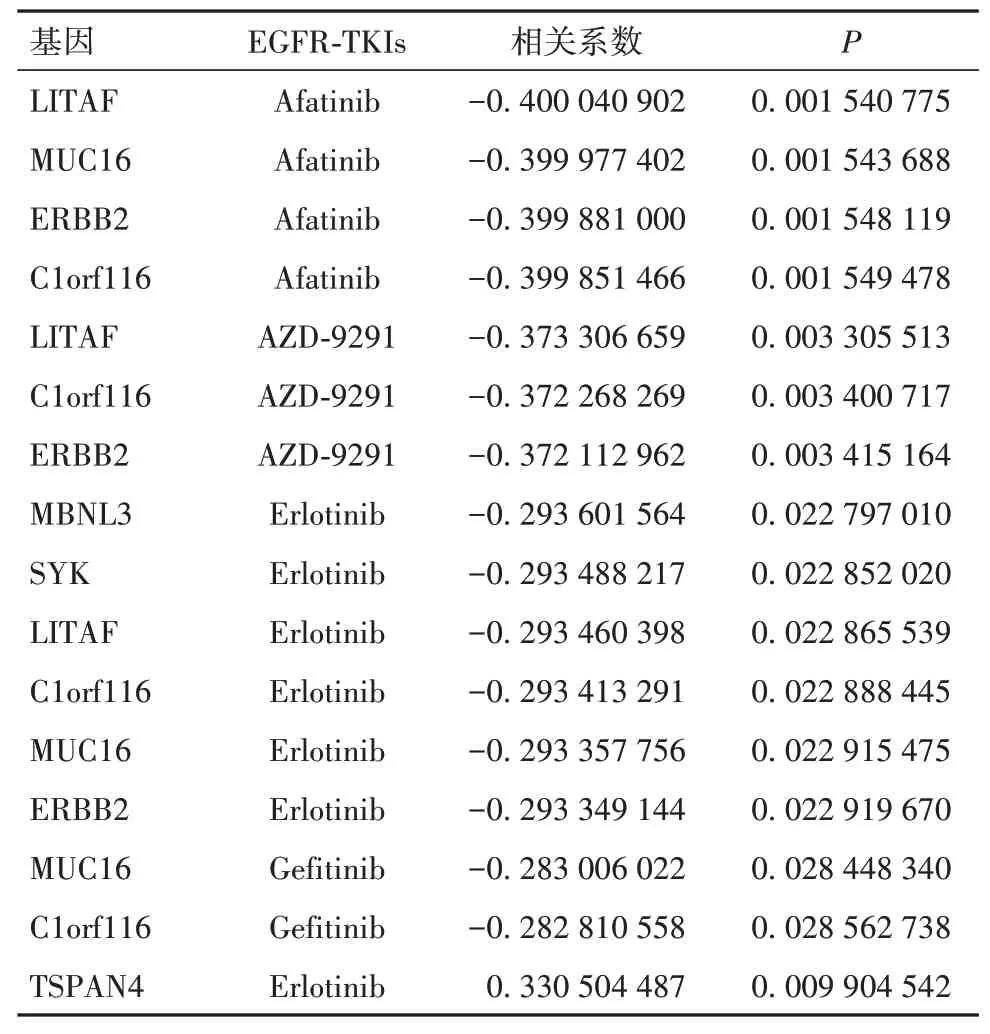
表3 共同DEGs与EGFR-TKIs IC50的相关性分析结果
2.4 EGFR-TKIs药物核心成分与关键靶点的分子对接16对基因—药物对中仅5对的结合能<-7.0 kcal/mol,分 别 为ERBB2-Afatinib、ERBB2-AZD-9291、ERBB2-Erlotinib、MUC16-Afatinib、MUC16-Er⁃lotinib,其结合能分别为-7.7、-7.4、-7.4、-9.2、-8.6 kcal/mol。分子对接可视化分析结果显示,Afatinib与活性位点附近的Thr-2、Ala-272这2个氨基酸形成氢键结合到ERBB2,与活性位点附近的Tyr-152、ASN-149这2个氨基酸形成氢键结合到MUC16;AZD9291与活性位点附近的Thr-84这1个氨基酸形成氢键结合到ERBB2;Erlotinib与活性位点附近的Thr-2、Ser-1这2个氨基酸形成氢键结合到ERBB2,与活性位点附近的Gln-159这1个氨基酸形成 氢键 结 合到MUC16;但MUC16与Gefitinib,TSPAN4与Erlotinib,在实际对接过程中并没有形成可靠结合点;提示EGFR-TKIs耐药/敏感相关的核心基因有2个,分别为MUC16和ERBB2,见OSID码图3。
3 讨论
肺癌在所有恶性肿瘤中的癌症相关病死率排名第一,中国肺癌患者的5年总生存率低于20%,大约50%的亚洲NSCLC患者携带EGFR基因突变[3]。研究显示,采用Gefitinib治疗的晚期NSCLC患者比用标准化疗方案(包括卡铂和紫杉醇)治疗的患者无进展生存期更长[4]。杨淑慧等[5]研究发现,EGFR突变型进展期肺腺癌患者易出现肺、脑、骨、胸膜转移,就诊时常有多器官转移,而骨转移及转移器官数目是影响患者接受TKIs治疗预后的独立影响因素。近年来,EGFR-TKIs的耐药性问题成为了NSCLC患者生存获益的重大阻碍,EGFR-TKIs的获得性耐药机制可能有:①继发性基因突变,如T790M、L747S、D761Y、T854A、MET、HER2扩增等;②旁路信号通路激活;③异常下游通路激活;④组织学转化;⑤ABC转运蛋白过表达等[6-7]。随着近年来基因测序技术的发展,大量NSCLC患者靶向治疗的基因芯片数据上传至网络数据库。因此,数据挖掘技术为EGFR-TKIs耐药/敏感基因的筛选提供了新的思路[8]。GEO属于美国国家生物技术信息中心,隶属于美国国立卫生研究院,是目前最大的公共基因表达数据资源之一[9]。本研究通过生物信息学方法分析EGFR-TKIs耐药/敏感细胞的基因测序或芯片数据集,4个基因数据集中EGFR-TKIs敏感组共同上调基因42个,共同下调基因14个。本研究GO功能分析结果显示,DEGs主要富集于Rab蛋白信号转导、上皮细胞形态发生等过程。
CellMiner数据库主要是通过国家癌症研究所癌症研究中心所列出的60种癌细胞为基础而建立的,NCI-60细胞系是目前使用最广泛的用于抗癌药物测试的癌细胞样本群,通过CellMiner数据库可查询到NCI-60细胞系中已确认的22 379个基因,以及20 503个已分析的化合物数据,包括多种已获美国食品和药物监督局批准的药物,以及临床试验中的药物分子。本研究初筛结果显示,与EGFR-TKIs IC50之间存在显著相关关系的EGFR-TKIs耐药/敏感 基 因 有7个,分 别 为LITAF、MUC16、ERBB2、C1orf116、MBNL3、SYK、TSPAN4,可能成为EGFR突变NSCLC患者靶向治疗的潜在指标;其中LITAF、MUC16、ERBB2、C1orf116、MBNL3、SYK表达与EG⁃FR-TKIs的IC50呈负相关关系,提示其高表达可能会提高EGFR-TKIs的敏感性;TSPAN4表达与EGFRTKIs的IC50呈正相关关系,提示其高表达可能会提高EGFR-TKIs的耐药性。
LITAF也称为p53诱导基因7,最初在人巨噬细胞系THP-1经脂多糖刺激后鉴定发现,是一种重要的转录因子。LITAF不仅可以诱导肿瘤坏死因子α表达,还可以参与其他细胞因子的调节,包括白细胞介素lα、干扰素γ和白细胞介素10,并影响凋亡相关基因Bax、Bcl-2等表达[10]。研究发现,LITAF参与调节胞质—溶酶体运输和细胞内信号传导,虎蛙病毒ORF080L蛋白与LITAF相互作用可破坏表皮细胞生长因子诱导的EGFR降解[11]。C1orf116参与调节上皮—间质转化,且其表达降低与肺癌、前列腺癌患者的预后不良有关[12]。研究发现,MBNL3和KANSL2是调节胰腺导管腺癌PANC-1细胞侵袭能力的相关因子,但不影响细胞增殖,MBNL3可通过上调Nanog来增加卵巢干细胞的细胞活力并减少细胞凋亡,是治疗卵巢癌细胞紫杉醇耐药的相关靶点[13]。本研究结果显示,MBNL3表达升高可增强EGFR-TKIs的敏感性。SYK是一种非受体酪氨酸激酶,参与免疫感受器和生长因子受体的信号传导,EGFR活化显著诱导SYK磷酸化的同时,SYK抑制剂又抑制了表皮生长因子诱导的EGFR磷酸化,免疫沉淀和共聚焦显微镜显示表皮生长因子刺激后EGFR和SYK之间的分子相互作用增加[14]。TSPAN4是跨膜蛋白4超家族的成员之一,通常与干扰素和其他细胞表面蛋白形成复合物,并在各种组织和细胞类型中广泛表达,如成纤维细胞、内皮细胞、树突状细胞和间充质细胞等[15]。TSPAN4在肺腺癌组织和细胞系中表达显著升高,TSPAN4过表达与晚期肿瘤患者淋巴结转移、远处转移以及不良结局有关。TSPAN4可直接与miR-665相互作用,增加ZEB1表达,从而促进肿瘤转移,慢病毒介导的TSPAN4基因敲低可显著降低肺腺癌细胞在体外和体内的转移能力[16]。本研究结果显示,TSPAN4过表达可能导致EGFR-TKIs的耐药性增强。
MUC16是一种大分子跨膜黏蛋白,是EGFR突变的预测因子[17]。ERBB2即HER2基因,在含有EGFR外显子19缺失的多种细胞系中表达增加。研究显示,与单独在细胞中使用Afatinib或曲妥珠单抗依坦辛相比,Erlotinib和依坦辛的组合对细胞增殖能力显示出更好的抑制作用[18]。ERBB2扩增发生在10%~15%的EGFR-TKIs耐药患者中,但迄今为止尚无ERBB2特异性靶向治疗药物批准用于ERBB2扩增产生耐药性的EGFR突变性癌症患者。本研究分子对接结果显示,MUC16、ERBB2与EGFR-TKIs具有较好的结合活性,MUC16和ERBB2与TKIs关系密切且复杂,其具体机制及关系仍待深入研究。
综上所述,本研究首先确定了EGFR-TKIs耐药/敏感相关的7个核心基因,即LITAF、MUC16、ERBB2、C1orf116、MBNL3、SYK和TSPAN4,分子对接进一步证实MUC16、ERBB2与EGFR-TKIs存在较好的结合活性,MUC16过表达能提高Afatinib、Erlo⁃tinib的敏感性,ERBB2过表达能提高Afatinib、Erlo⁃tinib、AZD-9291的敏感性,为进一步探索EGFRTKIs耐药机制提供了新思路。

