伏马毒素的毒性作用及研究进展
刘晓莉, 李金泽, 朱勇文, 王文策, 杨 琳
(华南农业大学动物科学学院广东省动物营养调控重点实验室,广东广州 510642)
霉菌毒素是食品和饲料中常见的污染物,严重影响着全球人类和动物健康(坚乃丹等,2018)。霉菌毒素主要由曲霉菌属、镰刀菌属等4种常见的霉菌属产生。其中镰刀菌属产生的伏马毒素(FB)是该属中毒性最强、产毒素数量最多的毒素(李巍,2015;潘冬春等,2012),严重污染玉米、高粱、水稻等多种粮食作物及其产品,导致受污染的农作物营养价值和粮食产量降低,危害人畜健康,造成巨大的经济损失(坚乃丹等,2018)。
1 伏马毒素的理化性质
FB是由串珠镰刀菌(F.verticillioides)和再育镰刀菌(F.proliferatum)为主的致病菌产生的一种次级代谢产物(潘冬春等,2012),1988年首次从串珠镰刀菌培养液中分离得到 (Catherine等,1988)。FB为白色针状结晶,是由20个碳原子组成的双酯类直链化合物,其骨架结构两侧分布着各种官能团(Kenneth等,2013)。FB是水溶性毒素,易溶于水等极性溶剂,无荧光和紫外吸收特性(Wu等,2008),遇酸可水解失去丙三羧酸酯基,且水解产物仍然有毒性(Bry'la等,2017)。因为FB具有耐高温、物理性质稳定等特征,所以在生产加工过程中其结构很难被破坏,致使其在粮食或饲料中的污染较为严重。研究表明,随着温度的不断升高,FB的半衰期不断缩短,在150℃的高温条件下,FB的半衰期为10 min,但在75℃的条件下,FB的半衰期可达8 h(李巍,2015;王金昌等,2009)。
目前发现的FB结构类似物有28种,通常分为A、B、C和P四类(范颖等,2021)。FB的分类主要取决于其化学结构中不同的3个取代基团,即R1、R2和R3(表1)。四类FB中以B型伏马菌素毒性最高,主要以FB1、FB2、FB3的形式存在(李巍,2015)。其中,FB1的毒性在B类毒素中最强,污染最普遍。FB1约占FB总含量的70%,是污染食品和饲料的主要毒素,因而受到广泛关注。同时,FB也是致癌物,可诱发人的食管癌,并已被国际癌症研究机构认定为2B类致癌物(Deepa等,2019;Antonissen等,2014)。
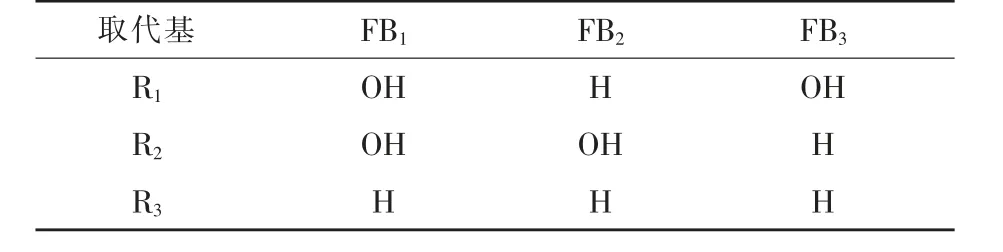
表1 B类伏马毒素(FB)的主要取代基
2 伏马毒素的污染情况及限值
2.1 污染情况 高湿天气以及收获前后处理和保存不当会导致FB在谷物和饲料中的大量污染,因而检出率较高 (Elias,2016)。Ngure等(2021)研究发现,在肯尼亚西部8个县的204份玉米样品中有48%受到FB污染,毒素含量超过2 mg/kg。Custodio等(2019)对巴西30个养殖场的饲料检测发现,FB的污染最普遍并且毒素含量也最高,达2330μg/kg。Jaksic等(2019)检测了291份玉米样品发现,82%的样品被FB污染,毒素含量高达1.515 mg/kg。Josep等(2013)对三个国家的1250份玉米样品进行检测发现,FB1和FB2的毒素含量分别为1201.7μg/kg和1010.5μg/kg,污染率达到11.4%和和11.3%。Seo等(2013)对150份配合饲料和40份饲料原料进行检测,结果显示在原料中FB1和FB2污染率分别为50%和40%,在饲料中毒素污染水平高达85%和47%,其中肉鸡饲料和育肥犊牛饲料的污染最严重,毒素含量分别为14.6 mg/kg和2.28 mg/kg。Nada等(2019)对132种不同种类的药草、香料和混合物样品进行检测发现,60%的样品中出现高浓度FB1(平均为5394.2μg/kg)。
国内FB的污染情况也较为严重。范楷等(2021)对长江三角地区720份常见农产品检测后发现FB1的检出率最高,达49%。Wang等(2021)对河北、广东和广西三省(区)的家禽饲料进行毒素含量检测发现,FB1的平均含量为1628μg/kg,远高于其他毒素含量。李孟聪等(2021)对广东省内四类196份饲料样品进行毒素检测发现,FB1的检出率在猪饲料中最高,达82.95%,但在禽饲料中的毒素含量最高,达16260.45μg/kg。李人杰(2015)在2012年和2013年收集的玉米样本中发现,FB的检出率分别为50.2%和70.7%,平均污染水平分别为1575 ng/g和5225 ng/g。郭耀东等(2014)对485份样品进行检测发现,FB检出率为20.48%,平均含量为0.04 mg/kg。黄志伟等(2020)对62份植物性饲料原料进行检测发现,FB的检出率为37.09%,最大检测值为15.96 mg/kg。李丽娜(2019)对不同地区的121份玉米籽粒样品进行检测发现,FB污染率达57.9%,毒素平均含量为2.0657 mg/kg,最高水平达10.0627 mg/kg。由此可见,FB在粮食和饲料中的污染已经对粮食及养殖安全造成了严重影响。
2.2 伏马毒素的限值 鉴于伏马毒素的污染日渐严重,我国在2018年5月实施的新版饲料卫生标准中,增加了FB的限值规定。同时,我国、欧盟和美国FDA等对伏马毒素最高限值的限定有所不同,其中我国对饲料原料与饲料产品中的限值概括最为全面,且欧盟与我国的限值标准相同,而美国的规定限值中除猪、家禽浓缩饲料和家禽配合饲料限值高于我国和欧盟外,其他限值均低于我国和欧盟(表2)。

表2 各国关于FB的限值标准
3 伏马毒素的毒性效应
FB对动物的损伤主要体现在神经、肠道、肝肾等方面。一方面,FB侵入动物机体后会竞争性抑制神经酰胺合成酶(Cers)对神经酰胺及鞘氨醇(So)的催化作用,导致神经酰胺和So合成减少、二氢鞘氨醇(Sa)在细胞中积累,使组织中Sa/So比值升高(Belqes等,2019;Merrill等,2001),进而导致线粒体复合物 I、细胞色素P450酶(CYP450)、花生四烯酸代谢和还原酶辅酶Ⅱ(NADPH)系统的活性升高,进而参与活性氧的生成(Mary等,2012),导致抗氧化状态的降低,同时诱导脂质、蛋白质和DNA发生氧化;另一方面,通过细胞外调节蛋白激酶(ERK)、线粒体途径、内质网应激和核转录因子-κB(NF-κB)的激活,导致细胞凋亡和自噬(Jia等,2020;Kim等,2018;Xu等,2016),引起细胞膜脂质发生改变、鞘脂代谢紊乱、细胞损伤和癌症(陈惠玉等,2019),严重危害动物神经、肠道以及肝肾等多种细胞。
3.1 神经毒性 FB1引起的神经毒性主要是通过破坏鞘脂生物合成来破坏细胞膜上的叶酸受体而导致叶酸吸收减少、神经管缺陷(NTD),进而引起机体产生神经毒性(Waes等,2005;Marasas等,2004)。Riley等(2015)对妊娠小鼠用FB1进行处理发现,FB1会诱导小鼠的NTD,并导致血液和组织中鞘氨醇碱1-磷酸水平升高。Sadler等(2002)指出,FB1具有抑制胚胎鞘脂合成、产生胚胎毒性和阻断叶酸转运的潜力,并且与癌症和NTD的患病率增加有关。由此可知,当妊娠期间受到FB的影响时,会对胚胎发育造成很大影响,因此应在妊娠期间严格控制饲料品质,避免摄入过量的霉菌毒素。
3.2 肠道毒性 FB1首先作用于机体并造成损伤的器官是肠道(Belqes等,2019)。当FB侵入机体后,吸收的FB主要通过肝肠循环进入肠道,干扰核外源性受体系统的稳态、影响肠道炎症因子的释放(Li等,2020)、激活细胞凋亡和自噬,从而引起肠道损伤。用浓度为5 mg/kg的FB1灌胃小鼠42 d后发现,十二指肠、回肠、盲肠和结肠中的中性粒细胞和淋巴细胞数量增加,且在不同肠道中白介素-2(IL-2)、IL-1β、IL-4、IL-10和 肿瘤坏死因子-α(TNF-α)受到不同程度的干扰,并损害了肠道的核外源性受体系统(Li等,2020;黎晓雯,2019)。Kim等(2018)用2.5 mg/kg的FB1连续4 d处理小鼠结肠区域的细胞后,观察到肌醇依赖性激酶1-α(IRE1α)和p-jun氨基末端激酶(p-JNK)的表达增加,神经酰胺水平降低,脂质过氧化物酶水平增加。Minervini(2014)等发现,FB会抑制人结肠细胞的增殖,并随着时间的延长使肠道膜黏度增加,造成细胞表面发生恶性病变。因此说明,当FB1进入肠道后,会降低肠道的消化、吸收和免疫等功能,进而引起肠道损伤。
3.3 肝毒性 FB1在肝细胞中主要通过干扰细胞鞘脂类代谢,导致细胞膜脂改变(陈惠玉等,2019),引起机体发生氧化应激、细胞凋亡和坏死(Xu等,2016),进而导致肝毒性。研究表明,当用含FB的饲料饲喂雏鸡时,会引起雏鸡肝脏中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性显著降低(Galli等,2020),引起氧化应激。李巍(2015)用含有42 mg/kg FB的饲料饲喂雏鸡发现,FB降低了机体的抗氧化能力,提高了血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)和乳酸脱氢酶(LDH)的水平,同时SOD活性降低。Benlasher等(2012)在FB的作用下,研究了火鸡和鸭的血清和肝脏中Sa的浓度,结果表明血清和肝脏中Sa的浓度均增加,并且在肝脏和血清中火鸡和鸭的Sa水平相反。有研究表明,若用FB1处理小鼠,会发现小鼠血浆中ALT、AST和碱性磷酸酶(ALP)显着增加,LDH降低,并且FB1还会显著增加肝肾中丙二醛(MDA)水平,显著降低肝肾中的CAT活性(Ezdini等,2020),从而扰乱机体的生化和氧化应激状态。Mahendra等(2017)用FB1处理人肝癌细胞(HepG 2)和小鼠模型不同时间后发现,FB1会引起肝脏诱导的细胞损伤,改变小鼠的肝酶水平,通过ROS介导的信号引起细胞自噬,而Sa和神经酰胺的含量无明显改变。用FB1处理大鼠肝细胞时,发现FB1可通过介导半胱天冬酶3(Caspase-3)、抗凋亡基因(如Bax、Bcl-2)的表达诱导细胞凋亡(Wang等,2020)。当用不同浓度的FB1染毒HepG 2细胞后发现,FB1呈剂量依赖性诱导肝细胞损伤,引起细胞凋亡(Ming等,2017)。当HepG 2细胞暴露在FB1中,可通过肝X受体机制降低细胞表面低密度脂蛋白受体水平并促进胆固醇外流启动子的表达,导致肝细胞中的胆固醇代谢失调(Abdul等,2021)。由此说明,当肝脏受到FB1的影响时,会降低肝脏的抗氧化能力和细胞活力,干扰鞘脂代谢,引起机体发生氧化应激。
3.4 肾毒性 肾脏是FB毒性作用的靶器官之一。FB1主要引起肾上皮细胞的氧化损伤,诱导细胞自噬与凋亡。肾脏细胞上的研究发现,FB1可通过TNF和重组蛋白-丝裂原活化蛋白激酶通路诱导细胞自噬,启动Caspase非依赖性细胞死亡。研究表明,当猪肾细胞或猴肾细胞暴露在FB1中,均会发生氧化损伤,凋亡率增加(Wei等,2018;Seyda等,2017)。当人肾小管上皮细胞暴露在FB1中,会激活细胞自噬,并通过雷帕毒素复合物1诱导细胞产生肾毒性和氧化应激(Hou等,2021)。袁巧玲等(2019)指出FB1可显著降低猪肾细胞活力,降低细胞周期相关基因的表达,从而抑制猪肾上皮细胞增殖。
3.5 免疫毒性 FB1会影响动物体内和体外的免疫功能和抑制神经酰胺合酶,引起鞘脂代谢紊乱,因此鞘脂代谢产物可能会影响免疫相关受体的表达(Wang等,2016;Dresden等,2002),从而参与免疫反应。用含15 mg/kg的FB1饲料饲喂肉鸡可显著抑制血液中IL-1β、IL-2、干扰素-α(IFN-α)和IFN-γ的表达(Cheng等,2006)。给大鼠喂食100ppm FB1后,脾脏单核细胞中IL-4和IL-10的mRNA表达水平显著增加(Wang等,2016)。由此说明,当机体受到FB1的影响时,可能会导致鞘脂代谢发生紊乱,进而导致免疫系统受损。
3.6 生殖毒性 FB1在生殖细胞中主要通过损害线粒体功能,引起氧化应激和卵母细胞死亡、诱导溶酶体的积累和自噬的发生,并引起内质网应激和DNA损伤(Wang等,2021)。研究表明,用FB1染毒猪卵母细胞时,可显著抑制猪卵母细胞体外成熟,引起细胞染色体排列紊乱、纺锤体结构异常,并检测到猪卵母细胞ROS含量明显增加,氧化应激相关因子CAT、SOD1和SOD2的mRNA相对表达量升高;细胞凋亡相关基因Caspase 3和Bax的mRNA表达显著升高,而Bcl-2 mRNA水平则显著下降,表明FB1可诱导猪卵细胞产生氧化应激和细胞凋亡,最终导致卵母细胞未能成熟(曹伟,2019)。当用0、20、30、40μmol/kg的FB1处理猪卵丘卵母细胞复合物时发现,FB1浓度达到30μmol/Kg时,会干扰细胞周期进程、破坏细胞骨架和破坏线粒体功能对卵母细胞成熟产生不利影响,诱导猪卵母细胞发生氧化应激和细胞凋亡(Li等,2021)。
3.7 其他毒性 FB1一方面会通过改变细胞内鞘脂代谢、阻断有丝分裂、干扰DNA合成和组蛋白去乙酰化酶/磷酸肌醇3激酶/蛋白激酶B(HDAC/PI3K/Akt)信号通路等方式诱导细胞凋亡,影响细胞的生长、分化和坏死;另一方面,FB1会通过引起线粒体应激和内质网损伤,导致氧化应激。Yu等(2021)将人食管上皮细胞(HEEC)暴露在FB1中发现,FB1可促进HEEC的细胞增殖和迁移,诱导HEEC转化为癌细胞,最终导致食管癌;并且发现FB1可显著上调HDAC的表达,激活PI3K/Akt信号通路;表明HDAC/PI3K/Akt信号通路在FB1诱导的HEEC癌变中起关键作用。Khan等(2018)指出当食道细胞暴露在0~20μmol的FB148 h后,发现FB1对细胞有影响的最低浓度为1.25μmol,当10μmol和20μmol FB1暴露在细胞时线粒体去极化增加,ATP、ROS和GSH均降低。Yu等(2020)以人胃黏膜细胞(GES-1)为体外模型对FB的毒性进行研究,结果发现FB可能导致细胞活力降低,并导致膜渗漏、细胞死亡增加和内质网应激标志物的诱导表达。Alizadeh等(2015)研究表明,小鼠口服FB1后,GES-1会通过增加细胞凋亡和抑制这些细胞的有丝分裂活性而引起胃黏膜萎缩。
4 伏马毒素的污染防控措施
FB在饲料和粮食中的污染日益严重,因此找到有效缓解或降解其危害的方法尤为重要。一方面,可以利用农业措施及生物技术对FB的产生进行预防控制,Yue等(2020)对于FB污染程度较低的粮食作物通过筛选、清洗、射线照射、有机溶剂抽提等物理方法降低毒素含量,但由于FB的性质稳定导致物理方法处理对FB无影响。因此有研究指出植物提取物(香芹酚和丁香油酚等)和放线菌F-1发酵液可有效地抑制串珠镰刀菌孢子的萌发和菌丝生长(段灿星等,2015;刘春静等,2011)。此外,植物乳酸杆菌B7和戊糖乳酸杆菌X8可以吸附FB(王晓等,2015),进而降低FB的危害。另一方面,在饲料中添加适当的解毒型添加剂也可有效缓解FB对动物的影响。研究表明,饲料中添加伏马菌素酯酶可显著降低FB的污染(Alberts等,2021),进而达到解毒效果和维持肠道功能(Grenier等,2017)。在被FB污染的兔子饲料中添加20 g/kg辣木叶粉可提高兔子的营养消化率和器官重量,改善动物的中毒影响(Gbore等,2021)。在有FB污染的雏鸡饲料中,添加10 mg/kg的姜黄素可减轻毒性污染,起到抗氧化的作用(Galli等,2020)。当饲料中马齿苋含量达2%时,可最大限度地减少FB对鸡的肝脏氧化应激的影响(Marcela等,2020),此外,酵母细胞壁提取物也可显著提高动物的生产性能,降低空肠病原菌比例促进肠道健康(Sung等,2019)。有研究表明,在口服FB1的BALB/c小鼠中添加副干酪乳杆菌可降低FB1在胃肠道中的生物利用度,对氧化应激和组织学损伤等起保护作用,进而减轻FB1的毒性,因此,副干酪乳杆菌可作为镰刀菌毒素解毒的候选者(Khawla等,2020)。周妍(2018)指出,合适的FB1特异性适配体可直接清除ROS,提高SOD和GSH-Px酶抗氧化能力,减少细胞凋亡,进一步缓解FB1的损伤作用。
5 总结
目前,霉菌毒素污染粮食和饲料是全球普遍存在的问题,不仅危害人类健康,对经济也造成了巨大的损失。近年来,我国玉米、豆粕等饲料原料紧缺,每年有超过2%的谷物受霉菌毒素污染,完全丧失经济价值,所以霉菌毒素污染是亟待解决的问题。生产中通过利用农业措施及生物技术对FB的产生进行预防控制,开发出部分植物提取物和放线菌等可以抑制串珠镰刀菌的生长,伏马菌素酯酶、副干酪乳杆菌和黑酵母等能够缓解或者降解FB,但现在的研究仍处于初级阶段,具体作用机制尚不明确,所以解毒型饲料添加剂的研发以及伏马毒素降解菌的研究是未来减少FB污染的主要研究方向。

