阿加曲班联合双联抗血小板治疗CYP2C19不同基因型急性缺血性卒中的疗效分析
王敏 王敦敬 杜波 陈浩 牟英峰 耿德勤
虽然关于急性缺血性卒中的研究已屡见不鲜,但中国人群的终身卒中风险(39.3%)在同项比较中仍居于世界首位[1],因此我国卒中防治工作任重而道远。选择合理的个体化治疗方案、有效地改善侧支循环、减轻卒中后的脑损伤仍是今后临床工作的重点[2-3]。近期的研究越来越支持急性缺血性卒中后使用双联抗血小板治疗[4],然而仍有部分患者在规律服用抗血小板药物后再发卒中,这与CYP2C19不同基因型对氯吡格雷反应性不同有很大关系。研究发现氯吡格雷抵抗在亚洲人群中发生率高达20%~65%[5],在氯吡格雷抵抗患者中高达40%可能会再发血栓事件[6],但氯吡格雷抵抗的机制尚未完全清楚。CYP2C19基因多态性会影响氯吡格雷作用后的血小板反应性,但是否会影响患者的预后尚缺少临床研究证据[7]。急性缺血性卒中的抗凝治疗一直存在争议,有研究显示,抗凝治疗对特殊类型脑梗死有一定疗效[8-10]。本研究主要分析阿加曲班联合阿司匹林、氯吡格雷双联抗血小板治疗CYP2C19不同基因亚型的效果,以期更好地指导临床用药。
对象与方法
1.对象:2018年8月~2020年1月于徐州医科大学附属医院神经内科收治的急性缺血性卒中患者317例,其中男227例,女90例,年龄35~85岁,平均年龄(63.78±10.51)岁。纳入标准:(1)急性缺血性卒中诊断符合《中国急性缺血性脑卒中诊治指南2018》诊断标准[11],且经头颅CT或MRI证实;(2)18岁≤年龄≤85岁;(3)入院时美国国立卫生研究院卒中量表(NHISS)评分≤25分;(4)发病时间≤1周;(5)TOAST分型为大动脉粥样硬化型、小动脉闭塞型、不明原因型;(7)均完善CYP2C19基因检测。排除标准:(1)严重心、肺、肝、肾功能不全;(2)有凝血功能障碍、血小板减少等出血倾向;(3)入院时接受过动静脉溶栓、血管内治疗;(4)氯吡格雷、阿司匹林、阿加曲班过敏;(5)因其他原因不能配合。依据CYP2C19基因检测结果,将317例患者分为快代谢组134例(CYP2C19*1/*1)、中代谢组133例(CYP2C19*1/*2、*1/*3)、慢代谢组50例(CYP2C19*2/*2、*2/*3、*3/*3)。本研究经徐州医科大学附属医院伦理委员会审核批准,所有患者均知情同意。
2.方法:所有患者均予双联抗血小板常规治疗(拜阿司匹林每日100 mg、氯吡格雷每日75 mg口服)。按照是否联合阿加曲班,将CYP2C19不同基因亚型组患者又分为双抗联合阿加曲班组(A组)与单纯双抗组(B组),统计各组患者入院时、治疗后7天及治疗后3个月NHISS评分及改良Rankin量表(MRS)评分。阿加曲班治疗方案:发病时间≤48 h患者,阿加曲班每日60 mg持续泵入2日后,以每次10 mg、每日2次继续泵入5日;发病时间>48 h患者,阿加曲班每次10 mg、每日2次泵入7日。出院后,如伴有颅内大动脉严重狭窄,则使用双联抗血小板治疗3个月;如未伴有颅内大动脉严重狭窄,则双联抗血小板治疗时间不应超过21日。之后,根据CYP2C19基因亚型分型结果,将治疗方案调整为拜阿司匹林或氯吡格雷单抗治疗(快代谢型应用拜阿司匹林或氯吡格雷,中代谢或慢代谢型应用拜阿司匹林)。统计1年内各组患者的不良反应(消化道出血、肝肾功能损伤等)和心脑血管事件、颅内出血事件发生率及死亡率。
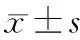
结 果
1.各组患者一般资料比较:快代谢组男89例,女45例,年龄35~85岁,平均年龄(64±10.81)岁;中代谢组男105例,女28例,年龄40~85岁,平均年龄(63±10.70)岁;慢代谢组男33例,女17例,年龄49~83岁,平均年龄(65±9.18)岁。各组患者年龄比较差异均无统计学意义(P>0.05),中代谢组、快代谢组及慢代谢组男性患者比例依次降低(P<0.05)。
2.CYP2C19不同基因亚型组患者治疗前后NHISS评分比较:入院时及治疗后7天各组患者NHISS评分比较差异均无统计学意义(P>0.05)。入院时、治疗后7天及治疗后3个月各组患者NHISS评分均依次降低(P<0.05)。治疗后3个月,快代谢组、慢代谢组、中代谢组患者NHISS评分依次升高(P<0.05)。见表1。
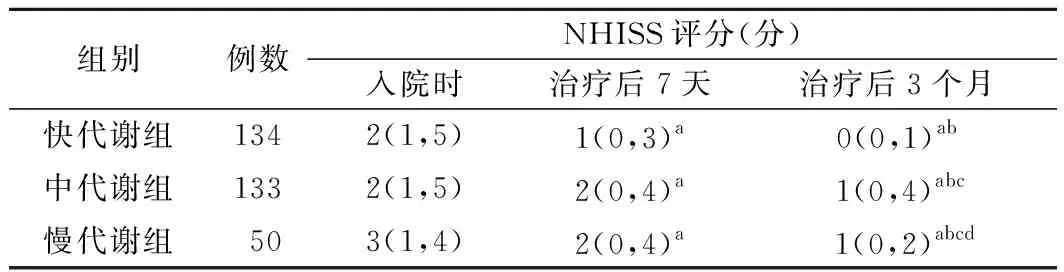
表1 CYP2C19不同基因亚型组患者治疗前后NHISS评分比较[M(P25,P75)]
3.各基因亚型A组与B组患者治疗前后NHISS评分比较:6组患者入院时、治疗后7天、治疗后3个月NHISS评分均依次降低(P<0.05);治疗后3个月,快代谢A组、慢代谢A组、中代谢A组患者NHISS评分依次升高(P<0.05)。其余各组间NHISS评分比较差异均无统计学意义(P>0.05)。见表2。

表2 各基因亚型A组与B组患者治疗前后NHISS评分比较[M(P25,P75)]
4.CYP2C19不同基因亚型组患者治疗前后MRS评分比较:治疗后3个月,快代谢组、慢代谢组及中代谢组MRS评分0~1分患者比例依次降低(P<0.05),快代谢组MRS评分2分患者比例低于同期中代谢组,中代谢组MRS评分3分患者比例高于同组入院时(P<0.05),其余组别比较差异均无统计学意义(P>0.05)。见表3。
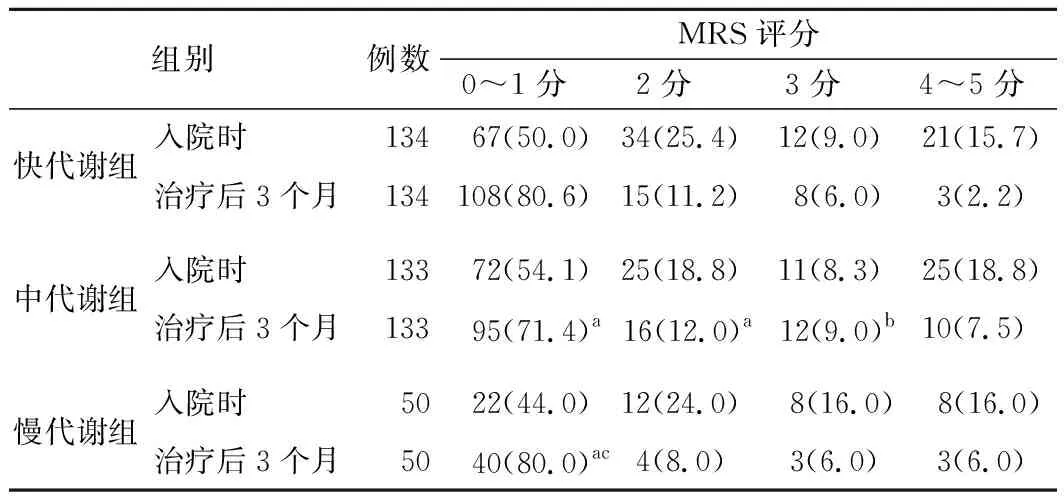
表3 CYP2C19不同基因亚型组患者治疗前后MRS评分比较[例,(%)]
5.各组患者1年内不良反应、心脑血管事件、颅内出血事件发生率及死亡率比较:中代谢B组颅内出血患者比例低于慢代谢B组(P<0.05),其余组别比较差异均无统计学意义(P>0.05)。见表4。
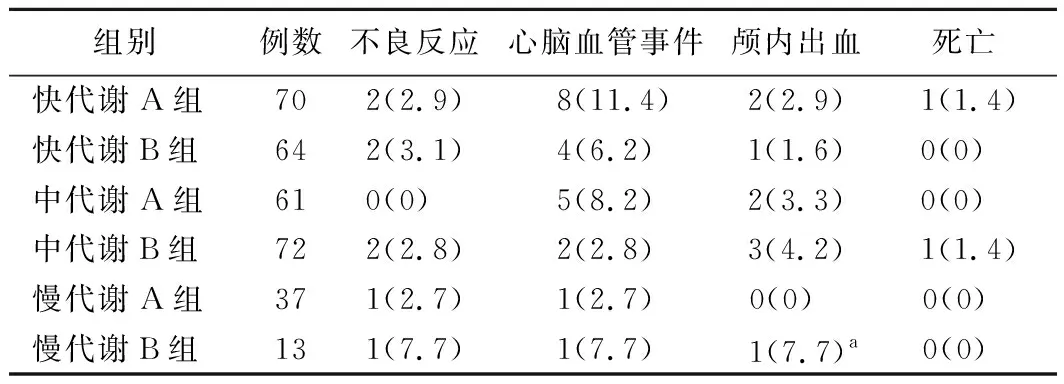
表4 各组患者1年内不良反应、心脑血管事件、颅内出血事件发生率及死亡率比较[例,(%)]
讨 论
急性缺血性卒中如治疗不当,1年内卒中复发率可达5%~14%[12]。目前国际通用的TOAST分型将脑梗死按病因分为5型,其中大动脉粥样硬化型、小动脉闭塞型最为常见。在动脉粥样硬化基础上斑块破裂,血小板激活、黏附、聚集在损伤的血管壁上,血栓进而形成,可能为其主要原因[13]。部分患者在规律服用抗血小板药物后,再发卒中的几率仍较高,这可能与药物抵抗有关[14]。有研究指出,常规使用氯吡格雷的患者发生抵抗的概率约4%~30%,CYP2C19基因失功能者高达45%[15]。我国约有35%的人口是CYP2C19等位基因携带者[16]。在血小板聚集反应中,血栓素A2和二磷酸腺苷为两个相互独立的环节[14],阿司匹林联合氯吡格雷较单剂治疗能更有效控制微血栓和临床症状,接受双联抗血小板治疗的急性缺血性卒中患者在治疗3个月时有更好的功能预后,卒中复发减少[17],且不增加出血风险[18]。本研究显示,治疗3个月时,各基因亚型A组与B组患者NHISS评分较入院时均有下降,提示治疗有效;慢代谢组NHISS评分、MRS评分0~1分患者比例均优于中代谢组;各基因亚型A组中,快代谢、慢代谢、中代谢组患者NHISS评分依次升高,可能原因是慢代谢组使用阿加曲班比率最高,支持阿加曲班治疗有效。脑梗死在急性期发生损伤的内皮细胞会激活内、外源性凝血途径,导致凝血功能亢进,大量凝血酶生成,形成血栓的同时消耗大量抗凝血酶Ⅲ(AT-Ⅲ)[19]。阿加曲班是一种低分子量凝血酶抑制剂,通过抑制纤维蛋白的形成、凝血因子Ⅴ、Ⅷ和的活化、蛋白酶C的活化及血小板聚集发挥抗凝作用,其抗血栓作用不需要辅助因子AT-Ⅲ,并可通过血脑屏障,进入血栓内部,灭活已与纤维蛋白结合的凝血酶,且半衰期短(39~51分)[20],不会导致血小板下降,也不引起出血时间延长,具有起效快、无免疫原性等优点[21]。有研究证实,阿加曲班联合双联抗血小板治疗缺血性卒中的有效率为97.06%,显著高于单独双联抗血小板治疗(85.29%)。应用阿加曲班可有效改善侧支循环[22],从而改善预后,且安全性好[23]。
CYP2C19失功能等位基因患者发生心脑血管事件比未携带者高50%以上[24]。本研究发现,各组患者1年内不良反应、心脑血管事件、颅内出血事件发生率及死亡率比较无显著差异。心脑血管事件发生率无显著差异的可能原因是阿加曲班可改善氯吡格雷抵抗带来的不良作用。慢代谢B组颅内出血患者比例最高,与中代谢B组比较差异有统计学意义,但因本次研究慢代谢组病例数少,可能有统计误差。此外,本研究纳入的3组患者在性别上有显著差异,可能存在其他因素如抽烟、饮酒、基础疾病等的影响,但未作进一步分析,今后仍需更完
善的数据分析证实。
综上,由于CYP2C19存在不同基因亚型,失功能型对氯吡格雷抵抗明显,阿加曲班具有良好的抗凝、抗血小板聚集作用,并可有效改善侧支循环,减轻卒中后的脑功能损伤,因此阿加曲班联合双联抗血小板治疗CYP2C19不同基因型急性缺血性卒中可能为未进行再灌注的短期治疗的合适选择,尤其对慢代谢型患者联用阿加曲班可提高疗效。

