肝脏影像报告和数据系统在肝细胞肝癌中的应用
李若坤 严福华
肝细胞肝癌(HCC)是最常见的肝脏原发恶性肿瘤,发病率占90%[1-2],影像检查是HCC诊断的主要方法。因此,规范影像检查方法及诊断路径对提高HCC诊断水平至关重要。肝脏影像报告和数据系统(LI-RADS)是美国放射学会(ACR)基于各个机构的专家共识发布的关于增强CT或MRI检查的HCC诊断规范,旨在为放射科医生规范化诊断高危人群中的HCC提供各方面指导。LI-RADS于2011年首次发布,分别在2013年、2014年、2017年、2018年进行了更新[3-4],并在2018年被美国肝病研究协会(AASD)纳入临床指南[5]。本文就LI-RADS的临床应用作一综述。
一、LI-RADS概述
LI-RADS有严格的适用人群,包括肝硬化患者、慢性乙型肝炎患者、目前或曾诊断为HCC的患者。不适用于以下人群:无HCC高危因素、年龄<18岁、先天性肝纤维化或血管性疾病(如遗传性出血性毛细血管扩张症、Budd-Chiari综合征、淤血性等)所致肝硬化。
LI-RADS分级标准主要基于病灶直径、动脉期高强化(非环形高强化)、静脉期或延迟期廓清(非周边廓清)、强化包膜、阈值增长表现5个方面的主要征象。2018版LI-RADS指南在阈值增长及LR-5的诊断标准上作出较大改动[6]。2017版LI-RADS对阈值增长的定义为:(1)肿块直径增加>5 mm;(2)6个月内直径增大>50%或6个月以上增大≥100%;(3)在2年内病灶新发且直径>10 mm。为了使具有肝癌高危因素患者的影像观察结果更贴近临床实际,ACR将2018版LI-RADS指南中的阈值增长修改为在6个月内肿块直径增加>50%;同时将LR-5g和LR-5us统一归为LR-5[7](图1)。
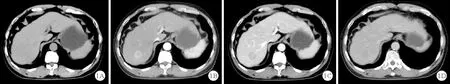
图1 某患者CT平扫结果:LI-RADS归类为LR-5,手术证实为HCC(A:肝脏S7段稍低密度影;B:增强动脉期,非环形显著强化;C:门静脉期,病灶非周边廓清;D:延迟期,病灶周边环形强化包膜)
除了对HCC主要征象描述外,还使用了辅助征象进一步调整诊断,主要包括HCC特异性辅助征象(非强化包膜、马赛克结构、病灶内含脂、出血、结中结)和非HCC特异性辅助征象(T2WI轻中度高信号、晕环状强化、扩散受限、病灶内乏脂、病灶内乏铁、亚阈值增长、肝胆期低信号)。
二、LI-RADS分级在HCC诊断中的应用
2018版LI-RADS指南仍依据影像征象将未经治疗的具有高危因素患者分为LR-NC、LR-1~5、LR-M及LR-TIV[8],见表1。

表1 2018版LI-RADS分类方法及临床建议
LR-1、LR-2表示观察结果确定为良性病变和高度可能为良性病变。在ACR先后更新的几个版本的LI-RADS指南中,LI-RADS分类中的LR-1、LR-2类分别明确诊断为良性病变、可能为良性病变。Jha等[6]对具有HCC高危因素患者的病变分级的研究结果表明,影像上<1cm、CT和MRI平扫的密度或信号与周围肝实质相近或稍低同时增强扫描的强化方式与邻近组织也相近的这一类肝硬化结节可不进行LI-RADS分类。但对于一些不典型增生的结节,由于其后期的强化方式可类似于HCC,因此可归于LR-3,部分借助于辅助征象甚至上升至LR-4,但不可上升至LR-5。
LR-3~5表示存在诊断HCC的可能性。LR-3主要包括一些具有结节状或小片状的灌注异常灶、不典型血管瘤及具有1~2个恶性特征的增生结节和部分小肝癌。LR-4、LR-5表示从可能为HCC到明确诊断的HCC。Kierans等[9]对144例高危患者的病变结果采用LI-RADS进行分类后发现LR-5/LR-TIV+LR-5对HCC的诊断效能较高,特异度为85.0%~96.8%。
LR-M定义为肝脏恶性肿瘤,除HCC外还可见于肝内胆管细胞癌(ICC)、混合型肝癌(HCC-ICC)等。其典型的影像征象表现为靶样肿块及环形动脉期高强化、门静脉期边缘性廓清及延迟期中心强化。LR-M除依据典型表现进行分类外,还可依据以下辅助征象进行分类:(1)影像学上具有侵袭性表现的病灶;(2)扩散加权成像(DWI)上病灶明显扩散受限;(3)病灶内出现严重缺血或坏死;(4)不符合LR-5分类标准且无血管浸润的病灶。Fraum等[10]按照2018版LI-RADS对256例患者进行研究的结果显示,具有HCC高危因素患者与无HCC高危因素患者相比,非HCC原发性肝癌的非环形动脉期高强化及非边缘廓清征象的出现率较高,而环形动脉期高强化及延迟期中心强化征象出现率较低;同时约90%非HCC原发性肝癌被分类为LR-M,约10%病灶被分类为LR-4或LR-5。
三、LI-RADS在HCC疗效评估中的价值
LR-Treated是ACR在2017版中开始提出的评估HCC预后疗效的评价标准[11-13],用于评估HCC局部治疗后有无复发或转移,分为无法评估治疗后反应、治疗后无肿瘤生存、治疗反应不确定和治疗后肿瘤存活,具体如下:(1)LR-TR无法评估:定义为影像质量差,无法对病灶进行观察,无法评估病灶局部治疗后的效果。(2)LR-TR无肿瘤存活:定义为病灶无强化或出现特异性的治疗后影像学征象。如肝动脉灌注化疗栓塞(TACE)术后早期,病灶周围出现细线样的环状强化,可能是术后增生的肉芽组织而并非表示有肿瘤存活[14]。(3)LR-TR肿瘤存活:定义为在治疗后的病灶内或周围出现结节状、肿块样或不规则软组织影,并有以下表现中任何一种,即动脉期高强化、“廓清”或与治疗前相似的强化方式。“廓清”现象并不要求病灶必须存在动脉期高强化的影像学表现。对廓清的影像学评估,在应用肝胆特异性对比剂钆塞酸二钠的MRI增强时只应在门静脉期进行;在应用细胞外对比剂增强的MRI时可在门静脉期及延迟期进行评价,见图2。(4)LR-TR不确定:定义为图像质量合格而病灶强化方式不典型而无法判断有无肿瘤存活。但由于影像学检查不能排除病灶中存在少量生存的肿瘤细胞的可能性,因此LR-TR不生存的分类并没有排除病理上生存的肿瘤细胞。故而,在诊断证据不足时,可适当考虑将病变分类确定为更低一级的分类。

图2 某HCC患者射频消融术后复查增强MRI结果:LI-RADS归类为LR-TR肿瘤存活(A:T2WI示肝脏S4段异常信号,坏死区呈低信号,存活区呈稍高信号;B:DWI示坏死区呈低信号,存活区呈高信号;C:增强动脉期示坏死区无强化,存活区显著强化)
四、LI-RADS在临床应用中的注意事项
在LI-RADS临床应用中,仍需注意以下几点:
1.LI-RADS有严格的技术扫描要求:CT增强扫描必须包括动脉期(以动脉晚期最优)、门静脉期和延迟期;MRI扫描必须包括T1WI同/反相位、T2WI、DWI、多期动态增强扫描,同时包括动脉(晚)期、门静脉期、延迟期。
2.LI-RADS有严格的适用人群:未包括日益增长的代谢相关性脂肪性肝病等及其他未达到肝硬化阶段的进展期慢性肝病人群,其应用价值有待进一步验证。
3.LI-RADS没有尝试鉴别癌前病变(如低级别及高级别异型增生结节):只是描述病变恶性或良性的可能性。
4.LR-5类具有较高的特异度,但敏感度中等:大多数病灶直径≤2 cm以下的HCC被归为LR-4类及以下,在小肝癌中的敏感度不够理想;另外,穿刺病理检查对LR-M病变性质的明确具有重要临床意义。
5.LI-RADS肝脏特异性对比增强的一些相关征象也作出了规范化定义,包括肝胆特异期高信号、低信号和环状低信号。肝胆特异期高信号是倾向于诊断为良性病变的次要征象,而低信号和环状低信号则是倾向于诊断为恶性病变的次要征象,这是因为其单独诊断HCC的特异度不够高,很多良性病变(如囊肿、血管瘤等)也可表现为肝胆特异期低信号,而一部分分化良好的HCC则可表现为高信号。
三、LI-RADS对HCC预后评估的价值
部分LI-RADS影像征象和LI-RADS分类在肝脏原发恶性肿瘤的预后预测中具有一定潜在价值。病灶内含脂可预测HCC分化良好,预后更好。病灶内出血、马赛克结构等是HCC切除术后早期复发的独立危险因素。若能将这些已知的与HCC患者预后相关的影像征象结合不同影像技术,构建更精准、有效的预测原发性肝癌预后的诊断预测模型,这将更有助于临床医生指导患者,制定基于患者的个性化处理方案。
综上,LI-RADS主要依靠病灶动态增强表现及非血供影像学特征无创性地诊断HCC,并对疗效提供标准化的解释及报告标准,同时提供一定的预后信息,在HCC诊疗中具有重要的应用潜力。今后需基于中国人群样本在临床实践中进一步验证和反馈。

