谷胱甘肽过氧化物酶-1在急性髓系白血病中的表达及临床意义
吐尔逊阿依·肉孜 吴八路 梁雨星 周芙玲
急性髓性白血病(AML)是以骨髓母细胞克隆性增殖为特征的血液系统恶性疾病,是成人中最常见的恶性髓性疾病[1]。目前研究及临床实践表明,结合融合基因表达、基因突变、染色体核型和特异分子标志物等对患者进行危险分层能够为患者治疗方案的选择和预后评估提供重要依据[1-2]。由于AML的异质性,目前近一半的患者无法根据现有分层因素进行准确分类[2]。因此,我们需要探索更多有效指标来区分预后良好和预后不良患者,并为其提供个性化治疗。谷胱甘肽过氧化物酶-1(GPX1)是GXP的家族成员,主要分布于细胞的内质网上,目前被认为是一种与氧化应激相互作用的酶[3]。越来越多的研究表明,GPX1表达的改变或异常与恶性肿瘤、心血管疾病、神经退行性疾病、自身免疫性疾病和糖尿病等密切相关[4]。然而,目前关于GPX1在AML中的研究较少。通过挖掘在线数据库,获得疾病相关性基因已在多种肿瘤中得到应用[5-7]。本研究主要采用生物信息学方法,通过在线数据库挖掘分析GPX1在AML中的表达及其对患者预后的影响,构建与之相互作用的蛋白网络图,富集其参与的主要生物学过程,探索其临床价值,为进一步研究GPX1在AML发生发展过程中的作用提供理论基础。
材料与方法
1.材料:通过癌症基因组图谱(TCGA)数据库、基因组织表达(GTEx)数据库及阿拉巴马大学伯明翰分校癌症分析(UALCAN)数据库检索并下载151例AML患者(AML组)和70例正常受试者(正常对照组)的临床资料。以AML患者骨髓细胞中GPX1表达水平的中位数(8.575)为界,将151例AML患者分为高表达组(76例)和低表达组(75例)。
2.方法:通过数据库收集AML组和正常对照组受试者的GPX1表达水平,收集AML组患者的FAB分型、临床资料(性别、年龄、FLT3突变情况、WBC计数、骨髓及外周血原始细胞比例、细胞遗传学中高风险情况)、中位生存时间、1、2、3年生存期及免疫细胞(未成熟树突状细胞、巨噬细胞、自然杀伤细胞、调节性T细胞、辅助性T细胞、记忆T细胞)的单样本基因集富集分析(ssGSEA)评分。
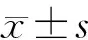
结 果
1.GPX1在AML组和正常对照组中的表达水平比较和诊断价值:通过TCGA和GTEx数据库检索发现AML组患者GPX1表达水平显著高于正常对照组(8.575±0.885比0.623±0.338,P<0.001)。UALCAN数据库检索结果显示,GPX1在非M3型AML组患者中表达水平显著高于M3型AML组(9.098±0.771比7.792±0.986,P<0.001)。ROC曲线分析结果显示,GPX1能准确区别AML患者和健康人群,GPX1预测AMLROC曲线下面积(AUC)为0.987(95%CI0.976~0.998),见图1。此外,进一步的ROC曲线分析结果显示,GPX1鉴别M4型AML和M5型AML时也具有一定的诊断价值,GPX1预测M5型AML的AUC为0.713(95%CI0.543~0.882),见图2。

图1 GPX1预测AML的ROC曲线 图2 GPX1预测M4型AML及M5型AML的ROC曲线
2.低表达组和高表达组AML患者的临床资料比较:高表达组AML患者WBC计数高于低表达组(P=0.001),而两组间性别、年龄、骨髓及外周血原始细胞比例、细胞遗传学中高风险及FLT3突变患者比例比较差异均无统计学意义(P>0.05)。见表1。

表1 低表达组和高表达组AML患者的临床特征比较[M(P25,P75)]
3.影响AML患者预后的单因素和多因素分析:单因素和多因素Cox分析结果显示,年龄、细胞遗传学及GPX1表达水平均为AML患者预后的独立预测因素(P<0.001)。见表2。
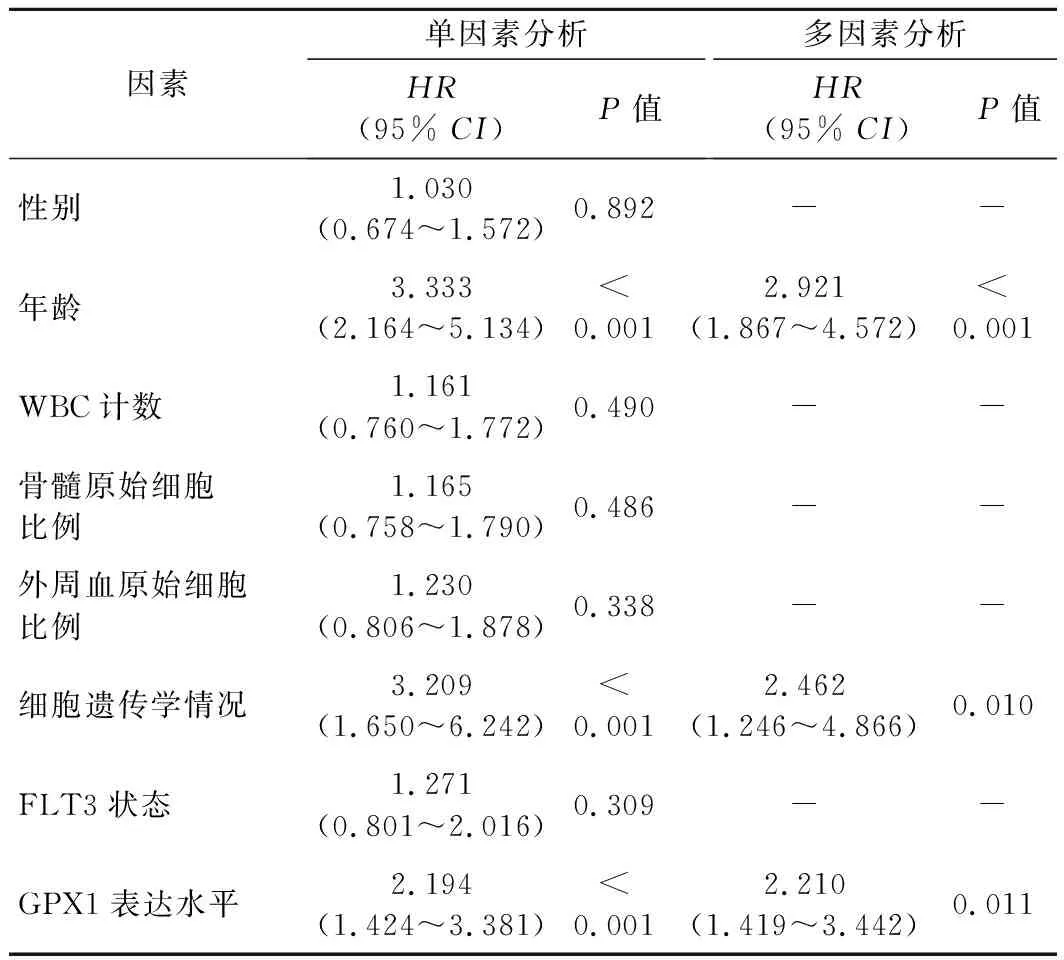
表2 影响AML患者预后的单因素和多因素分析
4.GPX1的表达水平与AML患者生存期的关系:Kaplan-Meier生存分析曲线结果显示,高表达组中位生存时间(9.2个月)低于低表达组(27.4个月,HR=2.19,95%CI1.42~3.38,P<0.001)。见图3。ROC曲线分析结果显示,GPX1表达水平预测AML患者1、2、3年生存期的AUC分别为0.669(95%CI0.573~0.765)、0.653(95%CI0.550~0.757)、0.636(95%CI0.516~0.756)。见图4。

图3 高表达组和低表达组患者Kaplan-Meier生存分析曲线 图4 GPX1预测AML患者1、2、3年生存期价值的ROC曲线
5.低表达组和高表达组AML患者不同免疫细胞的富集评分比较:高表达组患者未成熟树突状细胞、巨噬细胞、自然杀伤细胞、调节性T细胞的富集评分均高于低表达组,辅助性T细胞及记忆T细胞的富集评分均低于低表达组(P<0.01)。见表3。
6.AML患者GPX1表达水平与免疫细胞的相关性分析:Spearman相关分析结果显示,GPX1在AML患者中的表达水平与未成熟树突状细胞(r=0.489)、巨噬细胞(r=0.385)、自然杀伤细胞(r=0.342)、调节性T细胞(r=0.350)的富集评分均呈显著正相关,而与辅助性T细胞(r=-0.375)、记忆T细胞(r=-0.332)的富集评分均呈显著负相关(P<0.05)。
讨 论
根据最新的统计数据,每年新发的白血病约占全球所有新发恶性肿瘤病例的2.5%,而新发的白血病死亡患者约为3.1%[8]。随着社会老龄化,AML的发病率可能呈显著上升趋势,对人民的健康危害越来越凸显。近年来,随着人们对AML研究的进一步深入,越来越多的生物学分子被发现在白血病的发生、发展过程中起着关键作用,有一部分已经被应用于白血病的靶向治疗,给患者带来希望。
目前研究表明,活性氧(ROS)在肿瘤细胞内可能是一把双刃剑:一方面,高水平的ROS与肿瘤的发生、转化和化疗耐药有关[9-11];另一方面,过量的ROS可引起肿瘤细胞的凋亡,而抗氧化酶催化的还原反应能够抵消肿瘤细胞中过量的ROS水平,以避免氧化应激产生的不利影响[12]。抗氧化酶系统主要由超氧化物歧化酶、硫氧还蛋白过氧化物酶、谷胱甘肽过氧化物酶、过氧化氢酶等组成[10]。在哺乳动物中,GPX家族由8个成员(GPX1~GPX8)组成,其中5个(GPX1~GPX4和GPX6)在催化中心含有硒代半胱氨酸,另外三个则是含半胱氨酸的蛋白质[3]。GPX1是迄今为止鉴定出的5种GPX同工酶中表达水平最丰富的并且普遍存在于各种细胞中的一种酶,并广泛表达在细胞的细胞质和线粒体上,是细胞抗氧化防御的重要组分,且和多种疾病的发生发展密切相关[13-15]。研究发现,GPX1参与肿瘤的多种生物学功能,如增殖、侵袭、转移、凋亡和化疗耐药性[13,16]。例如GPX1的mRNA和蛋白质在急性T淋巴细胞白血病(T-ALL)细胞中明显过表达,功能试验结果表明GPX1沉默显著抑制T-ALL细胞的增殖能力并诱导其凋亡[17]。基因调控网络表明,GPX1主要参与包括谷胱甘肽代谢、细胞周期调控、铁死亡、TP53调控代谢基因、ROS代谢过程和其他几个信号通路在内的多种通路[4,13,18]。
本研究中我们通过生物信息学分析发现GPX1在正常人群中低表达,而在AML患者中显著高表达,且其表达水平在AML各亚型中也不同。ROC曲线分析结果显示GPX1预测AML的AUC较高。此外,GPX1在鉴别M4型AML和M5型AML方面也具有一定价值。Kaplan-Meier生存分析曲线结果显示,高表达组患者的中位生存时间低于低表达组,提示GPX1可能是AML患者潜在的分子预后标志物。单因素和多因素Cox分析结果显示,GPX1的表达水平对于AML患者而言是除了年龄、细胞遗传学外的又一个重要的独立预测因子。Spearman相关分析结果显示,GPX1的表达水平与未成熟树突状细胞、巨噬细胞、自然杀伤细胞、调节T细胞富集评分均呈正相关,而与辅助T细胞、记忆T细胞富集评分均呈负相关。这些结果均提示我们,GPX1可能在AML肿瘤微环境中免疫细胞的募集和调节中发挥了重要作用。已有研究表明,活化的调节性T细胞和树突状细胞能够促进肿瘤转移[19-20],提示GPX1可能在AML患者肿瘤细胞浸润、转移方面也起到一定作用。
综上所述, 本研究通过对在线数据库中AML GPX1基因信息的深入挖掘和系统分析,发现GPX1在AML中高表达,且与AML患者不良预后密切相关,可能在AML的发生发展过程中发挥了促癌作用。此外,我们对不同免疫细胞ssGSEA评分与AML患者GPX1表达水平的相关分析发现GPX1可能在AML的发生发展中通过调节白血病细胞免疫微环境而发挥作用。总之,对于AML患者而言,GPX1可能是一种独立的预后因子和一种新的潜在生物标志物,能够用于预测AML患者的疾病进展,并可为AML的新药设计和治疗策略的选择提供参考。本研究也存在一定的局限性:研究结果均由生物信息学分析在线数据获得,尚需进一步的临床样本及试验验证。

