硼替佐米不同给药途径治疗多发性骨髓瘤的疗效及其与周围神经病变的相关分析
王科 苏梅芳 王萌 陈珍 许梦阳 刘丹兰 孙元利
多发性骨髓瘤(MM)是血液系统恶性疾病,中老年人为其好发人群。传统化疗治疗MM完全缓解(CR)率仅约5%,且在短时间内患者会出现病情进展及复发[1-2]。硼替佐米是一种靶向治疗药物,为可逆性的蛋白酶抑制剂,能够明显延长MM的生存时间,显著提高生活质量[3-4]。但硼替佐米治疗后会引发患者周围神经病变(PN),其临床表现主要有疼痛、手足麻木等,对患者的生活质量造成严重影响,并限制了硼替佐米的应用。相关研究资料显示,硼替佐米治疗MM后发生PN的几率为40%~60%[5],但目前硼替佐米疗效和PN的相关研究尚少。本文探讨硼替佐米不同给药途径治疗MM的疗效,并分析其与PN的关系。
对象与方法
1.对象:纳入2017年1月~2021年12月于我院诊治的MM患者84例。纳入标准:(1)经蛋白电泳、影像学、血清免疫球蛋白定量、骨髓穿刺等确诊为MM,且符合《中国多发性骨髓瘤诊治指南(2017年修订)》[6]中有关MM的诊断标准;(2)均为初始治疗;(3)卡氏评分>70。排除标准:(1)其他恶性肿瘤;(2)对硼替佐米不耐受;(3)行造血干细胞移植;(4)血液系统疾病;(5)先天性免疫系统疾病;(6)呼吸系统疾病;(7)严重感染性疾病;(8)重要脏器发生器质性病变;(9)妊娠及哺乳期;(10)临床随访记录不详细。根据给药途径的不同将84例患者分为皮下组(43例)和静脉组(41例)。本研究通过我院伦理委员会审核批准,所有患者均签署知情同意书。
2.方法
(1)基线资料收集:包括性别、年龄、疾病类型(IgA型、IgD型、IgG型、轻链型)、国际分期系统(ISS)分期情况(Ⅰ期、Ⅱ期、Ⅲ期)及糖尿病病史。
(2)治疗方法:两组患者均予预防性抗疱疹病毒治疗,并对其肝、胃进行对症治疗。在每个疗程的第1天、第4天、第8天、第11天予1.3 mg/m2的硼替佐米注射。皮下组患者采用生理盐水1.4 ml混合硼替佐米于大腿外侧或双侧腹部皮下注射。静脉组患者采用生理盐水按照1∶1比例混合稀释硼替佐米,在外周静脉进行快速推注。3周为1个疗程,共治疗10个疗程。
(3)观察指标:治疗10个疗程后,按照《中国多发性骨髓瘤诊治指南(2017年修订)》[6]评判临床疗效。经免疫球蛋白、尿、血固定电泳检查结果均为阴性,且骨髓内的浆细胞水平<5%,则为CR;经尿、血固定电泳检查结果为阴性,而免疫球蛋白固定电泳检查结果为阳性,则为非常好的部分缓解(VGPR);血清M蛋白下降幅度>50%,且24 h尿蛋白水平<0.2 g,则为部分缓解(PR);不在CR、VGPR、PR的范围内,则为无效(NR)。总有效率(%)=[CR(例)+VGPR(例)+PR(例)]/总例数(例)×100%。
(4)不良反应:记录不良反应发生情况,包括WBC计数及PLT计数减少、腹泻、感染、乏力、肝功能损伤、PN。根据美国国立癌症研究所通用毒性标准4.0版(NCI CTC-4.0)[7]对PN分级进行诊断:PNⅠ级:肌肉稍微有收缩;PNⅡ级:不对抗地心引力的方向,能够达到关节的完全动度;PNⅢ级:对抗地心引力的方向,能够达到关节的完全动度,但是不能加任何阻力;PNⅣ级:对抗地心引力的方向,且加一定的阻力,也能够达到关节的完全动度。
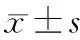
结 果
1.两组患者基线资料比较:皮下组和静脉组年龄、疾病类型、ISS分期及糖尿病病史患者比例比较差异均无统计学意义(P>0.05)。见表1。

表1 两组患者基线资料比较[例,(%)]
2.两组患者临床疗效比较:两组患者临床治疗总有效率比较差异无统计学意义(P>0.05)。见表2。

表2 两组患者临床疗效比较[例,(%)]
3.两组患者不良反应情况比较:两组患者WBC计数及PLT计数减少、腹泻、感染、乏力、肝功能损伤发生率比较差异均无统计学意义(P>0.05)。皮下组患者PN发生率低于静脉组(P<0.05)。见表3。

表3 两组患者不良反应情况比较[例,(%)]
4.两组患者PN分级比较:两组PN不同分级患者比例比较差异均无统计学意义(P>0.05)。见表4。
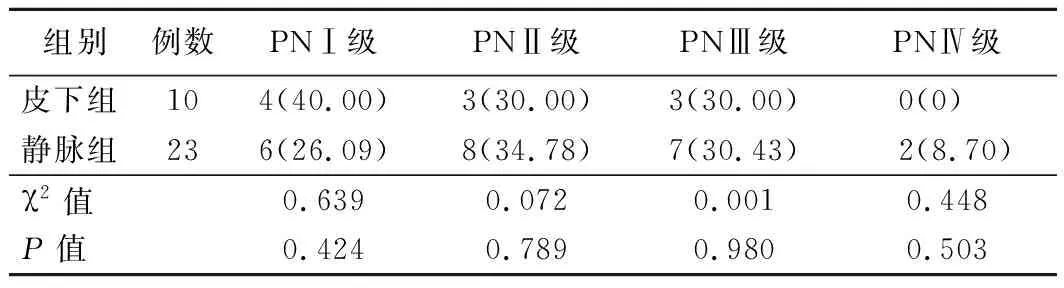
表4 两组患者PN分级比较[例,(%)]
5.MM患者临床疗效与PN分级的关系:Kendall’stau-b相关分析结果显示,MM患者临床疗效与PN呈负相关(r=-0.306,P=0.001)。
讨 论
硼替佐米可抑制细胞内的核转录因子(NF)-κB活性,减少IL-6分泌,引导MM细胞凋亡[8-9]。同时,硼替佐米还会干扰细胞,使其不能够从G1期进入S期,导致细胞死亡,抑制血管生成,对细胞黏附分子的表达进行下调[10]。本研究结果表明,皮下注射和静脉注射硼替佐米治疗MM的效果相当。
硼替佐米引发的PN是MM治疗期间常见并发症,其神经症状可能持续多月,严重时会发生小腿肌肉萎缩,行走困难,导致药物剂量减少甚至停止用药,影响临床疗效。硼替佐米引发的PN主要病理机制可能包括以下4项[11]:(1)通过对NF-κB的信号通路进行抑制,下调抗凋亡靶基因,并上调促凋亡蛋白Noxa,阻碍神经营养蛋白合成,导致神经元细胞凋亡。(2)在神经元中蓄积毒性导致PN。(3)微管的稳定性及聚合和PN有关。(4)遗传因素、自身免疫性因素、炎症等。硼替佐米引发的PN最早发生在硼替佐米治疗的2~3个月,即第3~4个周期;在治疗的第5个周期硼替佐米的累积量为26 mg/m2,达到高峰;至第8个周期PNⅢ级的发生率达到平台期。本研究结果表明,皮下注射患者PN发生率较低。分析其原因在于硼替佐米采用皮下注射时,其在血浆中达到的最大浓度仅为静脉注射的10%,且皮下注射达到血浆最大浓度的时间也较静脉注射的时间长,而硼替佐米引发的PN是呈剂量累积性的毒性,皮下注射吸收较为缓慢,达到的血浆最大浓度相对较低且时间相对较长,因此引起的PN也相对较少[12]。硼替佐米导致的PNⅠ级和PNⅡ级在停止使用硼替佐米3个月左右可恢复,PNⅢ级和PNⅣ级则需更长时间恢复。尤文(ω-3鱼油脂肪乳注射液)是一种脂肪乳,可调节ω-3和ω-6脂肪酸的比例,对过度炎症反应起到阻断作用,从而保护重要的器官功能,可用于改善PN。本研究进一步行Kendall’stau-b相关分析,结果显示MM患者临床疗效与PN呈负相关,与曹亚峰等[13]的研究结果一致。
综上所述,皮下注射和静脉注射硼替佐米治疗MM的效果相当,但皮下注射可降低PN的发生率,临床疗效较好,PN发生率较低,且PN损伤较小。

